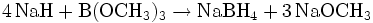- Natriumboranat
-
Strukturformel 
Allgemeines Name Natriumborhydrid Andere Namen - Natriumboranat
- Natriumtetrahydroborat
- Natriumtetrahydridoborat
Summenformel NaBH4 CAS-Nummer 16940-66-2 Kurzbeschreibung weißes Pulver[1] Eigenschaften Molare Masse 37,83 g/mol Aggregatzustand fest
Dichte 1,07 g·cm–3[2]
Schmelzpunkt ca. 400 °C[2]
Siedepunkt ca. 500 °C (Zersetzung)[2]
Löslichkeit heftige Zersetzung in Wasser[2]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 

Giftig Leicht-
entzündlich(T) (F) R- und S-Sätze R: 15-24/25-35 S: 7/8-26-36-43-45 LD50 Oral: 160 mg/kg (Ratte)
Dermal: 230 mg/kg (Hase)[2]WGK 2[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumborhydrid ist ein Komplexsalz, bestehend aus einem Natriumkation (Na+) und einem komplexen Tetrahydroboratanion (BH4-). Die Verbindung ist ein Reduktionsmittel und wird häufig in der organischen Chemie eingesetzt.
Inhaltsverzeichnis
Geschichte
Natriumborhydrid wurde 1942 in der Arbeitsgruppe um Professor Hermann Irving Schlesinger an der University of Chicago im Rahmen von Arbeiten zur Isolierung von flüchtigen Uranverbindungen entdeckt. Der spätere Nobelpreisträger Herbert Charles Brown war wesentlich an diesen Arbeiten beteiligt. Während des Zweiten Weltkriegs wurde, auf Anregung des US Army Signal Corps, in der gleichen Arbeitsgruppe die Hydrolyse von Natriumborhydrid zur Wasserstofferzeugung für militärische Anwendungen untersucht. Aus Geheimhaltungsgründen wurden die Forschungsergebnisse zu Natriumborhydrid aber erst 1953 veröffentlicht.[3] In den 1960er Jahren wurden erste Versuche zum Einsatz von Natriumborhydrid-Lösungen in Brennstoffzellen gemacht.
Eigenschaften
Mit Wasser wird es unter Hydrolyse und Bildung elementaren Wasserstoffs zersetzt. Dies geschieht nur bei niedrigen pH-Werten relativ schnell, so dass die Verbindung auch in wässrigen und alkoholischen Lösungsmitteln eingesetzt werden kann.[4]
Natriumborhydrid ist ein starkes Reduktionsmittel. Die Reaktion mit Metallionen kann entweder zur Reduktion des Metalls, zur Bildung von Metallboriden oder zur Bildung von flüchtigen Metallhydriden führen.
Durch seine reduzierende Wirkung greift Natriumborhydrid organisches Gewebe an, daher ist jeglicher Kontakt, auch mit der Haut, zu vermeiden.
Darstellung
Natriumborhydrid wird aus dem Alkalimetallhydrid Natriumhydrid (NaH) und Trimethylborat (B(OCH3)3) dargestellt.[3] Die Reaktionsgleichung lautet:
Verwendung und Reaktionen
Natriumborhydrid wird vor allem in der organischen Chemie als Reduktionsmittel beziehungsweise Hydrierungsmittel benutzt. Durch die Polarisierung der Bor-Wasserstoff-Bindung kann die Verbindung als Hydridionen-Donator fungieren; der Wasserstoff wird mit seinen Bindungselektronen übertragen. Dieses Teilchen ist ein starkes Nukleophil und reagiert leicht zum Beispiel mit Carbonylgruppen und reduziert sie zum entsprechenden Alkohol, der nach sauer-wässriger Aufarbeitung erhalten wird. Besonders geeignet ist es für Reaktionen in wässrigen oder methanolischen Lösungen, da es bei weitem nicht so heftig mit Wasser reagiert wie beispielsweise Lithiumaluminiumhydrid.[5][6] Dies macht das Reagens besonders in der Zuckerchemie wertvoll.
In der analytischen Chemie wird Natriumborhydrid verwendet, um Halbmetalle wie Arsen und Selen in flüchtige Verbindungen umzusetzen, die sich leichter mit der Atomabsorptionsspektrometrie nachweisen lassen (Hydrid-AAS).[7]
Eine weitere ins Auge gefasste Verwendungsmöglichkeit für Natriumborhydrid ist der Einsatz in Brennstoffzellen so genannter Wasserstoffautos, hier existiert der von DaimlerChrysler gebaute Prototyp Natrium.[8] Das Funktionsprinzip ist eine katalytische Hydrolyse des Borhydrids, wodurch elementarer Wasserstoff entsteht, welcher in der Brennstoffzelle eingesetzt wird. Das Produkt ist Natriummetaborat (NaBO2), das durch Reaktion mit Wasserstoff wieder als Treibstoff nutzbar gemacht werden kann.[9]
Quellen
- ↑ a b Sicherheitsdatenblatt Merck
- ↑ a b c d e f Sicherheitsdatenblatt (carl roth)
- ↑ a b H. I. Schlesinger, H. C. Brown, B. Abraham, A. C. Bond, N. Davidson, A. E. Finholt, J. R. Gilbreath, H. Hoekstra, L. Horvitz, E. K. Hyde, J. J. Katz, J. Knight, R. A. Lad, D. L. Mayfield, L. Rapp, D. M. Ritter, A. M. Schwartz, I. Sheft, L. D. Tuck, A. O. Walker: New developments in the chemistry of diborane and the borohydrides. General summary, in: Journal of the American Chemical Society 1953, 75, 186–90; doi:10.1021/ja01097a049.
- ↑ L. Banfi, E. Narisano, R. Riva, N. Stiasni, M. Hiersemann: Sodium Borohydride, in: Encyclopedia of Reagents for Organic Synthesis 2004, J. Wiley & Sons, New York; doi:10.1002/047084289X.rs052.
- ↑ H. R. Christen, F. Vögtle: Organische Chemie - Von den Grundlagen zur Forschung. 2. Auflage, Otto Salle Verlag, Frankfurt a. Main 1996, S. 821; ISBN 3-7935-5398-1.
- ↑ Autorenkollektiv: Organikum, 22. Auflage, Wiley-VCH, Weinheim, 2001, 568–569; ISBN 3-527-29985-8.
- ↑ Umweltprobenbank des Bundes
- ↑ Brennstoffzellenforschung bei Daimler
- ↑ Patent DE102006041958B3. [1]
Wikimedia Foundation.