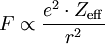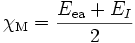- Pauling-Skala
-
Elektronegativität (Abkürzung EN; Formelzeichen χ (gr.: Chi)) ist ein relatives Maß für die Fähigkeit eines Atoms, in einer chemischen Bindung das Bindungselektronenpaar an sich zu ziehen (Linus Pauling). Sie wird unter anderem von der Kernladung und dem Atomradius bestimmt (Erläuterungen zu den Zusammenhängen sind in den Abschnitten der einzelnen Skalen nachzulesen). Die Elektronegativität kann daher als Anhaltspunkt für die Polarität und den Ionenbindungscharakter einer Bindung genommen werden: Je höher der Unterschied in der Elektronegativität der gebundenen Elemente, desto polarer ist die Bindung.
Atome mit hoher Elektronegativität bezeichnet man auch als elektronegativ, solche mit geringer Elektronegativität als elektropositiv. Die Elektronegativität nimmt in der Regel innerhalb einer Elementperiode von links nach rechts zu und innerhalb einer Elementgruppe von oben nach unten ab, dies darf nicht mit der Säurestärke verwechselt werden, die von oben nach unten aufgrund des Ionenradius zunimmt.
Allerdings existiert keine wirklich eindeutige Methode zur Messung der EN. Die Hauptschwierigkeit dabei ist, dass sich die EN auf das Verhalten eines bestimmten Atoms in einem Atomverband – in einer Einfachbindung! – bezieht und nicht auf einzelne, voneinander isolierte Atome im Gaszustand (wie die Ionisierungsenergie und Elektronenaffinität), und dass sie in hohem Maß von der Art und der Anzahl der mit dem betreffenden Atom sonst noch verbundenen Atome abhängt.
Inhaltsverzeichnis
Einteilungssysteme
Das Elektronegativitätsmodell wurde 1932 durch Linus Pauling eingeführt und später mehrmals verfeinert. Heute finden neben der Pauling-Skala auch die Skalen von Allred-Rochow und Mulliken Verwendung.
Allred-Rochow-Skala
Die Elektronegativität nach A. L. Allred und E. G. Rochow wird oft auch mit cAR oder χAR bezeichnet.
Die Skala beruht auf der Überlegung, dass die Elektronegativität proportional zur elektrostatischen Anziehungskraft F ist, die die Kernladung Z auf die Bindungselektronen (von inneren Elektronen abgeschirmt) ausübt:
wobei r der Atomradius, e die Elementarladung und Zeff die effektive Kernladungszahl ist.
Tabelle der Werte nach Allred-Rochow
IUPAC-Gruppe 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Periode 1 H
2,10He 2 Li
0,97Be
1,47B
2,01C
2,50N
3,07O
3,50F
4,17Ne 3 Na
1,01Mg
1,23Al
1,47Si
1,74P
2,06S
2,44Cl
2,83Ar 4 K
0,91Ca
1,04Sc
1,20Ti
1,32V
1,45Cr
1,56Mn
1,60Fe
1,64Co
1,70Ni
1,75Cu
1,75Zn
1,66Ga
1,82Ge
2,02As
2,20Se
2,48Br
2,74Kr 5 Rb
0,89Sr
0,99Y
1,11Zr
1,22Nb
1,23Mo
1,30Tc
1,36Ru
1,42Rh
1,45Pd
1,30Ag
1,42Cd
1,46In
1,49Sn
1,72Sb
1,82Te
2,01I
2,21Xe 6 Cs
0,86Ba
0,97La
1,10Hf
1,23Ta
1,33W
1,40Re
1,46Os
1,52Ir
1,55Pt
1,44Au
1,42Hg
1,44Tl
1,44Pb
1,55Bi
1,67Po
1,76At
1,96Rn 7 Fr
0,86Ra
0,97Ac
Rf
Db
Sg
Bh
Hs
Mt
Ds
Rg
Uub
Uut
Uuq
Uup
Uuh
Uus
Uuo
Allred-Rochow-Werte der Elektronegativität im Periodensystem der Elemente
Mulliken-Skala
In der Mulliken-Skala (1934 von Robert S. Mulliken vorgeschlagen) wird die Elektronegativität als Mittelwert aus der Ionisationsenergie EI und der Elektronenaffinität Eea (electron affinity) berechnet:
Diese Energie wird in Elektronenvolt angegeben.
Tabelle der Werte nach Mulliken
IUPAC-Gruppe 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Periode 1 H
2,10He
2 Li
1,28Be
1,99B
1,83C
2,67N
3,08O
3,21F
4,42Ne 3 Na
1,21Mg
1,63Al
1,37Si
2,03P
2,39S
2,65Cl
3,54Ar 4 K
1,03Ca
1,30Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
1,34Ge
1,95As
2,26Se
2,51Br
3,24Kr 5 Rb
0,99Sr
1,21Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
1,83Sb
Te
2,34I
2,88Xe 6 Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn 7 Fr
Ra
Ac
Rf
Db
Sg
Bh
Hs
Mt
Ds
Rg
Uub
Uut
Uuq
Uup
Uuh
Uus
Uuo
Pauling-Skala
Das Pauling-Modell beruht auf der Elektronegativitätsdifferenz zweier Atome A und B als Maß für den ionischen Anteil ihrer Bindung A-B. Sie setzt die Kenntnis der experimentell ermittelten Bindungsdissoziationsenergien der Moleküle A-B, A2 und B2 voraus.
Die Elektronegativitätsdifferenz zweier Atome A und B ergibt sich gemäß:
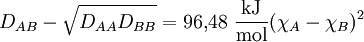
Zur Berechnung der dimensionslosen Elektronegativitätswerte der chemischen Elemente aus der Differenz wurde für Fluor der Wert χF = 3,98 als Referenzpunkt festgelegt.
In der Literatur finden sich oft unterschiedliche Werte für die EN nach Pauling, was auf folgende Gründe zurückzuführen ist:- Die Bindungsdissoziationsenergien sind für manche Elemente bzw. Verbindungen experimentell schwer zugänglich.
- Früher verwendete Referenzwerte waren χF = 4,00 und χH = 0,00 (ursprünglicher Wert für Wasserstoff).
- Statt des geometrischen Mittels
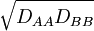 wurde früher auch das arithmetische Mittel
wurde früher auch das arithmetische Mittel 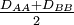 verwendet.
verwendet. - Schließlich finden sich in der Literatur unterschiedliche Werte für den Proportionalitätsfaktor.
Tabelle der Werte nach Pauling
Pauling-Werte der Elektronegativität im Periodensystem der Elemente (wenn nicht anders angegeben Werte nach [1]) IUPAC-Gruppe 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Periode 1 H
2,2He
— [2]2 Li
0,98Be
1,57B
2,04C
2,55N
3,04O
3,44F
3,98Ne
— [2]3 Na
0,93Mg
1,31Al
1,61Si
1,9P
2,19S
2,58Cl
3,16Ar
— [2]4 K
0,82Ca
1Sc
1,36Ti
1,54V
1,63Cr
1,66Mn
1,55Fe
1,83Co
1,88Ni
1,91Cu
1,9Zn
1,65Ga
1,81Ge
2,01As
2,18Se
2,55Br
2,96Kr
3,0[3]5 Rb
0,82Sr
0,95Y
1,22Zr
1,33Nb
1,6Mo
2,16Tc
1,9Ru
2,2Rh
2,28Pd
2,2Ag
1,93Cd
1,69In
1,78Sn
1,96Sb
2,05Te
2,1I
2,66Xe
2,6[3]6 Cs
0,79Ba
0,89La*
1,1Hf
1,3Ta
1,5W
1,7Re
1,9Os
2,2Ir
2,2Pt
2,2Au
2,4Hg
1,9Tl
1,8Pb
1,8Bi
1,9Po
2At
2,2Rn
— [2]7 Fr
0,7Ra
0,9Ac**
1,1Rf
—Db
—Sg
—Bh
—Hs
—Mt
—Ds
—Rg
—Uub
—Uut
—Uuq
—Uup
—Uuh
—Uus
—Uuo
—Lanthanoide *
La
1,1Ce
1,12Pr
1,13Nd
1,14Pm
1,13[4]Sm
1,17Eu
1,2[4]Gd
1,2Tb
1,1[4]Dy
1,22Ho
1,23Er
1,24Tm
1,25Yb
1,1[4]Lu
1,27[4]Actinoide **
Ac
1,1Th
1,3Pa
1,5U
1,7Np
1,3Pu
1,28[4]Am
1,13[4]Cm
1,28[4]Bk
1,3[4]Cf
1,3[4]Es
1,3[4]Fm
1,3[4]Md
1,3[4]No
1,3[4]Lr
1,3[4]
Eigenschaften der Atome der Hauptgruppen im Periodensystem (von links nach rechts):- Atomradius nimmt ab
- Ionisierungsenergie nimmt zu
- Elektronegativität nimmt zu
Andere Elektronegativitäts-Skalen
Nach L.C. Allen wird die Elektronegativität aus dem Energiezustand der Valenzelektronen berechnet, was eine spektroskopische Bestimmung erlaubt.
R. T. Sanderson führt die Elektronegativität wie Allred & Rochow auf die effektive Kernladung zurück.
Fußnoten und Einzelnachweise
- ↑ David R. Lide: CRC handbook of chemistry and physics : A ready-reference book of chemical and physical data. 87. Aufl. Boca Raton Fla. : CRC Taylor & Francis, 2006 – ISBN 0-8493-0487-3
- ↑ a b c d Für die Pauling-Skala nicht bestimmt, vgl.
L. C. Allen, J. E. Huheey: The definition of electronegativity and the chemistry of the noble gases. In: Journal of Inorganic and Nuclear Chemistry. 42, 1980, S. 1523-1524 (doi:10.1016/0022-1902(80)80132-1).
T. L. Meek: Electronegativities of the Noble Gases. In: Journal of chemical education. 72, Nr. 1, 1995, S. 17-18. - ↑ a b L. C. Allen, J. E. Huheey: The definition of electronegativity and the chemistry of the noble gases. In: Journal of Inorganic and Nuclear Chemistry. 42, 1980, S. 1523-1524 (doi:10.1016/0022-1902(80)80132-1).
T. L. Meek: Electronegativities of the Noble Gases. In: Journal of chemical education. 72, Nr. 1, 1995, S. 17-18. - ↑ a b c d e f g h i j k l m n o Elektronegativität: URL: [1]. – Überprüfungsdatum 2007-07-16– UNI TERRA - Kindler & Gliech GbR Germany
Literatur
- Bücher
- L. Pauling: The nature of the chemical bond and the structure of molecules and crystals. Mei Ya Publications Taipei, 1960.
- Hans R. Christen; Gerd Meyer: Grundlagen der allgemeinen und anorganischen Chemie. Sauerländer, Frankfurt am Main 1997. ISBN 3-7941-3984-4
- Zeitschriftenaufsätze
- Robert S. Mulliken: A New Electroaffinity Scale; Together with Data on Valence States and on Valence Ionization Potentials and Electron Affinities. In: The Journal of Chemical Physics. 2, Nr. 11, 1934, S. 782–793 (doi:10.1063/1.1749394).
- A. L. Allred: Electronegativity values from thermochemical data. In: Journal of Inorganic and Nuclear Chemistry. 17, Nr. 3–4, Mai 1961, S. 215–221 (doi:10.1016/0022-1902(61)80142-5).
- A. L. Allred, E. G. Rochow: A scale of electronegativity based on electrostatic force. In: Journal of Inorganic and Nuclear Chemistry. 5, Nr. 4, 1958, S. 264–268 (doi:10.1016/0022-1902(58)80003-2).
- R. T. Sanderson: Chemical principles revisited: Principles of electronegativity - Part I. General nature. In: Journal of Chemical Education. 65, Nr. 2, 1988, S. 112–118.
- R.T. Sanderson: Chemical principles revisited: Principles of electronegativity - Part II. Applications. In: Journal of Chemical Education. 65, Nr. 3, 1988, S. 227–231.
- L. C. Allen: Electronegativity is the average one-electron energy of the valence-shell electrons in ground-state free atoms. In: Journal of the American Chemical Society. 111, Nr. 25, 1989, S. 9003–9014 (doi:10.1021/ja00207a002).
Weblinks
Wikimedia Foundation.