- Riboflavin-Kinase
-
Flavokinase —
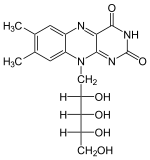
Vorhandene Strukturdaten: 1nb0, 1nb9, 1p4m, 1q9s Größe 155 Aminosäuren Struktur Monomer Kofaktor Zink oder Magnesium Bezeichner Gen-Name RFK Externe IDs UniProt: Q969G6 MGI: 1914688 Enzymklassifikation EC, Kategorie 2.7.1.26 Kinase Reaktionsart Phosphorylierung Substrat Riboflavin + ATP Produkte FMN + ADP Vorkommen Homologie-Familie Riboflavinkinase Übergeordnetes Taxon Eukaryoten Flavokinase (auch Riboflavin-Kinase) ist das Enzym im Vitamin B2-Metabolismus, welches Riboflavin in das Flavinmononukleotid (FMN) umwandelt und daher unentbehrlich für die Synthese des Coenzyms Flavin-Adenin-Dinukleotid (FAD) ist. Flavokinase wird von allen Lebewesen produziert, das Enzym der Archaeen ist aber von dem der Bakterien und Eukaryoten sehr verschieden. Im Menschen ist Flavokinase im Zytoplasma der Zellen von Gehirn, Plazenta und Blase lokalisiert.
Katalysierte Reaktion
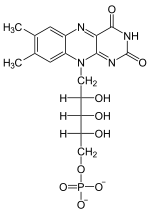
Die katalysierte Reaktion ist eine Phosphorylierung, bei der ein Phosphorsäurerest von einem Nukleotidtriphosphat auf die 5`-Hydroxygruppe des Riboflavins übertragen wird.
Bei bakteriellen und eukaryotischen Riboflavinkinasen (ATP-Riboflavin-5'-Phosphotransferasen, EC 2.7.1.26) ist die katalysierte Reaktion ATP-spezifisch:
- Riboflavin + ATP --(Flavokinase, T3-stimuliert) − − > FMN + ADP
Bei archaealen Riboflavinkinasen (CTP-Riboflavin-5′-Phosphotransferasen, EC 2.7.1.161) verläuft sie CTP-spezifisch [1]:
- Riboflavin + CTP --(Flavokinase) − − > FMN + CDP
Weblinks
Einzelnachweise
- ↑ Ammelburg M, Hartmann MD, Djuranovic S, Alva V, Koretke KK, Martin J, Sauer G, Truffault V, Zeth K, Lupas AN and Coles M. A CTP-Dependent Archaeal Riboflavin Kinase Forms a Bridge in the Evolution of Cradle-Loop Barrels. Structure 2007 (12) 1577–90; PMID 18073108
Wikimedia Foundation.