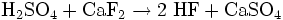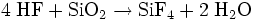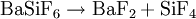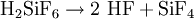- Siliziumfluorid
-
Strukturformel 
Allgemeines Name Siliciumtetrafluorid Andere Namen Silicium(IV)-fluorid
Summenformel SiF4 CAS-Nummer 7783-61-1 Kurzbeschreibung farbloses Gas Eigenschaften Molare Masse 104,1 g/mol Aggregatzustand gasförmig
Dichte 4,681 kg/m3 (0 °C)[1]
Schmelzpunkt −86,8 °C[2]
Siedepunkt −95,2 °C (Sublimation)[2]
Löslichkeit gut löslich in Wasser (unter Zersetzung)[2]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 

Giftig Ätzend (T) (C) R- und S-Sätze R: 23-35 S: 9-26-36-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Siliciumtetrafluorid (SiF4), eine Siliciumverbindung, ist ein farbloses giftiges unbrennbares Gas. Es hat einen stechenden Geruch und ist bei Feuchtigkeit stark rauchend. Es wechselt beim Abkühlen durch Resublimation von der gasförmigen Phase direkt in die feste Phase. Das Gas ist ab einem Druck von 50 atm verflüssigbar.
Inhaltsverzeichnis
Herstellung
Verfahren 1
Hergestellt wird es aus Calciumfluorid und Siliciumdioxid (Sand) mit konzentrierter Schwefelsäure. Folgende Reaktionen laufen ab: Umsetzung von Fluorit zu Fluorwasserstoff
Der Fluorwasserstoff reagiert dann mit dem SiO2
Unter Säureüberschuß wird die Hydrolyse von SiF4 verhindert.
Das so erhaltene SiF4 ist allerdings nur 80–90-prozentig. Es enthält sauerstoffhaltige Produkte wie F3Si–O–SiF3 oder F3Si–O–SiF2–O–SiF3. Beim Transport von SiF4 in Pipelines zerfallen diese Moleküle in SiF4 und SiO2. Dabei setzt das SiO2 die Rohrleitungen zu. Die chemische Industrie hatte das Verfahren des Transportes von SiF4 in Pipelines anstelle des gefährlicheren Fluorwasserstoffs entwickelt, um entferntere Produktionsstätten per Pipeline mit Fluoriden zu versorgen. Aufgrund der geschilderten Probleme fand dieses Verfahren jedoch keine Verbreitung.[3]
Verfahren 2
Beim Erhitzen von Bariumfluorosilikat entsteht SiF4, es kann auch die Hexafluorokieselsäure selbst verwendet werden:[4]
Anwendungen
In der Halbleiterindustrie entsteht es beim Entfernen von SiO2 Schichten auf Wafern mittels Flusssäure.
Quellen
- ↑ Eintrag zu Siliciumtetrafluorid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 17.10.2007 (JavaScript erforderlich)
- ↑ a b c d Sicherheitsdatenblatt (Air Liquide)
- ↑ W. Legat, Dissertation 1978, Giessen
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 212-3.
Weblinks
Wikimedia Foundation.