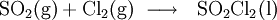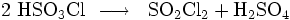- Sulfuryldichlorid
-
Strukturformel 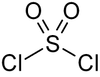
Allgemeines Name Sulfurylchlorid Andere Namen - Schwefelsäuredichlorid
- Sulfuryldichlorid
- Sulfonylchlorid
Summenformel SO2Cl2 CAS-Nummer 7791-25-5 Kurzbeschreibung farblose bis leicht gelbliche Flüssigkeit Eigenschaften Molare Masse 134,97 g·mol−1 Aggregatzustand flüssig
Dichte Schmelzpunkt Siedepunkt 69,4 °C[1]
Dampfdruck 144,3 mbar[1] (20 °C)
Löslichkeit löslich in nicht-protischen, organischen Lösungsmitteln
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Ätzend (C) R- und S-Sätze R: 14-34-37 S: (1/2)-26-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Sulfurylchlorid ist eine farblose, aggressive Flüssigkeit, die zur Gruppe der anorganischen Säurechloride gezählt wird. Es ist das Dichlorid der Schwefelsäure.
Inhaltsverzeichnis
Gewinnung und Darstellung
Es bildet sich aus Schwefeldioxid und Chlor am Aktivkohlekatalysator oder durch Zersetzung von Chlorsulfonsäure:[3]
Eigenschaften
Physikalische Eigenschaften
Sulfurylchlorid ist eine leichtbewegliche, an feuchter Luft rauchende Flüssigkeit, die aufgrund ihres recht niedrigen Siedepunkts von 69 °C leicht verdampft und problemlos durch Destillation gereinigt werden kann. Es hat eine für viele Halogenverbindungen typische hohe Dichte von 1,6674 g·cm-3
Chemische Eigenschaften
Mit Wasser reagiert Sulfurylchlorid unter ausgesprochen heftiger Zersetzung und Wärmeentwicklung zu Schwefelsäure und Chlorwasserstoff:
Weiterhin reagiert es heftig mit Basen sowie mit niederen Alkoholen.
Verwendung
Aus Sulfurylchlorid können durch elektrophile aromatische Substitution aromatische Sulfonsäurechloride (Sulfochloride) hergestellt werden. Weiterhin kann es in Gegenwart eines Radikalstarters zur radikalischen Chlorierung von Alkanen und Cycloalkanen verwendet werden. Bei letzterer Reaktion entstehen als gasförmige Nebenprodukte Schwefeldioxid und Chlorwasserstoff.
Sicherheitshinweise
Sulfurylchlorid ist stark ätzend und greift Haut und besonders Schleimhäute und Augen heftig an. Beim Arbeiten ist ein gut ziehender Abzug zu verwenden und die persönliche Schutzausrüstung zu tragen (Kittel, Schutzbrille, Schutzhandschuhe).
Reste von Sulfurylchlorid müssen unter größter Vorsicht in kleinen Portionen in eine Eis/Wasser-Mischung eingetragen werden. Die dann erhaltene Schwefelsäure-Salzsäure-Mischung wird mit einer geeigneten Base vorsichtig neutralisiert, bevor sie der fachgerechten Entsorgung zugeführt wird.
Quellen
- ↑ a b c d Eintrag zu Sulfurylchlorid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 8.1.2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7791-25-5 im European chemical Substances Information System ESIS
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 383-5.
Weblinks
Wikimedia Foundation.