- Xanthinoxidase
-
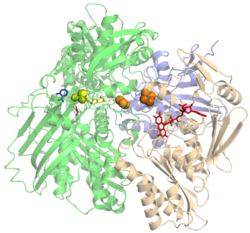
Xanthinoxidase Bändermodell des Monomer der Xanthinoxidase aus Rind, pdb 1FIQ. Gebundene Cofaktoren, FAD (rot), FeS-cluster (orange), Molybdän-Cofactor mit Molybdän (gelb) und der gebundene Inhibitot Salicylat (blau), sind hervorgehoben. Vorhandene Strukturdaten: 2ckj, 2e1q Masse/Länge Primärstruktur 1332 AS; 146 kDa Sekundär- bis Quartärstruktur Homodimer Kofaktor 2Fe-2S, FAD, Molybdopterin Bezeichner Gen-Namen XDH; XO; XS; XDHA Externe IDs OMIM: 607633 UniProt: P47989 MGI: 98973 CAS-Nummer: 9002-17-9 Enzymklassifikation EC, Kategorie 1.17.3.2 Oxidoreduktase Reaktionsart Hydroxylierung Substrat Xanthin + H2O + O2 Produkte Harnsäure + H2O2 Vorkommen Homologie-Familie Xanthindehydrogenase Übergeordnetes Taxon Lebewesen Die Xanthinoxidase (XO, manchmal auch XAO) oder Xanthindehydrogenase (XDH) ist ein Metalloenzym (eine Hydroxylase), welches die Oxidation von Hypoxanthin und Xanthin zu Harnsäure in Niere und Leber katalysiert.
- Hypoxanthin + O2 + H2O → Xanthin + O2− + 2 H+
- Xanthin + O2 + H2O → Harnsäure + O2− + 2 H+
Das aktive Zentrum enthält ein Molybdänatom, gebunden in Form des Molybdän-Cofaktors (MoCo). Jede Untereinheit enthält zudem zwei unterscheidbare Zwei-Eisen-zwei-Schwefel-cluster (2Fe-2S) und ein FAD-Molekül. In Prokaryoten werden die MoCo-, (2Fe-2S)- und FAD- Domäne von zwei bzw. drei Genen kodiert, in Eukaryoten sind die Domänen in einem Gen fusioniert. Das Enzym kommt daher in Eukaryoten als Homodimer vor, in Prokaryoten als Heterotetramer bzw. Heterohexamer.
Erhöhter Harnsäurespiegel ist als Gicht bekannt. Gicht kann daher auch mit einem Inhibitor der Xanthinoxidase behandelt werden; zum Beispiel Allopurinol oder Febuxostat. Allopurinol bindet sich fest an die reduzierte Form der Xanthinoxidase und inaktiviert sie somit. Dadurch wird die Produktion der schwerlöslichen Harnsäure verringert und die Konzentration der besser löslichen Verbindungen Xanthin und Hypoxanthin erhöht.
Literatur
- L. G. Nagler und L. S. Vartanyan: Subunit structure of bovine milk xanthine oxidase. Effect of limited cleavage by proteolytic enzymes on activity and structure. Biochim Biophys Acta. 427/1/1976:78-90- PMID 1260010
- J. J. Truglio et al.: Crystal structures of the active and alloxanthine-inhibited forms of xanthine dehydrogenase from Rhodobacter capsulatus. Structure. 10/1/2002:115-25. PMID 11796116
- S. T. Smith et al.: Purification and properties of xanthine dehydroganase from Micrococcus lactilyticus. J Biol Chem. 242/18/1976:4108-4117. PMID 6061702
Weblinks
-
 Wikibooks: Biochemie und Pathobiochemie: Purinabbau – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Purinabbau – Lern- und Lehrmaterialien -
 Wikibooks: Biochemie und Pathobiochemie: Purin-Stoffwechsel – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Purin-Stoffwechsel – Lern- und Lehrmaterialien
Wikimedia Foundation.