- Caesiumfluorid
-
Kristallstruktur 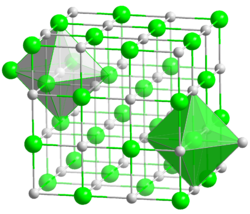
__ Cs+ __ F− Kristallsystem kubisch
Raumgruppe 
Koordinationszahlen Cs[6], F[6]
Allgemeines Name Caesiumfluorid Verhältnisformel CsF CAS-Nummer 13400-13-0 Kurzbeschreibung farbloses, kristalliner Feststoff[1]
Eigenschaften Molare Masse 151,90 g·mol−1 Aggregatzustand fest
Dichte 4,12 g·cm−3[1]
Schmelzpunkt Siedepunkt 1251 °C[1]
Löslichkeit löslich in Wasser (3670 g·l-1 bei 18 °C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Gefahr
H- und P-Sätze H: 301-311-314-331 EUH: keine EUH-Sätze P: 261-280-301+310-305+351+338-310 [2] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20/21/22 S: 36/37 MAK 2,5 mg·m−3 (als Fluorid)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Caesiumfluorid (CsF) ist das Caesiumsalz der Fluorwasserstoffsäure. Es ist ein farbloser, hygroskopischer, kristalliner Feststoff, der sich gut in polaren Lösungsmitteln löst. Es dient in der Chemie neben Tetraalkylammoniumfluoriden (wie Tetrabutylammoniumfluorid TBAF) als Lieferant „nackter“ Fluoridionen und milde Base. Außerdem besitzt es einen stark ausgeprägten ionischen Charakter und ist neben dem instablilen und seltenen Franciumfluorid die Verbindung der beiden Elemente mit dem größtmöglichen Unterschied der Elektronegativitäten.
Inhaltsverzeichnis
Darstellung
Caesiumfluorid lässt sich durch Reaktion von Fluorwasserstoff mit Caesiumcarbonat oder Caesiumhydroxid und anschließende Trocknung erhalten.
Eigenschaften
Aufgrund der guten Löslichkeit und einfachen Verfügbarkeit lässt sich Caesiumfluorid als Fluoridionen-Donator einsetzen. Es ist löslicher als seine Verwandten mit den kleineren Alkalimetallen Natrium und Kalium.
Wegen der nur gering ausgeprägten Nucleophilie der Fluoridionen wird Caesiumfluorid in der Organischen Chemie als milde Base eingesetzt, so z. B. bei der Knoevenagel-Reaktion. Des Weiteren dient es zur Desilylierung, d. h. zu Entfernung von Silyl-Schutzgruppen, da wegen der hohen Bindungsenergie der Si-F-Bindung eine starke Tendenz zur Ausbildung selbiger besteht. Außerdem lässt sich Caesiumfluorid problemlos entwässern, so dass es auch bei säure- und wasserempfindlichen Substraten einsetzbar ist.
 Uhrglasschale mit einer Caesiumfluorid-Probe
Uhrglasschale mit einer Caesiumfluorid-Probe
Sicherheitshinweise
Die Reaktion mit Säuren führt zur Bildung von toxischem Fluorwasserstoff.
Einzelnachweise
- ↑ a b c d e f g Datenblatt Caesiumfluorid bei AlfaAesar, abgerufen am 3. Februar 2010 (JavaScript erforderlich)..
- ↑ a b Datenblatt Caesiumfluorid bei Sigma-Aldrich, abgerufen am 15. März 2011.
Literatur
- G. K. Friestad, B. P. Branchaud, in: Handbook of Reagents for Organic Synthesis: Acidic and Basic Reagents, (H. J. Reich, J. H. Rigby, eds.), S. 99–103, Wiley, New York, 1999.
- L. Rand, J. V. Swisher, C. J. Cronin, Journal of Organic Chemistry 27, S. 3505 (1962).
- M. Fiorenza, A. Mordini, S. Papaleo, S. Pastorelli, A. Ricci, Tetrahedron Letters 26, S. 787 (1985).
- F. W. Evans, M. H. Litt, A. M. Weidler-Kubanek, F. P. Avonda, Journal of Organic Chemistry 33, S. 1837–1839 (1968).
CaesiumhalogenideCaesiumfluorid | Caesiumchlorid | Caesiumbromid | Caesiumiodid
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Cäsiumfluorid — Kristallstruktur Cs+ F Kristallsystem … Deutsch Wikipedia
Uhrenglas — Uhrglas mit einer Caesiumfluorid Probe Uhrgläser (oder: Uhrglasschalen) sind runde, zu den Außenrändern hin leicht konkav gewölbte Glasscheiben mit einem Durchmesser von etwa 4 bis 20 cm, die in der chemischen Labortechnik Anwendung finden. Der… … Deutsch Wikipedia
Alkalihalogenid — Alkalihalogenide sind Salze aus einem positiv geladenen Alkalimetallion und einem negativ geladenen Halogenid: Lithiumfluorid Lithiumchlorid Lithiumbromid Lithiumiodid Natriumfluorid Natriumchlorid Natriumbromid Natriumiodid Kaliumfluorid… … Deutsch Wikipedia
Cesium — Eigenschaften … Deutsch Wikipedia
Chemikalienliste — Die Chemikalienliste stellt eine alphabetisch sortierte Liste von Chemikalien dar, ohne Anspruch auf Vollständigkeit. Elemente sind fett gekennzeichnet, Stoffgruppen kursiv. Der Haupteintrag zu einer Chemikalie ist gleichzeitig der Name des… … Deutsch Wikipedia
Cäsium — Eigenschaften … Deutsch Wikipedia
Kochsalzstruktur — Natriumchlorid Struktur Die für viele Salze typische kubisch flächenzentrierte Kristallstruktur von Natriumchlorid (Kochsalz) ist Prototyp für die Natriumchlorid Struktur bzw. den Natriumchloridtyp. Beispiele für Vertreter dieses Strukturtyps… … Deutsch Wikipedia
Liste chemischer Verbindungen — Die Chemikalienliste stellt eine alphabetisch sortierte Liste von Chemikalien dar, ohne Anspruch auf Vollständigkeit. Elemente sind fett gekennzeichnet, Stoffgruppen kursiv. Der Haupteintrag zu einer Chemikalie ist gleichzeitig der Name des… … Deutsch Wikipedia
Liste von chemischen Verbindungen — Die Chemikalienliste stellt eine alphabetisch sortierte Liste von Chemikalien dar, ohne Anspruch auf Vollständigkeit. Elemente sind fett gekennzeichnet, Stoffgruppen kursiv. Der Haupteintrag zu einer Chemikalie ist gleichzeitig der Name des… … Deutsch Wikipedia
NaCl-Struktur — Natriumchlorid Struktur Die für viele Salze typische kubisch flächenzentrierte Kristallstruktur von Natriumchlorid (Kochsalz) ist Prototyp für die Natriumchlorid Struktur bzw. den Natriumchloridtyp. Beispiele für Vertreter dieses Strukturtyps… … Deutsch Wikipedia


