- Chloridkanal
-
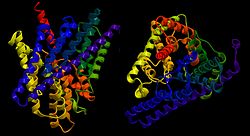
Chloridkanal Bändermodell des ClC von E. coli von der Seite und oben, nach PDB 3NMO Bezeichner Gen-Name(n) CLCN1, CLCN2, CLCN3, CLCN4, CLCN5, CLCN6, CLCN7 Transporter-Klassifikation TCDB 2.A.49 Bezeichnung Chloridkanäle Vorkommen Übergeordnetes Taxon Lebewesen Ausnahmen mehrere Protozoen mit kleinem Genom Als Chloridkanäle werden in der Physiologie und Zellbiologie Transporter bezeichnet, die eine spezifische und mehr oder weniger selektive Leitfähigkeit für Chlorid-Ionen aufweisen. Die Unterfamilie der epithelialen calciumregulierten Chloridkanäle (E-ClC) werden als eigenständige Gruppe gesehen, da ihre Kanalfunktion inzwischen fraglich ist und sie auch nicht die CBS-Domäne der ClC-Familie aufweisen.[1]
Die Proteinfamilie der Chloridkanäle (ClC, abgeleitet vom englischen chloride channel) umfasst Chloridkanäle und sekundär aktive Chlorid/Protonen-Austauscher. Strukturelle Homologe dieser Familie finden sich durch alle biologischen Reiche hinweg, vom einfachen Darmbakterium Escherichia coli über Pflanzen bis hin zu den Säugetieren. Hierbei übernehmen die Kanäle unterschiedliche biologische Funktionen, wie z. B. die Teilhabe an der Regulation des zellulären Wasserhaushaltes oder die Stabilisierung des Ruhemembranpotentials im Skelettmuskel.
Inhaltsverzeichnis
Zur wissenschaftlichen Historie der ClC-Familie
1980 entdeckten Miller et al. den ersten Chloridkanal in Vesikeln des elektrischen Organs des Torpedorochens.[2] Anhand von Einzelkanal-Untersuchungen sagte er einen doppelporigen Kanal voraus, was seither von einer Vielzahl an Untersuchungen verfestigt wurde. In den 1990er Jahren untersuchte Thomas Jentsch die Proteinfamilie auf molekularer Ebene. 2002 löste R. Dutzler röntgenkristallographisch (2.5 -3.5 Å) die Strukturen der ClC-Transporter EcClC und StClC von E. coli bzw. Salmonella typhi und setzte hiermit die Basis für das molekulare Verständnis der Funktion.[3]
Isoformen im Menschen
Im Menschen finden sich neun Isoformen der ClC-Familie. Einige davon werden in den Plasmamembranen exprimiert, andere in den Membranen von intrazellulären Organellen. ClC-1 zum Beispiel findet sich in der Plasmamembran von Zellen des Skelettmuskels und ist in die Stabilisierung des Ruhemembranpotentials involviert.
Die einzelnen humanen Chlorid-Transporter: ClC-1, ClC-2, ClC-3, ClC-4, ClC-5, ClC-6, ClC-7, ClC-8, ClC-9.
Chloridkanäle in Pflanzen
Chloridkanäle erfüllen verschiedene Funktionen in Pflanzen, abhängig von ihrer Lokalisierung und ihrer Ionenaffinität. Am besten untersucht sind die sieben Chloridkanäle von Arabidopsis thaliana, AtCLCa bis AtCLCg.[4] Die Kanäle befinden sich in den Membranen verschiedener Organelle und erfüllen dort die Funktion von Aniontransportern. So transportieren AtCLCa und AtCLCe Nitrat anstelle von Chlorid über Membranen.[5]
Die Struktur
ClC-Transporter und -Kanäle sind rautenförmige Homodimere. Jede Untereinheit besitzt eine eigene sanduhrenförmige Pore mit der engsten Stelle im Zentrum der Membran. Von der extra- und intrazellulären Seite reichen zwei ausgedehnte wassergefüllte Vorhöfe in die Pore hinein, zentral liegt die Pore wasserfrei vor. Es werden drei Ionenbindungstellen angenommen: zwei je an der Kontaktfläche zwischen Vorhof und Poreninnerem und eine im wasserfreien Zentrum. Koordiniert werden die Ionen bei der Permeation hierbei von partiell geladenen Seitenketten-Hydroxylgruppen und einigen Hauptkettenstickstoffatomen, welche gemeinsam den Selektivitätsfilter bilden und die Ionen energetisch durch den hydrophoben Teil der Membran balancieren.
Siehe auch
- Andere Ionenkanäle: Natriumkanal - Kaliumkanal - Calciumkanal
- Mukoviszidose (eine Erkrankung bei verändertem Chloridkanal)
Einzelnachweise
- ↑ TCDB: Epitheliale Chloridkanäle
- ↑ Miller C, White MM. A voltage-dependent chloride conductance channel from Torpedo electroplax membrane. Ann N Y Acad Sci. 1980;341:534-51. PMID 6249158
- ↑ Dutzler R, Campbell EB, Cadene M, Chait BT, MacKinnon R. X-ray structure of a ClC chloride channel at 3.0 A reveals the molecular basis of anion selectivity. Nature. 2002 Jan 17;415(6869):276-7. PMID 11796999
- ↑ Cloning and molecular analyses of the Arabidopsis thaliana chloride channel gene family, Plant Science 2009
- ↑ Two anion transporters AtClCa and AtClCe fulfil interconnecting but not redundant roles in nitrate assimilation pathways, New Phytologist 2009
Literatur
- Jentsch TJ, Stein V, Weinreich F, Zdebik AA: Molecular structure and physiological function of chloride channels. Physiol Rev. 2002 Apr;82(2):503-68. Review. PMID 11917096
Weblinks
- Swiss Institute of Bioinformatics (SIB): PROSITE documentation PDOC51371. CBS-Domäne. Abgerufen am 20. September 2011 (englisch).
Wikimedia Foundation.