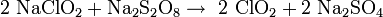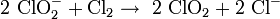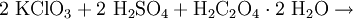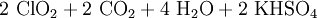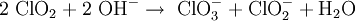- ClO2
-
Strukturformel 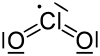
Allgemeines Name Chlordioxid Andere Namen - E926
- Chlor(IV)-oxid
Summenformel ClO2 CAS-Nummer 10049-04-4 PubChem 24870 Kurzbeschreibung gelb-rötliches Gas mit scharfem, erstickendem Geruch Eigenschaften Molare Masse 67,46 g·mol−1 Aggregatzustand gasförmig
Dichte 3,01 g·l−1[1]
Schmelzpunkt −59,5 °C[1]
Siedepunkt 11 °C[1] (Zersetzung ab 45 °C)
Dampfdruck 1,4 bar bei 20°C [1]
Löslichkeit löslich in Wasser (8 g·l−1 bei 4 °C) [2], alkalischen Lösungen und Schwefelsäure[3]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 


Brand-
förderndSehr giftig Umwelt-
gefährlich(O) (T+) (N) R- und S-Sätze R: 6-8-26-34-50 S: (1/2)-23-26-28-36/37/39-38-45-61 MAK 0,1 ml/m3 oder 0,28 mg/m3[1]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Chlordioxid, eine chemische Verbindung aus dem Halogen Chlor und Sauerstoff mit der Formel ClO2, ist bei Standardtemperatur ein gelb-rötliches Gas. Wegen der explosiven Eigenschaften in allen Aggregatzuständen ist bei der Handhabung äußerste Vorsicht angebracht. Es wurde vor 200 Jahren entdeckt und ist damit das erste bekannte Halogenoxid.
Inhaltsverzeichnis
Gewinnung und Darstellung
Im Labormaßstab kann Chlordioxid durch Oxidation von Chlorit gewonnen werden, Oxidationsmittel ist entweder Natriumperoxodisulfat Na2S2O8 oder Chlorgas:
Eine andere Methode ist die Umsetzung von Kaliumchlorat mit konzentrierter Schwefelsäure. Um die Explosionsgefahr zu verringern, wird Oxalsäure zugesetzt, es entsteht ein Chlordioxid-Kohlendioxid-Gemisch:[9]
Für die großtechnische Herstellung eignet sich insbesondere das Chlorit-Salzsäure-Verfahren und das Chlorit-Chlor-Verfahren. Bei diesen Verfahren handelt es sich aufgrund der Spontanbildung von Chlordioxid um für den Anwender sehr gefährliche Darstellungsmöglichkeiten und sie müssen daher unbedingt in entsprechenden Reaktoranlagen durchgeführt werden. Die technische Herstellung von kleinen und mittleren Mengen Chlordioxid unter Einhaltung der MAK-Werte ist dagegen sichergestellt durch das Chlorit - Peroxodisulfat-Verfahren, da es hier zu keiner Spontanbildung von großen Mengen Chlordioxid kommen kann. Die verschiedenen Chlorat-Säure-Reduktionsmittel-Verfahren sind für die Darstellung großer Mengen Chlordioxid geeignet, wie sie z. B. in der Papierindustrie Verwendung finden. Ihr Einsatz bedingt, aufgrund der hohen Explosionsgefahr, zwingend den Einsatz von Reaktoren.
Für die Trinkwasserdesinfektion sind nur die nach DVGW W 224 und W 624 beschriebenen Herstellverfahren zulässig. Da das Regelwerk W 224 den Stand der Technik aus dem Jahre 1986 wiedergibt, sind dort bisher nur das Salzsäure-Chlorit- und das Chlor-Chlorit-Verfahren beschrieben. Das Regelwerk W 224 wird dahingehend überarbeitet, dass auch das in der DIN EN 12671 „Produkte zur Aufbereitung von Wasser für den menschlichen Gebrauch Chlordioxid“ genannte und in der Zeitschrift „Vom Wasser “ (Band 4) aus dem Jahre 2005 beschriebene Peroxodisulfat-Chlorit-Verfahren Aufnahme findet. Die Ausgangsstoffe Natriumperoxodisulfat und Natriumchlorit sind bereits zum heutigen Zeitpunkt als Vorprodukte für die Herstellung von Chlordioxid durch den Gesetzgeber zugelassen.
Eigenschaften
Physikalische Eigenschaften
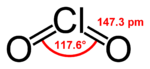
Chlordioxid ist 2,33 mal schwerer als Luft. Es ist paramagnetisch; beim Übergang in den festen Zustand dimerisiert es zu orangeroten Kristallen und wird diamagnetisch. ClO2 ist gewinkelt aufgebaut, der Bindungswinkel beträgt 117°, die Cl–O-Bindungslänge 147 pm.[2] Im Jahr 1933 schlug Lawrence Olin Brockway (1907-1979) eine drei-Elektronen-Bindung vor.[10] Linus Pauling entwickelt diese Idee später zu einer Theorie mit schwächerer Bindung des dritten Elektrons weiter.[11] Spätere Untersuchungen zeigten, dass das ungepaarte dritte Elektron das höchste besetzte Molekülorbital besetzt (HOMO).
Chemische Eigenschaften
Es besitzt eine Masse von 67,46 g·mol−1. Wenn es bei −59 °C gefriert, bilden sich explosive rote Kristalle. In flüssiger Form ist Chlordioxid rotbraun und besitzt einen von Chlor deutlich verschiedenen Geruch. Der Siedepunkt liegt bei ca. 11 °C. Chlordioxid ist in reinem Wasser gut löslich;[2] die Lösungen sind gelb bis dunkelgrün gefärbt und über einen weiten pH-Bereich erstaunlich unempfindlich gegen Hydrolyse, zu der Chlordioxid als gemischtes Anhydrid der Chlorsäure und der Chlorigen Säure eigentlich neigen sollte. Bei pH-Werten über 10 und unter 5,5 setzen jedoch bereits erhebliche Disproportionierungen ein, die je nach pH-Wert zu Chlorat-/Chloridbildung oder Chlorat-/Chloritbildungen führen.[9][12]
Beim Einbringen von ClO2 in alkalische Lösungen läuft diese Reaktion stürmisch ab. Auch Licht beschleunigt die Zersetzung in Wasser.[2]
Wässrige Lösungen sind nicht explosiv, soweit sie kein Chlordioxid-Luft-Gemisch von 10 Vol. % Chlordioxid erzeugen können. Dies ist bei Raumtemperatur bei wässrigen Lösungen mit einem Chlordioxidgehalt von mehr als 6 g/L gegeben. Chlordioxidlösungen mit einer Konzentration über 30 g/L explodieren bereits unter Luftabschluss.
ClO2 und dessen wässrige Lösungen wirken stark oxidierend wobei je nach Reduktionspartner Chloride, Chlorite oder Hypochlorite entstehen können. Eine Oxidation von ClO2 ist unter anderem mit Fluor F2, Ozon O3 und rauchender Schwefelsäure möglich.[2]
Verwendung
Chlordioxid (E926) wird zum Bleichen in der Textil-, Cellulose- und Papierindustrie verwendet und hat dort Chlor weitgehend ersetzt. Es findet Verwendung bei der Trinkwasserdesinfektion (Desinfektion), wo es ebenfalls Chlor in einzelnen Ländern weitgehend ersetzt hat, da es im Gegensatz zu Chlor auch stark viruzid und gegen viele Protozoen wirksam ist. Der Mindestwert an gelösten Chlordioxid soll für die Desinfektion 0,05 mg pro Liter betragen. Als Höchstwert für das im Wasser gebildete Chlorit gelten 0,2 mg pro Liter.[13] Es erstaunlich, dass höhere Organismen sehr unempfindlich gegen Chlordioxid sind. Die Toleranzschwelle für Chlordioxid liegt bei Vertebraten bei mehr als dem Zwanzigfachen dessen, was üblicherweise zur Trinkwasserdesinfektion eingesetzt wird. Chlordioxid hat im Gegensatz zu Chlor keinen negativen Einfluss auf den Geruch und Geschmack von Wasser.
Des Weiteren wird Chlordioxid zunehmend auch bei der Abfüllung von PET-Flaschen zur Desinfektion genützt. Es wird auch zur Desodorierung übelriechender Abfälle und Abwässer verwendet. Für Letzteres ist es geeignet, da es im Gegensatz zu Chlor nicht chlorierend wirkt und daher keine persistenten Organochlorverbindungen in die Umwelt entlässt.
Im Labor findet Chlordioxid Verwendung bei der Herstellung von Chloriger Säure.
Quellen
- ↑ a b c d e Eintrag zu CAS-Nr. 10049-04-4 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 15.10.2007 (JavaScript erforderlich)
- ↑ a b c d e A.F. Holleman und N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, S. 482–485, Berlin 2007, Walter de Gruyter, ISBN 978-3-11-017770-1.
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006
- ↑ Eintrag zu CAS-Nr. 10049-04-4 im European chemical Substances Information System ESIS
- ↑ Datenblatt bei microbansystems (englisch)
- ↑ S. Gangolli: The Dictionary of Substances and Their Effects. Royal Society of Chemistry, 1999, ISBN 0-85404-813-8; ISBN 9780854048137
- ↑ JAT, Journal of Applied Toxicology. Vol. 2, Pg. 160, 1982.
- ↑ AMA Archives of Industrial Health. Vol. 15, Pg. 101, 1957.
- ↑ a b G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry. 2nd ed., vol. 1, Academic Press 1963, ISBN 012126601X S. 302
- ↑ The Three-Electron Bond in Chlorine Dioxide; L. O. Brockway Proc Natl Acad Sci U S A. 1933 March; 19(3): 303–307. elektronische Version (englisch)
- ↑ General Chemistry By Linus Pauling Published by Courier Dover Publications, 1988, ISBN 0-486-65622-5, ISBN 9780486656229, 992 pages
- ↑ Willy J. Masschelein: Chlorine Dioxide: Chemistry and Environmental Impact of Oxychlorine Compounds. Ann Arbor Science 1979; ISBN 0-2504-0224-6
- ↑ Michael Binnewies, Manfred Jäckel und Helge Willner: Allgemeine und Anorganische Chemie. Spektrum Akademischer Verlag 2004, 1. Auflage; ISBN 3-827-40208-5
Literatur
- Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. Gruyter Verlag; 102., stark umgearb. u. verb. Auflage 2007; ISBN 978-3-11-017770-1; S. 482ff.
Wikimedia Foundation.