- Cuprum
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Kupfer, Cu, 29 Serie Übergangsmetalle Gruppe, Periode, Block 11, 4, d Aussehen lachsrosa, metallisch CAS-Nummer 7440-50-8 Massenanteil an der Erdhülle 0,01 % Atomar Atommasse 63,546 u Atomradius (berechnet) 135 (145) pm Kovalenter Radius 138 pm Van-der-Waals-Radius 140 pm Elektronenkonfiguration [Ar]3d104s1 Elektronen pro Energieniveau 2, 8, 18, 1 Austrittsarbeit 4,44 eV 1. Ionisierungsenergie 745,5 kJ/mol 2. Ionisierungsenergie 1957,9 kJ/mol 3. Ionisierungsenergie 3555 kJ/mol 4. Ionisierungsenergie 5536 kJ/mol Physikalisch Aggregatzustand fest Kristallstruktur kubisch flächenzentriert Dichte 8920 kg/m3 (8,92 g/cm3) Mohshärte 3,0 Magnetismus diamagnetisch Schmelzpunkt 1357,6 K (1084,4 °C) Siedepunkt 2840 K (2567 °C) Molares Volumen 7,11 · 10-6 m3/mol Verdampfungswärme 300,3 kJ/mol Schmelzwärme 13,05 kJ/mol Dampfdruck 0,0505 Pa bei 1358 K Schallgeschwindigkeit 3570 m/s bei 293,15 K Spezifische Wärmekapazität 385 J/(kg · K) Elektrische Leitfähigkeit 58 · 106 A/(V · m) Wärmeleitfähigkeit 401 W/(m · K) Chemisch Oxidationszustände 1, 2 Oxide (Basizität) Cu2O (Kupfer(I)-oxid), CuO (Kupfer(II)-oxid) (leicht basisch) Normalpotential 0,342 V (Cu2+ + 2e- → Cu) Elektronegativität 1,9 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 61Cu 3,333 h ε 2,237 61Ni 62Cu 9,74 min ε 3,948 62Ni 63Cu 69,17 %
Stabil 64Cu 12,7 h ε 1,675 64Ni β− 0,579 64Zn 65Cu 30,83 %
Stabil 66Cu 5,088 min β− 2,642 66Zn 67Cu 61,83 h β− 0,577 67Zn NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Kupfer (lat. Cuprum) ist ein chemisches Element mit dem Symbol Cu und der Ordnungszahl 29. Es ist ein Metall der 4. Periode in der 11. Gruppe im Periodensystem. Der lateinische Name cuprum ist abgeleitet von aes cyprium „Erz von der Insel Zypern“, wo im Altertum Kupfer gewonnen wurde.
Kupfer ist als relativ weiches Metall gut formbar und zäh. Als hervorragender Wärme- und Stromleiter findet es vielseitige Verwendung. Darüber hinaus zählt es auch zur Gruppe der Münzmetalle.
Als schwach reaktives Schwermetall gehört Kupfer zu den Edelmetallen.
Inhaltsverzeichnis
Geschichte
 Kupferbergwerk, Herri met de Bles, Mitte 16. Jahrhundert
Kupferbergwerk, Herri met de Bles, Mitte 16. JahrhundertKupfer, Gold, Silber und Zinn waren die ersten Metalle, welche die Menschheit in ihrer Entwicklung kennenlernte. Da Kupfer leicht zu verarbeiten ist, wurde es bereits von den ältesten bekannten Kulturen vor etwa 10.000 Jahren verwendet. Die Zeit seines weiträumigen Gebrauchs vom 5. Jahrtausend v. Chr. bis zum 3. Jahrtausend v. Chr. wird manchmal auch Kupferzeit genannt. In der Alchemie wurde Kupfer mit Venus/Weiblichkeit ♀ assoziiert, sicher nicht zuletzt deshalb, weil die ersten Spiegel aus diesem Metall hergestellt wurden.
Später wurde es mit Zinn und Bleianteilen zu Bronze legiert. Diese härtere und technisch widerstandsfähigere Legierung wurde zum Namensgeber der Bronzezeit. Die Unterscheidung von Blei und Zinn wurde erst mit wachsenden Metallkenntnissen eingeführt, sodass der Begriff Bronze aus heutiger Sicht nur auf die hochkupferhaltigen Zinn-Kupferlegierungen richtig angewendet ist.
Die goldgelbe Kupfer-Zink-Legierung „Messing“ war bereits im antiken Griechenland bekannt. Es wurde durch gemeinsames Verarbeiten der jeweiligen Erze erschmolzen, aber erst die Römer haben dieses Verfahren verstärkt verwendet. In Altkolumbien wurde die Gold-Kupfer-Legierung Tumbaga häufig verwendet.
Vorkommen
Kupfer kommt in der Natur manchmal als gediegenes Element vor, hauptsächlich in basaltischen Laven. Es tritt meist als Nugget (aus der Schmelze erstarrt) oder in verzweigten Strukturen, so genannten Dendriten auf, selten auch in kristalliner Form. Der Anteil gediegenen Kupfers in der Natur ist allerdings sehr niedrig.
Kupfererze kommen dagegen häufig vor. So wird Kupfer aus Chalkopyrit (Kupferkies) (CuFeS2), Chalkosin (Kupferglanz) (Cu2S), seltener auch aus Bornit (Cu5FeS4), Atacamit [CuCl2 • Cu(OH)2], Malachit und anderen Erzen gewonnen.
Die weltweit größten Vorkommen gibt es in Chile (Chuquicamata), den USA, Russland, Sambia (Copperbelt), Kanada und Peru.
Siehe auch: Kupferbergbau
Die Staaten mit der größten Förderung
- Siehe auch: Liste der größten Kupferproduzenten
Die Staaten mit der größten Förderung von Kupfer (2002)[2] Rang Land Fördermengen
( in 1000 t )1 Chile 4620 2 Indonesien 1167 3 USA 1140 4 Australien 876 5 Russische Föderation 844 6 Peru 843 7 Kanada 577 8 Polen 572 9 China 554 10 Kasachstan 432 11 Sambia 336 12 Mexiko 315 13 Argentinien 218 14 Papua-Neuguinea 211 15 Südafrika 130 16 Mongolei 120 17 Bulgarien 108 18 Indien 79 19 Portugal 77 20 Schweden 72 Das bedeutendste kupferproduzierende Land ist Chile, mit großem Abstand gefolgt von Indonesien und den USA. In Europa sind Polen, ferner Portugal und Schweden zu nennen. Die wichtigsten Exportländer sind in der CIPEC organisiert. Zur CIPEC gehören u. a. Australien, Indonesien, Demokratische Republik Kongo sowie Papua-Neuguinea, auf dessen Insel Bougainville eine der weltgrößten Kupferminen 1988 zu einem Bürgerkrieg führte, dessen Folgen noch andauern.
Historisch bedeutsam waren die Kupfergruben auf der Keweenaw-Halbinsel im Lake Superior/USA (weltweit größtes Vorkommen von gediegenem Kupfer; Gewinnung bereits in vorkolumbischer Zeit). In Deutschland wurde bis 1990 im Mansfelder Land Kupferschiefer abgebaut.
Herstellung
Zur Herstellung von Kupfer wird aus Kupferkies (CuFeS2) zunächst so genannter Kupferstein (Cu2S mit variierenden Gehalten an FeS, Cu-Gehalt ca. 70 %) gewonnen. Dazu wird das Ausgangsmaterial unter Zusatz von Koks geröstet und die enthaltenen Eisenoxide durch kieselsäurehaltige Zuschlagstoffe verschlackt. Diese Eisensilikat-Schlacke schwimmt auf dem Kupferstein und kann so leicht abgegossen werden.
-
- Röstarbeit:
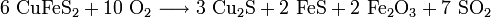
-
- Schmelzarbeit:
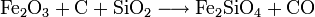
Der so erhaltene Kupferstein wird zu Rohkupfer (auch Schwarzkupfer, Cu-Gehalt ca. 98 %) weiterverarbeitet. Dazu wird er glutflüssig in einen Konverter gegossen und in diese Schmelze Luft eingeblasen. In einer ersten Stufe (Schlackenblasen) wird dabei das darin enthaltene Eisensulfid zu Eisenoxid geröstet und dieses durch zugeschlagenen Quarz zur Schlacke gebunden, die abgegossen werden kann. In einem zweiten Schritt (Garblasen) werden zwei Drittel des verbleibenden Cu2S zu Cu2O oxidiert. Das Oxid setzt sich dann mit dem restlichen Sulfid zum Rohkupfer um.
-
- Schlackenblasen:
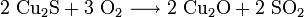
-
- Garblasen:
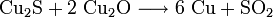
Das Rohkupfer (auch „Zementkupfer“ genannt) wird nun elektrolytisch gereinigt. Dabei bildet das unreine Kupfer die Anode, von dort wandert es als Ion durch den Elektrolyten zur Kathode und wird dort als Elektrolytkupfer mit einem Cu-Gehalt von 99,99 % abgeschieden, d. h. mit nur sehr geringen Beimengungen anderer Stoffe. Die unedleren Metalle dieser Beimengungen bleiben im Elektrolyt gelöst, die edleren Metalle (darunter Silber und Gold) bilden den „Elektrolytschlamm“ und werden gesondert aufbereitet.
Die Gewinnung von Kupfer erfolgt in einer Affinerie, in Deutschland ist dafür die Norddeutsche Affinerie in Hamburg bekannt, früher war es auch die Duisburger Kupferhütte (heute DK Recycling).
Eigenschaften
Physikalische Eigenschaften
Mit einer Dichte von 8920 kg/m3 gehört Kupfer zu den Schwermetallen, sein Schmelzpunkt liegt bei 1083,4 °C. Es kristallisiert im kubisch-flächenzentrierten (fcc = face centered cubic) Kristallsystem (Cu-Typ) und hat eine zwischen 2,5 und 3 liegende Mohshärte. Kupfer leitet den elektrischen Strom sehr gut (58 · 106 S/m). Damit ist es nur wenig schlechter als Silber und deutlich leitfähiger als Gold. Außerdem ist Kupfer ein sehr guter Wärmeleiter.
Aluminium ist pro Gramm Gewicht ein noch besserer elektrischer Leiter als Kupfer. Es ist aber voluminöser, so dass Kupfer je Quadratzentimeter Leitungsquerschnitt den elektrischen Strom besser leitet. Weil Kupfer reaktionsträger als Aluminium und seine Verarbeitung problemloser ist, wird als Stromleiter meist Kupfer verwendet und Aluminium nur, wenn es auf das Gewicht ankommt.
Als blankes Metall hat Kupfer eine hellrote Farbe, die Strichfarbe ist rosarot. An der Luft läuft es an und wird rötlichbraun. Durch weitere Verwitterung und Korrosion bildet sich sehr langsam (oft über Jahrhunderte) oberflächlich Patina. Dabei geht der Metallglanz verloren und die Farbe verändert sich von rotbräunlich bis hin zu einem bläulichen Grün.
Chemische Eigenschaften
Kupfer tritt in den Oxidationsstufen 0, +1, +2, +3 und +4 auf, am häufigsten sind +1 und +2, wobei +2 die stabilste Oxidationsstufe in wässrigen Lösungen ist; Stufe +4 ist extrem selten (beispielsweise in Cs2CuF6). Kupfer(II)-Salze (z. B. Kupfersulfat) sind meist von blauer oder grüner Farbe. Kupfer hat chemisch manche ähnliche Eigenschaften wie die in der gleichen Gruppe stehenden Elemente Silber und Gold. So scheidet sich an einem Eisen-Nagel, der in eine Lösung aus Kupfersulfat getaucht wird, eine Schicht aus metallischem Kupfer ab, wofür Eisen als Eisensulfat in Lösung geht, weil Eisen unedler als Kupfer ist (siehe dazu auch Spannungsreihe).
In flüssigem Kupfer lösen sich Sauerstoff und Wasserstoff, die sich bei der Erstarrung der Schmelze zu Wasserdampf umsetzen können und damit die Ursache für Gasporosität im Gussstück bilden.
Verwendung
 Elektrische Leitung (Litze)
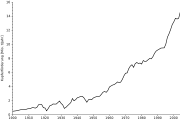
Elektrische Leitung (Litze)Kupfer wird für Münzen, Stromkabel, Schmuck, Besteck, Armaturen, Kessel, Präzisionsteile, Kunstgegenstände, Musikinstrumente, Rohrleitungen und vieles mehr verwendet. Es ist ein relativ teures Metall (Stand des Weltmarktpreises im Mai 2008: ca. 5450 Euro/Tonne).[3]
Für elektrischen Strom leitende Kabel und Leitungen, Leiterbahnen (Leiterplatten und Integrierte Schaltkreise) und Bauteile (Wicklungen von Transformatoren, Drosseln und Induktivitäten, Anodenkörper von Magnetrons) eignet sich reines Kupfer wegen seiner sehr guten elektrischen Leitfähigkeit. Für Oberleitungen wird Berylliumkupfer eingesetzt.
Kupfer besitzt ein hohes Reflexionsvermögen im Infrarotbereich und wird daher als Spiegel für Kohlendioxidlaser-Strahlen eingesetzt.
Wegen seiner sehr guten thermischen Leitfähigkeit eignet es sich als Wärmeableiter.
Im Kunsthandwerk wird Kupferblech getrieben, das heißt durch Hämmern verformt, was aufgrund seiner Weichheit leicht möglich ist.
Auch Dächer werden mit Kupferblech gedeckt, worauf sich dann eine beständige grünliche Patina aus verschiedenen basischen Kupferhydroxiden/-carbonaten bildet (das ist kein Grünspan, siehe Kupferacetat). Diese Patina schützt das darunterliegende Metall gut vor weiterer Korrosion, so dass Kupferdächer eine Lebensdauer von mehreren Jahrhunderten haben können.
Legierungen
Kupfer ist auch Bestandteil vieler Legierungen wie z. B. Messing (mit Zink), Bronze (mit Zinn) und Neusilber (mit Zink und Nickel). Diese Kupferlegierungen werden wegen ihrer guten Eigenschaften, wie Farbe, Korrosionsbeständigkeit und Verarbeitbarkeit gerne vielfältig eingesetzt. Man unterscheidet Knetlegierungen (Messing und Neusilber) und Gusswerkstoffe (Rotguss, Bronzen): Knetlegierungen werden durch plastisches Umformen (Warmumformen: Walzen, Schmieden usw. oder Kaltumformen: Drahtziehen, Hämmern, Kaltwalzen, Tiefziehen usw.) in die gewünschte Form gebracht, während Gusswerkstoffe meist nur schwer oder gar nicht plastisch formbar sind.
Gegenstände mit silberweißem oder edelstahlartigem Erscheinungsbild sind in Wirklichkeit oft hoch kupferhaltige Legierungen, wobei die kupfereigene Farbe durch ausreichenden Nickelzusatz verschwindet.
Viele Münzwerkstoffe sind auf Kupferbasis hergestellt, so ist das „Nordisches Gold“ genannte Metall der goldfarbigen Teile der Euromünzen eine Kupfer-Zink-Aluminium-Zinn-Legierung. Die Münzmetalle der bis 2001 gültigen 1-DM-Geldstücke sowie die hellen Anteile der Euromünzen bestehen aus Kupfernickel-Legierungen.
Kupferverbindungen kommen in Farbpigmenten, als Toner, in medizinischen Präparaten und galvanischen Oberflächenbeschichtungen zum Einsatz.
Siehe auch: Kupferrecycling
Biologische Wirkungen
bakterizide Eigenschaften
Kupfer ist für viele Mikroorganismen bereits in geringen Konzentrationen toxisch, welche für Wirbeltiere unbedenklich sind. Daher (aber auch weil leicht verlegbar) sind Wasserendleitungen oft kupferhaltig. Aufgrund der bakteriziden Eigenschaft von Kupfer wird in Großversuchen getestet, ob es wirtschaftlich sinnvoll ist, Krankenhauszimmer mit kupferbeschichteten Türklinken auszustatten.[4] Im Vergleich zu vielen anderen Schwermetallen ist Kupfer für höhere Organismen nur relativ schwach giftig. So kann ein Mensch täglich 0,04 Gramm Kupfer zu sich nehmen, ohne Schaden an seiner Gesundheit zu erleiden.[5] In freier, nicht an Proteine gebundener Form, wirkt Kupfer antibakteriell; man spricht hier wie beim Silber vom oligodynamischen Effekt, weshalb z. B. auch Blumenwasser, das in Kupfergefäßen aufbewahrt wird oder in das eine Kupfermünze gelegt wird, nicht so schnell faulig wird.
Die toxische Wirkung entsteht dadurch, dass Kupferionen an Thiolgruppen von Proteinen binden und Lipide der Zellmembran peroxidieren, was zur Bildung von freien Radikalen führt, welche die DNA und Zellmembranen schädigen. Beim Menschen führt das beispielsweise im Fall von Morbus Wilson zu Schädigungen der Organe mit einem hohen Kupferüberschuss.
Kupferbedarf
Bei den meisten Mehrzellern ist Kupfer Bestandteil vieler Enzyme und daher ein lebensnotwendiges Spurenelement. Kupfer ist Bestandteil des blauen Hämocyanin, das bei Weichtieren und Gliederfüßern als Blutfarbstoff dem Sauerstofftransport dient. Der tägliche Bedarf eines erwachsenen Menschen beträgt nach DACH 1,0–1,5 Milligramm.[6]
Im Menschen wird Kupfer hauptsächlich in der Leber gespeichert.
Kupfer ist vor allem in Schokolade, Leber, Getreide, Gemüse und Nüssen enthalten. Kupfermangel tritt beim Menschen selten auf, hauptsächlich bei langanhaltenden Durchfällen, frühreifen Kindern, nach einer langanhaltenden Unterernährung oder Malabsorption durch Krankheiten wie z. B. Sprue, Morbus Crohn oder Mukoviszidose. Die Einnahme hoher Dosen von Zink, Eisen oder Molybdat kann ebenfalls zu verringerten Kupfermengen im Körper führen.[7]
Kupferüberschuss und Vergiftung
Überschüssiges Kupfer wird mit der Gallenflüssigkeit zur Ausscheidung in das Verdauungssystem abgegeben.[7]
Kupfersulfat (Kupfervitriol) ist ein starkes Brechmittel und wurde deshalb zur Behandlung vieler Vergiftungen eingesetzt, beispielsweise durch weißen Phosphor, was in diesem speziellen Fall auch noch den Vorteil hat, dass gleichzeitig der Phosphor als schwerlösliches Kupferphosphid gebunden wird.
Bei der seltenen Erbkrankheit Morbus Wilson ist die Kupferausscheidung beeinträchtigt und es kommt zu vermehrter Kupferanlagerung, zuerst in der Leber, dann, wenn diese das Kupfer in den Blutkreislauf ausscheidet, auch in anderen Organen. Eine weitere ebenso seltene Erkrankung des Kupferstoffwechsels ist das Menkes-Syndrom. Dabei kann das Kupfer von den Zellen zwar aufgenommen, dann aber nicht mehr geordnet weitertransportiert werden, so dass einige Organe einen erhöhten, andere wiederum einen erniedrigten Kupfergehalt aufweisen.
Die Alzheimer-Krankheit geht möglicherweise mit Kupfermangel einher. Die therapeutische Wirksamkeit von Kupfergaben wird untersucht.[8]
Nachweis
Kupfer färbt die Boraxperle in der oxidierenden Flammenzone blau bis blau-grün, in der reduzierenden Flammenzone ist keine Färbung bemerkbar bzw. wird die Perle rot bis rotbraun gefärbt. Im klassischen Kationentrenngang wird Kupfer in der Schwefelwasserstoff-Gruppe gefällt und dort in der Kupfergruppe als blauer Komplex nachgewiesen. Letztere Färbung beruht darauf, dass Lösungen von Kupfer(II)-Ionen mit Ammoniak einen tiefblauen Kupfertetramminkomplex, [Cu(NH3)4]2+, bilden (siehe auch Komplexbildungsreaktion).
Eine Kaliumhexacyanoferrat(II)-Lösung fällt Kupfer(II)-Ionen als Kupfer(II)-hexacyanoferrat(II), Cu2[Fe(CN)6]. Diese Nachweisreaktion ist sehr empfindlich, d. h. sie zeigt auch geringe Kupfermengen an.
Kupfersalze färben die Flamme (Bunsenbrennerflamme) grün/blau (Spektralanalyse).
Die quantitative Bestimmung kann durch Elektrogravimetrie an einer Platinnetzkathode aus einer schwefelsauren Kupfer(II)-haltigen Lösung erfolgen. Maßanalytisch kann Kupfer durch Iodometrie oder Komplexometrie (Titration mit Titriplex/Komplexon III mit Indikator Murexid) bestimmt werden. Im Spurenbereich steht die Differenzpulspolarographie zur Verfügung (Halbstufenpotential −0,62 V gegen SCE in 1 M Rhodanid-Lösung). Ultraspuren an Kupfer bestimmt man mittels Inversvoltammetrie[9], Graphitrohr-AAS oder ICP-MS.
Siehe auch
Einzelnachweise
- ↑ Eintrag zu Kupfer in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 27.4.2008 (JavaScript erforderlich)
- ↑ Handelsblatt Die Welt in Zahlen (2005)
- ↑ London Metal Exchange: Copper Grade A
- ↑ Feldversuch: Mit Kupfer-Türklinken gegen resistente Krankenhauskeime
- ↑ Tägliche Aufnahme von 0,5 mg/kg unbedenklich laut: Holleman-Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin, 2007, S. 1434.
- ↑ DACH-Referenzwerte für die Nährstoffzufuhr
- ↑ a b http://www.merck.com/mmhe/sec12/ch155/ch155c.html Merck Manual: Copper
- ↑ http://www.uniklinikum-saarland.de/de/aktuelles/pressemitteilungen/2005/07/1121353268
- ↑ R. Neeb: Inverse Polarographie und Voltammetrie. Akademie-Verlag, Berlin, 1969, S. 185–188.
Literatur
- Harry H. Binder: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3.
Weblinks
- Kupfer im Seilnacht-Lexikon
- Mineralienatlas:Kupfer (Wiki)
- Deutsches Kupferinstitut (DKI) – umfassende Fachinformationen und Publikationen
- Kupfermuseum in Fischen am Ammersee – Kunstwerke der Kupferschmiede
- Kupferschaubergwerk
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.