- EDTA
-
Strukturformel 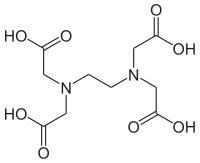
Allgemeines Name Ethylendiamintetraessigsäure (EDTA, EDTAH4) Andere Namen - Ethylendinitrilotetraessigsäure
- Ethylendiamintetraethansäure
- Edetinsäure (INN)
- Titriplex® II
- Idranal® II
- Chelaplex II
Summenformel C10H16N2O8 CAS-Nummer 60-00-4 PubChem 6049 Kurzbeschreibung weißes Pulver Eigenschaften Molare Masse 292,24 g·mol−1 Aggregatzustand fest
Dichte 0,86 g·cm−3[1]
Schmelzpunkt Siedepunkt Zersetzung
Dampfdruck pKs-Wert 0,26[2]
Löslichkeit löslich in Wasser: 1 g·l−1 (20 °C)[2]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Reizend (Xi) R- und S-Sätze R: 36 S: (2)-26 LD50 30 mg·kg−1 (Ratte, oral) [2]
WGK 2[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ethylendiamintetraessigsäure bzw. Ethylendiamintetraacetat, das Tetraanion der Ethylendiamintetraessigsäure, kurz EDTA, ist ein Komplexbildner. Er bildet besonders stabile 1:1-Chelatkomplexe mit Kationen mit einer Ladungszahl von mindestens +2. Pionierarbeit zu EDTA leistete Gerold Schwarzenbach in den 1940er-Jahren an der Universität Zürich.
Inhaltsverzeichnis
Eigenschaften
Das Ethylendiamintetraessigsäure-Anion kann neben den beiden freien Elektronenpaaren des Stickstoffatoms auch vier Carboxylgruppen für eine Komplexverbindung zur Verfügung stellen, sich also 6-fach an ein Kation binden. Es vermag so sehr stabile Komplexe auch mit solchen Kationen zu bilden, die wie beispielsweise Calcium eine äußerst geringe Tendenz zur Bildung von Komplexen haben. Komplexe dieser Art bezeichnet man auch als Chelatkomplexe, von griechisch Chele, Krebsschere. EDTA bildet besonders stabile Komplexe mit Cu2+, Ni2+, Fe3+ und Co3+. Die freie Säure ist schlecht löslich, vor allem bei niedrigem pH, die Salze sind dagegen sehr gut in Wasser löslich. Hingegen ist es in Fetten nicht löslich.
Synthese
Durch die Strecker-Synthese von Formaldehyd und Blausäure in Gegenwart von Ethylendiamin über das Tetranitril und anschließender alkalischer Hydrolyse.[4]
Verwendung
EDTA ist einer der am häufigsten verwendeten Komplexbildner. 1999 wurden in Europa rund 35.000 Tonnen, in den USA 50.000 Tonnen verbraucht.
Neben der freien Säure werden vielfach auch deren Salze verwendet:
- Dinatrium-ethylendiamin-tetraacetat (Na2EDTA, Natriumedetat)
- Tetranatrium-ethylendiamin-tetraacetat (Na4EDTA)
- Calcium-dinatrium-ethylendiamin-tetraacetat (CaNa2EDTA, E 385)
Die wichtigsten Anwendungen von EDTA und deren Salze sind
- Detergenzien: EDTA ist in vielen Wasch- und Reinigungsmitteln zur Bindung von Ca2+- und Mg2+-Ionen (Enthärtung) enthalten.
- Industrielle Reinigung: Komplexierung von zweiwertigen Kationen wie Ca2+ und Mg2+ sowie einiger Schwermetallionen
- Photoindustrie: FeIII-EDTA ist ein wichtiger Bestandteil (Oxidationsmittel) in der Farbentwicklung.
- Papierindustrie: Zur Komplexierung von Fe3+- und Mn2+-Ionen, die bei der chlorfreien Bleiche das Wasserstoffperoxid deaktivieren
- Agrochemikalien: FeIII-, CuII- und ZnII-EDTA werden als Dünger verwendet, vor allem auf kalkhaltigen Böden
- Konservierungsmittel: EDTA komplexiert zweiwertige Metallkationen, die für die Funktion vieler Enzyme essenziell sind. Die Vermehrung von Bakterien wird so unter anderem in Kontaktlinsen-Pflegemitteln verhindert.
Weitere Verwendungen von EDTA sind:
- Textilindustrie: Stabilisierung von Bleichbädern
- Kosmetika: als Konservierungsstoff
- Medizin: Behandlung von Metallvergiftungen. Eine umstrittene Therapie ist die Chelat-Therapie, bei der EDTA injiziert wird, um den Körper zu reinigen. In der diagnostischen Medizin wird EDTA als Calciumpuffer eingesetzt und dient der Antikoagulation von Blutproben.
- In der Zahnmedizin verwendet man EDTA-Lösungen bei Wurzelkanalbehandlungen, um die bei der Aufbereitung des Wurzelkanales entstehende Schmierschicht zu entfernen und die Dentinkanälcheneingänge freizulegen.
- Calciumdinatriumethylendiamintetraacetat wird als Antioxidationsmittel, Stabilisator und Komplexbildner verwendet. Durch die Bindung von Metallionen verhindert es eine Farbveränderung bei Lebensmitteln in Konservendosen. Öle werden aus gleichem Grund am Ranzigwerden gehindert. Es ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E 385 nur für emulgierte Saucen, Dosen- und Glaskonserven, Halbfettmargarine sowie Schalentiere zugelassen.[5] In Australien hat es keine Zulassung.
- Calciumdinatriumethylendiamintetraacetat wird in der Medizin als blutgerinnungshemmender Zusatzstoff für Blutabnahmen verwendet. Des Weiteren wird es als Medikamentenzusatz gegen Schwermetallvergiftungen, Herz-Kreislaufbeschwerden, Rheuma und Arthritis verabreicht. Weitere mögliche medizinische Einsatzgebiete sind Arteriosklerose und Durchblutungsstörungen.
In der Chemie oder Biologie wird EDTA vielfach verwendet.
- In der Analytischen Chemie wird EDTA als Komplexon®/Titriplex® II-Maßlösung dazu benutzt, in der Chelatometrie Metallionen wie Cu, Pb, Ca oder Mg quantitativ zu bestimmen. Auch das in Wasser besser lösliche Dinatriumsalz (Komplexon/Titriplex III) kann verwendet werden.
- EDTA ist einer der Bestandteile der TAE- und TBE-Puffer, die unter anderem bei der Gel-Elektrophorese Verwendung finden.
- Enzymlösungen werden oft mit EDTA versetzt, um der durch Schwermetallionen verursachten Hemmung der Enzymaktivität vorzubeugen.
- Pflanzennährlösungen wird EDTA zugefügt, um eine Fällung des benötigten Eisens mit dem ebenfalls benötigten Phosphat als Eisenphosphat zu verhindern.
- In der Labormedizin werden Blutproben für die Untersuchung des Blutbildes mit EDTA ungerinnbar gemacht, da das für die Gerinnung notwendige Calciumkation durch EDTA irreversibel komplexiert wird.
- Bei der Abtötung gramnegativer Bakterien mit Lysozym wird EDTA zur Permeabilisierung der Außenmembran (plastische Schichte) hinzugegeben.
- Auch lassen sich Metalloproteinasen durch Chelatbildner wie EDTA inhibieren. Durch die Chelatisierung der Metallionen aus dem Aktivzentrum von Metalloproteinasen verlieren diese ihre katalytische Aktivität.
Biologische Abbaubarkeit und Toxikologie
EDTA und seine Metallkomplexe sind in der Abwasserreinigung nicht oder nur schlecht biologisch abbaubar. Durch Erhöhen des pH-Wertes und Verlängerung des Schlammalters kann jedoch eine weitgehende biologische Elimination von EDTA erreicht werden. Aus Klärschlamm, Sedimenten und Böden wurde eine Vielzahl von Mikroorganismen isoliert, die mit EDTA als alleiniger C- und N-Quelle wachsen können. Die Metallkomplexe von EDTA sind nicht oder nur sehr wenig toxisch für Organismen. EDTA vermag jedoch auch schwerlösliche Schwermetallsalze aus den Sedimenten zu lösen. Wenn das EDTA dann zerfällt, werden diese an der Oberfläche wieder frei.
Auch die Toxizität von EDTA für den Menschen ist sehr gering, sodass EDTA als Lebensmittelzusatzstoff zugelassen ist. In sehr hohen Konzentrationen kann vor allem freies EDTA durch Bindung lebenswichtiger Metalle zu Störungen führen. Die in der Umwelt gemessenen Konzentrationen von EDTA sind für den Menschen unbedenklich.
Umweltverhalten
EDTA gelangt fast ausschließlich über das Abwasser in die Umwelt. Da EDTA unter normalen Bedingungen nur sehr langsam abgebaut wird, kann es in praktisch allen Wasserproben in niedrigen Konzentrationen nachgewiesen werden. EDTA-Konzentrationen in Flüssen liegen zwischen 10 und 100 µg/l, in Seen zwischen 1 und 10 µg/l. Im Grundwasser und Uferfiltrat kann EDTA in Konzentrationen zwischen 1 und 100 µg/l gefunden werden. Bei neutralen pH-Werten ist die Adsorption von EDTA an Mineraloberflächen gering, was zu einer hohen Mobilität im Grundwasser führt. Lediglich der FeIII-EDTA-Komplex wird sehr schnell durch Sonnenlicht abgebaut. Dies ist der wichtigste Eliminationsprozess für EDTA in der Umwelt. EDTA wird während der Ozonisierung oder Chlorung von Trinkwasser nur unvollständig entfernt. EDTA gilt heute als ökologisch bedenklich, da freie Komplexbildner Schwermetalle aus dem Sediment lösen und bioverfügbar machen.
Ersatzstoffe
- Nitrilotriessigsäure (NTA)
- EGTA (Ethylenglykol-bis(aminoethylether)-N,N'-tetraessigsäure)
- Ethylendiamindibernsteinsäure (EDDS)
- Citronensäure
- Polycarboxylate
- Zeolithe, insbesondere Zeolith A
- Phosphonate
- Polyspargelsäure (Quelle: Prof. Dr. Michael Braungart)
Quellen
- ↑ a b c Eintrag zu EDTA in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 2. Sep. 2007 (JavaScript erforderlich)
- ↑ a b c d Ethylendiamintetraessigsäure bei ChemIDplus
- ↑ Eintrag zu CAS-Nr. 60-00-4 im European chemical Substances Information System ESIS
- ↑ Beyer/Walter: Lehrbuch der organischen Chemie. 19. Auflage. Hirzel Verlag, Stuttgart 1981
- ↑ ZZulV: Anlage 4 (zu § 5 Abs. 1 und § 7) Begrenzt zugelassene Zusatzstoffe
Weblinks
- Neues Rezeptur-Formularium: Natriumedetat (PDF)
- European Union Risk Assessment Report - Untersuchung der Substanz im Rahmen des Chemikaliengesetzes (PDF)
Wikimedia Foundation.


-ion.png)