- Eisblock
-
Eis Eiskristalle unter dem Mikroskop Chemische Formel H2O Mineralklasse Oxide – Kation:Anion (M:O) = 2:1 (und 1.8:1)
4.AA.05 (8. Aufl.: IV/A.01-10) (nach Strunz)
4.1.2.1 (nach Dana)Kristallsystem hexagonal Kristallklasse dihexagonal-dipyramidal 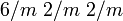 [1]
[1]Farbe farblos, weiß, in dicken Schichten schwach blaugrün schimmernd Strichfarbe weiß Mohshärte 1,5 Dichte (g/cm³) 0,9167 Glanz Glasglanz Transparenz durchsichtig bis undurchsichtig Bruch muschelig Spaltbarkeit fehlt Habitus prismatische, dendritische, nadelige bis faserige Kristalle; körnige bis massige Aggregate Häufige Kristallflächen Zwillingsbildung 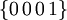 und
und 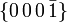
Kristalloptik Brechzahl α = 1,320; β = 1,330 [2] Doppelbrechung
(optische Orientierung)δ = 1,320 [2] ; einachsig (Richtung nicht definiert) Pleochroismus nicht vorhanden Weitere Eigenschaften Schmelzpunkt 0 °C Als Eis wird im Allgemeinen gefrorenes Wasser bezeichnet, welches – neben flüssigem Wasser und Wasserdampf – dessen dritten möglichen Aggregatzustand darstellt. Es bildet sich im Allgemeinen bei Null Grad Celsius und zählt als natürlich vorkommender kristalliner Festkörper mit einer definierten chemischen Zusammensetzung zu den Mineralen. Aufgrund seiner chemischen Struktur H2O gehört Eis zur Stoffgruppe der Oxide.
Eis kristallisiert im hexagonalen Kristallsystem und tritt in der Natur in den verschiedensten Erscheinungsformen auf, vom Hagelkorn über den Eiswürfel bis zum Gletscher. Seine Dichte von 0,9168 g/cm³ (bei 0 °C) ist geringer als die von Wasser (1 g/cm³), weswegen es auf der Wasseroberfläche schwimmt und dort Eisdecken, Eisschollen und Eisberge bildet.
In reiner Form besteht Eis aus farblosen, transparenten Kristallen. Eisblöcke enthalten jedoch meist viele feine Luftbläschen, die während der Erstarrung der Eiskristalle eingeschlossen werden und erscheinen daher durch vielfache Lichtbrechung weiß. Als chemischer Stoff zeichnet es sich durch einige besondere Eigenschaften aus, die auf den Anomalien des Wassers beruhen.
Bei zahlreichen meteorologischen Phänomenen spielt Eis eine wichtige Rolle. Die Eiskappen der Polarregionen sind von großer Bedeutung für das globale Klima und speziell für den globalen Wasserkreislauf. Einen dementsprechend entscheidenden Einfluss hat es daher auch auf unsere Biosphäre.
Die Wissenschaft von Formen, Auftreten und Eigenschaften von Eis und Schnee nennt man Glaziologie.
Inhaltsverzeichnis
Besondere Eigenschaften
Erstarrungsvorgang
Der Schmelz- bzw. Gefrierpunkt von Eis liegt unter Normalbedingungen bei Null Grad Celsius. Kristallisationskeime, also Verunreinigungen wie Staubpartikel und ähnliches, fördern die Kristallbildung, da sich die kristallisierenden Wassermoleküle an diese anlagern. Sehr reines (destilliertes) Wasser kann bis zu -70 °C unterkühlt werden.[3] In unterkühltem Wasser besitzen die Moleküle eine vom Normalfall abweichende Nahordnung, und es bilden sich Ikosaederstrukturen aus.
Der Gefrierpunkt kann durch Bestreuen mit Salzen (Streusalz) herabgesetzt werden. Dies ist eine kolligative Eigenschaft, die Gefrierpunktserniedrigung hängt nur von der Menge der gelösten Teilchen, nicht jedoch von ihrer Art ab. Der gleiche Effekt lässt sich also auch mit Zucker erreichen.
Zusätzlich kann auch die Lösungswärme eines Stoffes Eis zum Schmelzen bringen. Entscheidend hierfür ist, dass der hinzugegebene Stoff im festen Lösungsmittel unlöslich ist. Erreicht wird dieser Effekt durch die Erniedrigung des chemischen Potenzials der Flüssigphase. Dieser Effekt erzeugt gleichzeitig eine Siedepunkterhöhung des Wassers.
 bläulich durchscheinende Eisdecke des Fryxellsees
bläulich durchscheinende Eisdecke des FryxellseesFarbe
Eis ändert seine Farbe mit dem Luftgehalt und kann so auch in unterschiedliche Gruppen eingeteilt werden. Eis, das viel Luft enthält, ist weiß, solches, das wenig Luft enthält, ist durchsichtig und blau oder grün. Ein besonderer Fall von „farbigem“ Eis sind sogenannte Grüne Eisberge, bei welchen es sich um alte umgekippte Eisberge handelt, deren algenbewachsene Unterseite nun sichtbar ist.
Eis und Schnee reflektieren das Sonnenlicht. Innerhalb der Erdatmosphäre verursachen Eispartikel damit Lichtsäulen. (Die verwandten Halos entstehen dagegen durch Brechung des Lichtes in Eiskristallen.) Astronomisch und geophysikalisch sind Eis und Schnee häufig Verursacher einer hohen Rückstrahlung eines Gegenstandes.
Schallausbreitung
Die Schallgeschwindigkeit in Eis bei maximaler Dichte liegt bei 3250 m/s. Die Dispersion für Schallausbreitung in Eis ist im Gegensatz zu den meisten Festkörpern negativ. Dieser Effekt kann auf zugefrorenen Seen beobachtet werden. Entsteht z. B. in hinreichend großer Entfernung zum Beobachter ein Riss in der Eisfläche (z. B. durch Sonneneinstrahlung), kann ein pfeifendes Geräusch wahrgenommen werden, bei dem die Tonhöhe in Sekundenbruchteilen von ganz hohen Frequenzen zu sehr tiefen abfällt. Das Geräusch ähnelt dem eines vorbeifliegenden Projektils, das durch den Dopplereffekt eine fallende Tonhöhe erzeugt.
Tragfähigkeit
Nach der Mohsschen Härteskala hat Eis nur eine geringe Härte von 1,5 und lässt sich mit dem Fingernagel ritzen. Dennoch ist es in der Lage, Menschen und sogar schwere Fahrzeuge wie beispielsweise LKW zu tragen. Allerdings ist dafür eine Mindestdicke von etwa 5 cm bei einer einzelnen Person und 8 cm bei Personengruppen nötig. Schlittenfahrzeuge brauchen eine Eisdecke von mindestens 12 cm und Pkw wenigstens 18 cm.[4]
Die Tragfähigkeit lässt sich mit der sogenannten „Goldenen Formel“ berechnen.
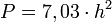 oder
oder 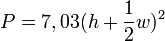
mit
P = zulässige Beladungs- bzw. Belastungskapazität des Eises in kg
h = Dicke Blaueis in cm
w = Dicke weißes Eis in cmDie kanadische Provinz Manitoba benutzt diese Formeln, um die Tragfähigkeit einer Eisfläche für die Nutzung als Winterstraße zu bestimmen.
Das Betreten von Eisflächen ist prinzipiell gefährlich und ist im Zweifel zu vermeiden. Dies gilt vor allem auch, weil die Dicke und Beschaffenheit des Eises häufig nicht zuverlässig zu bestimmen ist. Zur Bestimmung der Dicke des Eises eignet sich die Eisschraube.
Anomalien
Wasser weist zahlreiche Anomalien auf: Eigenschaften, die vom erwarteten Regelfall abweichen. Folgende Anomalien sind für seinen festen Zustand, als Eis, von Bedeutung:
- Eis ist weniger dicht, also leichter als Wasser, damit schwimmt es auf dem Wasser. Zu dieser Dichteanomalie kommt es, da die Wassermoleküle im hexagonalen Gitter einen größeren Abstand zueinander haben als im flüssigen, ungeordneten Zustand.
- Im Phasendiagramm hat Wasser mehr feste Modifikationen als jeder andere Stoff: 13 kristalline, 5 amorphe sowie 1 flüssiger, 1 überkritischer und 1 gasförmiger. Das Phasendiagramm enthält 11 Tripelpunkte – ein weiterer nicht nachweisbarer Tripelpunkt bei 0 K kann vermutet werden – und 2 kritische Punkte.
- Wasser ermöglicht in höherem Maße Unterkühlung als andere Stoffe: Auch unter natürlichen Bedingungen kann es bis −23 °C flüssig bleiben.
- Wasser hat einen zweiten kritischen Punkt bei −91 °C.
- Unterkühltes Wasser hat zwei Phasen (ES und CS). Es ist unter hohem Druck auch bei Temperaturen von bis zu −149 °C flüssig.
- Als Wasserglas wird ein Zustand bezeichnet, in dem festes glasiges Wasser wie eine Flüssigkeit erscheint, nur können sich die Moleküle darin nicht gegeneinander verschieben. Physiker in Kanada entdeckten dies etwa 1985, als sie bei minus 200 Grad auf einen Eisklotz drückten. Mittlerweile sind drei Glaswässer bekannt, zwei sehr dichte und eines, das auf flüssigem Wasser schwimmt.
- Heißes Wasser gefriert manchmal scheinbar schneller als kaltes Wasser (Mpemba-Effekt); der Effekt tritt auch bei anderen Flüssigkeiten auf, ist also nicht unbedingt eine Anomalie des Wassers.
- Erhöhter Druck setzt den Schmelzpunkt von Wasser herab, anstatt ihn heraufzusetzen (siehe Phasendiagramm). Pro Bar Druckanstieg sinkt der Schmelzpunkt um ca. 0,0077 K. Dies wird auch als Druckaufschmelzung bezeichnet.
- Magnetfelder können den Schmelzpunkt geringfügig verändern. Vermutet wird, dass das Magnetfeld indirekt die Wasserstoffbrücken der Wassermoleküle stärkt. Bei einem Magnetfeld von sechs Tesla steigt der Schmelzpunkt von normalem Wasser um 5,6 mK und bei schwerem Wasser um 21,8 mK.[5]
- Es ist möglich, Eis über den normalen Schmelzpunkt hinaus zu erwärmen. Mit ultrakurzen Laserpulsen kann ein Eiskristall im Inneren für kurze Zeit auf Raumtemperatur erhitzt werden, ohne dass er schmilzt. Vermutlich besitzt ein Eiskristall im Inneren einen höheren Schmelzpunkt als an seiner Oberfläche und das normale Schmelzen bei 0 °C ist demnach ein reiner Oberflächeneffekt.[6][7]
Klassifikation
Nach der 8. und 9. Auflage der Strunzschen Systematik der Minerale gehört Eis aufgrund seiner chemischen Zusammensetzung zur Mineralklasse der Oxide mit einem Stoffmengenverhältnis von 2:1 und 1:1.
Die 9. Auflage der Mineralsystematik nach Strunz untergliedert die Oxide allerdings weiter, sodass Eis zur Gruppe mit nicht näher bestimmter Ionengröße und dem Kation-Anion-Verhältnis von 2:1 und 1,8:1 zählt.
Die Mineralsystematik von Dana ordnet die Minerale nach ihrer Kristallstruktur. Eis gehört hier zur Abteilung der einfachen Oxide mit einer Kationenladung von +1 und bildet aufgrund seiner speziellen Kristallstruktur eine eigene Gruppe.[8]
Bildung und Fundorte
 Eis in dendritischer Form an einer Schneeflocke
Eis in dendritischer Form an einer Schneeflocke faseriges Kammeis
faseriges KammeisAuf der Erde
Eis bildet sich weltweit dort, wo die Luftfeuchtigkeit hoch genug und die Temperatur auf und unter den Gefrierpunkt gesunken ist.
Freie Eiskristalle entstehen in Form von Reif und Raureif durch Resublimation (direkter Übergang vom gasförmigen in den kristallinen Zustand) des atmosphärischen Wasserdampfs. Graupel und Hagel besteht aus rundlichen Eiskörnern. Sie bilden sich in Gewitterwolken aus Wassertröpfchen, welche in tiefen Wolkenschichten kondensieren und dann durch Aufwinde in höhere und kältere Luftschichten transportiert werden, wo sie dann gefrieren. Größere Hagelkörner sind oft Zusammenballungen kleinerer Eispartikel und durchlaufen in ihrer Entstehungsgeschichte mehrmals den Prozess des Aufstiegs durch Winde und des Absinkens durch ihre Gewichtskraft. Schnee besteht aus mehr oder weniger filigran verästelten Eiskristallen. Schneeflocken bilden sich durch langsames Anlagern und Gefrieren von feinsten Wassertröpfchen an einem Kristallisationskeim (z. B. Staubteilchen).
Dauerhaft mit dem Festland verbundene Eisflächen werden Schelfeis genannt. Die Schelfeisflächen werden meist durch fließende Gletscher gespeist. Eisberge sind von Gletschern abgebrochene (gekalbte) Eismassen.
Bei der Kristallisation von Meerwasser entsteht so genanntes Meereis; dabei wird das Salz an das Meer abgegeben oder sammelt sich in Sole(Salz)-Einschlüssen (Eis selbst ist immer festes Süßwasser). Je nach Größe und Zusammenballung des Eises unterscheidet man Nadeleis, Grieseis, Pfannkucheneis, Eisschollen und Packeis. Eine natürliche eisfreie Fläche, die jedoch vollständig von Packeis umgeben ist, heißt Polynja. Künstliche, in das Eis geschlagene Rinnen und Löcher werden Wuhnen genannt.
Eis, welches sich ausnahmsweise wegen seiner Entstehungsgeschichte am Boden eines Gewässers befindet, wird Grundeis genannt. Die Bildung von Neueis auf dem Meer wird als Nilas bezeichnet.
Die Eisverhältnisse auf Meeresgebieten werden mit einem internationalen Ice Code bezeichnet:
- 0: No ice; kein Eis, eisfrei
- 1: Slush or young ice; Schlamm- oder Neueis (junges Eis)
- 2: Fast ice; Festeis
- 3: Drift ice; Treibeis, Eisstoß
- 4: Packed slush or strips of hummocked ice; zusammengepacktes Schlammeis oder Höckereisstreifen (Eishöckerstreifen)
- 5: Open lead near shore; offene Eisrinne (durchgehende Fahrrinne im Eis) nahe der Küste
- 6: Heavy fast ice; starkes Festeis
- 7: Heavy drift ice; starkes Treibeis
- 8: Hummocked ice; Höckereis, Eishöcker (über das glatte Eis sich erhebende Eispyramiden), aufgepresstes Eis
- 9: Ice jamming; Eisblockierung
Im Sonnensystem
Eisvorkommen wurden in unserem Sonnensystem nachgewiesen in Kometen, auf dem Mars und auf einigen Monden der äußeren Planeten.
Von zahlreichen Kometen ist bekannt, dass sie zu einem Großteil aus Wassereis bestehen, weshalb sie auch hin und wieder als „Schmutzige Schneebälle“ tituliert werden. Es wird spekuliert, dass ein Großteil der irdischen Wasservorkommen auf ein lang anhaltendes Bombardement der noch jungen Erde durch Kometen zurückgeht. Das meiste Wasser im Universum liegt als Eis vor.
Außer der Erde ist der Mars der einzige Planet, auf dem Eisvorkommen nachgewiesen sind. Neben den Polkappen, die zweifelsfrei zu einem Teil aus gefrorenem Wasser bestehen, gibt es möglicherweise auch in anderen Regionen Eisvorkommen, und zwar als Permafrost in tieferen Bodenschichten.[9]
Hinweise auf das Vorhandensein von Eis in Meteoritenkratern in Polnähe bei Merkur, dem sonnennächsten Planeten, lieferte 1975 die Raumsonde Mariner 10. Genauere Untersuchungen mithilfe der für 2009 geplanten Mission MESSENGER sollen dies bestätigen bzw. widerlegen.
Von einigen Monden der äußeren Planeten ist bekannt oder wird vermutet, dass sie von einer Eiskruste bedeckt sind. Beispiele sind die Jupitermonde Europa, Ganymed und Kallisto, die Saturnmonde Enceladus und Titan, der Neptunmond Triton sowie der Plutomond Charon.
Frühe Radarbilder des Mond-Südpols aus den 1990er-Jahren mit vielen, kleinen, auffallend hell erscheinenden Flecken ließen bei zahlreichen Forschern die Hoffnung aufkeimen, dass der Mond über große Wasserreserven verfügt, die unter anderem am Grund tiefer Krater als Relikte von Kometeneinschlägen überlebt haben könnten. Solche Vorkommen wären wichtige Wasser- und Sauerstoffquellen für künftige Mondbasen. Neuerliche diesbezüglich Untersuchungen im Jahre 2006 mit hochauflösenden Radioteleskopen verliefen jedoch negativ.[10]
Struktur und Modifikationen
Im festen Aggregatzustand des Wassers wird als Eis normalerweise eine hohe Fernordnung durch Ausbildung eines Kristallgitters im Zuge der Kristallisation erreicht. Im flüssigen Zustand herrscht eine Mischung von Ordnung und Chaos, wobei die Moleküle aufgrund ihrer höheren Geschwindigkeit ein größeres Volumen ausfüllen.
Natürliches Eis kristallisiert im hexagonalen Kristallsystem in der Raumgruppe P63/mmc mit den Gitterparametern a = 6,27 Å und c = 5,79 Å sowie vier Formeleinheiten pro Elementarzelle. [1] [11]
Sechs Wassermoleküle schließen sich dabei über Wasserstoffbrücken jeweils zu einem Ring zusammen, wobei jedes Molekül ebenfalls Teil von zwei benachbarten Ringen ist. Die hexagonale Symmetrie der Kristallstruktur spiegelt sich in der makroskopischen Gestalt der Eiskristalle wider. In dieser Struktur ist jedes Sauerstoffatom tetraedrisch von jeweils vier anderen O-Atomen umgeben.[12]
Hexagonales Eis wird mit Eis Ih bezeichnet. Seine Dichte liegt bei etwa 0,92 g/cm–3 (0 °C), womit es - im Gegensatz zu den meisten anderen Stoffen - leichter als im flüssigen Zustand ist.
Unter −22 °C und über 207,5 MPa bilden sich jedoch noch andere, zum Beispiel kubische Eisformen aus, etwa das metastabile, kubische Eis Ic, in welchem die Sauerstoffatome eine Diamantstruktur aufweisen.[12] Bisher sind 13 kristalline und 5 amorphe Modifikationen bekannt (Stand Januar 2004). Letztere sind Formen ohne Kristallstruktur.
Die 13 kristallinen Formen werden als Eis Ih, Eis Ic, sowie Eis II bis Eis XII bezeichnet.
Nutzung und Behinderung
Schon die Römer nutzten Gletschereis zur Kühlung von Speisen und zur Herstellung von Erfrischungsgetränken. Diese Nutzung war allerdings den Reichen vorbehalten.
Im 19. Jahrhundert begann in Nordamerika die kommerzielle Nutzung von Wintereis, zunächst als Luxusgut für Menschen in tropischen Ländern, später auch als Massengut für den Hausbedarf. Der Eismann brachte Eisblöcke, mittels derer verderbliche Nahrungsmittel, typischerweise in einem Eisschrank, länger frisch gehalten werden konnten. Mit der Elektrifizierung und Einführung des Kühlschranks fand dieses Gewerbe sein Ende. Heute wird fast das gesamte vom Menschen zu Speisezwecken genutzte Eis von Kältemaschinen oder in Kühlschränken hergestellt.
Speiseeis ist dagegen eine aus Fruchtsäften oder Milchmixgetränken hergestellte Schneemasse oder Eisschlamm, da kompaktes Eis zu Erfrierungen der Zunge führen würde.
Da die Oberflächen von Eis und Schnee eine Schicht nur schwach gebundener Wassermoleküle besitzen, ist die Reibung auf einer Eis- oder Schneefläche gering. Da ein dünner, flüssiger Film zwischen dem Eis und den Kufen entsteht, sind Wintersport (Eislauf, Skifahren, Schlittenfahren) oder Schlitten als Transportmittel erst möglich.
Zugefrorene Wasserflächen können einerseits die Schifffahrt behindern, andererseits aber auch Transportwege verkürzen, indem Land-Transporte direkt über die Wasserfläche geführt werden können, zum Beispiel auf dem Baikalsee.
Früher wurde Eis von Inuit auch zum Bau von Iglus verwendet.
Aus Eisblöcken werden Eisskulpturen errichtet. Auch Häuser aus Eis sind möglich.
Behindernd wirken Eisvorkommen vor allem auf den Verkehr in Form von Packeis für die Schifffahrt (siehe auch Eisbrecher), als glatter Eisfilm auf Straßen (siehe auch Schneeketten), Fußwegen oder an Flugzeugen, sowie als Schneewehen bei allen Land-Verkehrsträgern. Um die Rutschgefahr zu vermindern, werden Eisflächen mit Streusand abgestumpft oder mit Streusalz weggetaut.
Eisblumen an Fensterscheiben behindern die Sicht.
Auch Bauvorhaben können durch Verfestigungen des Bodens durch Eis behindert werden. Andererseits kann die Verfestigung des Bodens gewollt sein und z.B. Tunnelarbeiten in losem Boden erst möglich machen. Hierbei wird die Vereisung meist künstlich mit großen Kühlaggregaten erzeugt. In Permafrostgebieten stellt die Aufweichung des Bodens durch den fehlenden Frost eine Gefahr für Bauwerke dar. Teile der Lhasa-Bahn werden hierzu mit großen Wärmerohren (Heatpipes) gekühlt.
Wasserleitungen platzen, wenn sie einfrieren. Zum Schutz werden solche Leitungen unterhalb der Frostgrenze im Boden verlegt oder ein Mindestdurchfluss sichergestellt oder rechtzeitig entleert.
Siehe auch
- Planet Erde. Eiswelten. (OT: Ice Worlds), Dokumentation, Großbritannien, 2006, 43 Min., ein Film von Alastair Fothergill, Produktion: BBC, Inhaltsangabe der ARD
- Eiszeit
- Synthetisches Eis
- Eishotel, Eisklettern, Eisskulptur
Einzelnachweise
- ↑ a b Webmineral – Ice (engl.)
- ↑ a b MinDat – Ice (engl.)
- ↑ Dienstleistungszentren Ländlicher Raum Rheinland-Pfalz – Unterkühltes Wasser.
- ↑ Gefahren an gefrorenen Gewässern und Eisrettung.
- ↑ „Magnetfelder verändern den Schmelzpunkt von Wasser“, Die Welt, 8. Januar 2005.
- ↑ „Heißes Eis“, pro-physik.de, 13. Januar 2006.
- ↑ H. Iglev, M. Schmeisser, K. Simeonidis, A. Thaller and A. Laubereau: „Ultrafast superheating and melting of bulk ice“, in: nature, 439, 183–186, 12. Januar 2006; doi:10.1038/nature04415.
- ↑ Webmineral – New Dana Classification of Oxide Minerals.
- ↑ scinexx – Das Wissensmagazin: „Phoenix findet erstes Mars-Eis“.
- ↑ raumfahrer.net – Doch kein Eis auf dem Mond.
- ↑ American Mineralogist Crystal Structure Database - Ice (engl.)
- ↑ a b R. Steudel, Y. Drozdova: Chemie der Nichtmetalle: Mit Atombau, Molekülgeometrie und Bindungstheorie. 2. Auflage, S. 206–208, de Gruyter, 1998, ISBN 9783110123227
Literatur
- Astrid Döppenschmidt: Die Eisoberfläche - Untersuchungen mit dem Rasterkraftmikroskop. GCA-Verl., Herdecke 2000, ISBN 3-934389-71-6
- Werner F. Kuhs: Physics and chemistry of ice. RSC Publ.,London 2007, ISBN 978-0-85404-350-7
- Victor F. Petrenko, Robert W. Whitworth: Physics of ice. Oxford Univ. Press, Oxford 2006, ISBN 0-19-851894-3
- Miles McPhee: Air-ice-ocean interaction - turbulent ocean boundary layer exchange processes. Springer, New York 2008, ISBN 978-0-387-78334-5
- John D.Castello: Life in ancient ice. Princeton Univ.Press, Princeton 2005, ISBN 0-691-07475-5
- Pat Dasch: Icy worlds of the solar system. Cambridge Univ. Press, Cambridge 2004, ISBN 0-521-64048-2
- Gurij N. Jakovlev: Studies in ice physics and ice engineering. Israel Program for Scientific Translation Jerusalem 1973, ISBN 0-7065-1275-8
Weblinks
- Mineralienatlas:Eis (Wiki)
- Ausführliche Informationen (englisch)
- Ice Testing Information. Formeln zur Berechnung der Tragfähigkeit einer Eisfläche, (engl., PDF)
- Beurteilung der Tragfähigkeit von Eisdecken – Merkblatt des BLfW
Artikel
- „Der Eishandel in Nord-Amerika“, Zeitschrift für allgemeine Erdkunde, 1855
- „Nassforschers Träume“, Die Zeit, 27. November 2003, Nr. 49, S. 38, „Viereckige Schneeflocken, 500 Grad heißes Eis, wässriges Glas – die Wissenschaft staunt immer wieder neu über H2O“
- Forscher lassen Wasser bei Zimmertemperatur gefrieren, wissenschaft.de, 19. August 2005
Künstliches Eis
Wikimedia Foundation.






