- Faworski-Umlagerung
-
Die Faworski-Umlagerung (meistens Favorskii-Umlagerung geschrieben, englisch Favorskii rearrangement) ist eine Namensreaktion in der organischen Synthesechemie, die nach dem russische Chemiker Alexei Jewgrafowitsch Faworski (1860−1945) benannt wurde. Sie beschreibt die Umlagerung von α-Halogenketonen im basischen Milieu zu Carbonsäuren oder Carbonsäureestern. Ausgangssubstanzen sind Chlor- oder Bromketone, selten Iodketone. Geeignete Basen sind Hydroxide, Alkoholate und Amine. Mit Ammoniak können Carbonsäureamide entstehen.
Die Faworski-Umlagerung ist nicht zu verwechseln mit der Faworski-Reaktion.
Inhaltsverzeichnis
Historie
Bei Untersuchungen zur Chemie α-halogenierter Ketone beobachtete Faworski, dass beim Behandeln einiger aliphatischer Dihalogenketone des Typs RCH2CX2COCH2R’ mit verdünnter Kalilauge α,β-ungesättigte Carbonsäuren entstehen (siehe unten).[1]
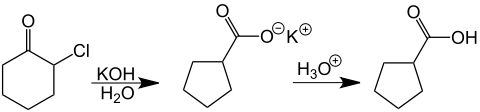
Als Beispiel für die Reaktion eines Monohalogenketons untersuchte er α-Chlorcyclohexanon und erhielt nach dem Ansäuern der alkalischen Lösung Cyclopentancarbonsäure. Diese Reaktion war damals besonders bemerkenswert, weil aus dem Kohlenstoff-Sechsring unter Ringverengung ein Fünfring entstanden war.[2]
Reaktionsmechanismen
Der genaue Ablauf der nach Faworski benannten Umlagerungen war lange Zeit umstritten. Schließlich wurde erkannt, dass mindestens zwei Mechanismen möglich sind.
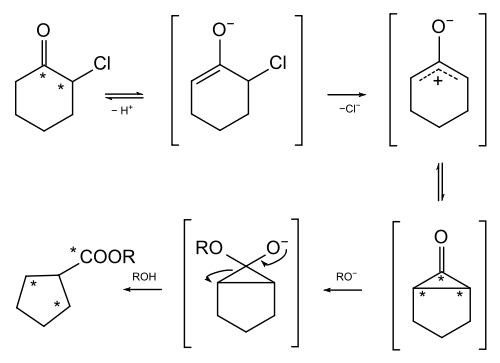
Im Falle des α-Chlorcyclohexanons tritt eine Zwischenstufe mit Cyclopropanon-Struktur auf, wie Loftfield durch Markierung mit 14C bewies.[3]
- Mechanismus der Faworski-Umlagerung von 2-Chlorcyclohexanon durch Natrium-ethoxid und Natrium-isoamyloxid (R = C2H5 bzw.(CH3)2CHCH2CH2). Die 14C-markierten Atome sind mit Stern (*) bezeichnet. Der spiegelsymmetrische Dreiring wird beim Angriff von Alkoxid-Ionen an beiden benachbarten C-C-Bindungen geöffnet, wodurch im Produkt die Atome C2 und C3 mit gleichem Anteil radioaktiv markiert sind (jeweils 25%); die Radioaktivität von C1 ist doppelt so hoch (50%).
Auch über die Bildung der Cyclopropanon-Zwischenstufe gab es Diskussionen. Bei der Deprotonierung des Chlorketons entsteht ein Enolat mit einer Allyl-Struktur. Burr und Dewar erkannten, dass diese erste Zwischenstufe dissoziieren könnte. Das zwitterionische Intermediat, später Oxyallyl genannt, könnte cyclisieren, wodurch der Dreiring entstünde.[4] Schließlich wurde dieser Prozess als Elektrocyclische Reaktion klassifiziert.
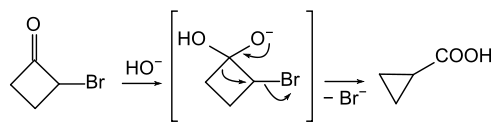
Während die Faworski-Umlagerung beim Chlorcyclopentanon nicht bekannt ist, liefert 2-Halogencyclobutanon Cyclopropancarbonsäure, neben 2-Hydroxycyclobutanon.[5], [6]
Die französischen Chemiker lieferten den Beweis, dass in diesem Fall Hydroxid am Carbonylkohlenstoffatom angreift und die benachbarte C-C-Bindung gespalten wird. Dieser Reaktionsmechanismus ähnelt der Benzilsäure-Umlagerung und wurde daher als „Semibenzilsäure-Umlagerung" bezeichnet.[7]
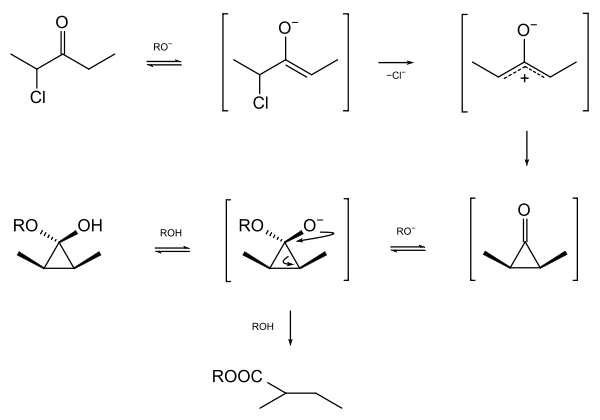
Über offenkettige (acyclische) Halogenketone gab es lange Zeit widersprüchliche Aussagen.[8]Eine Reihe von Chlor- und Bromketonen wurde von Föhlisch und Mitarbeitern mit Natriummethoxid in Methanol umgesetzt, wobei Carbonsäuremethylester zu erwarten waren. Mit Chlor- und Bromaceton wurde keine Faworski-Umlagerung gefunden, wohl aber mit 1-Chlor-3-methyl-butan-2-on, 2-Halogen-pentan-3-on und einigen höheren Halogenketonen. Diese Ketone reagieren nach dem Cyclopropanon-Mechanismus; substituierte Cyclopropanonhalbacetale konnten bei vorsichtiger Arbeitsweise isoliert und spektroskopisch untersucht werden. Durch überschüssiges Methoxid werden diese Intermediate zu Carbonsäuremethylestern umgelagert.[9], [10]
Faworski-Umlagerung von 2-Chlorpentan-3-on durch Natriummethoxid in Methanol (R = CH3)
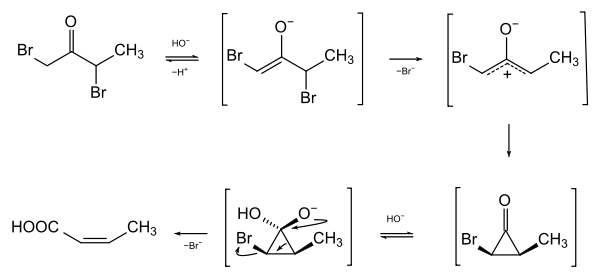
Die bereits von Faworski beobachete Reaktion von Dihalogenketonen mit Alkalien führt zu α,β-ungesättigten Carbonsäuren. Als Zwischenstufen sind halogensubstituierte Cyclopropanone anzunehmen. So entsteht aus 1,3-Dibrombutan-2-on cis-2-Butensäure („Isocrotonsäure“).[11], [12]
Verwendung
In der organischen Synthese werden Faworski-Umlagerungen immer dann verwendet, wenn alternative Synthesen von Carbonsäure(ester)n umständlicher sind als die von α-Halogenketonen.
Eine breite Anwendung findet die Faworski-Umlagerung bei cyclischen Verbindungen, da sich in der Regel ein n-gliedriger Ring in den nächstkleineren (n-1)-gliedrigen Ring umwandeln lässt.
Besonderes Aufsehen erregte eine Synthese des gespannten Kohlenwasserstoffs Cuban durch Eaton, bei der eine Faworski-Umlagerung (Semibenzilsäure-Mechanismus) ein Schlüsselschritt war.
Literatur
- Robert Jacquier, Rearrangement des cétones α-halogénées en acides sous l’influence des reactifs alcalins (Reaction de Faworsky), Bull. Soc. Chim. France 1950, D 35-45.
- Andrew Kende, The Favorskii Rearrangement, Org. React. 11, 261-316 (1960).
- J. M. Conia, J. R. Salaün, Cyclobutane Ring Contractions Not Involving Carbonium Ions, Acc. Chem. Res. 1972, 33-40.DOI:10.1021/ar50049a005.
- J. Bülle, A. Hüttermann, Das Basiswissen der Organischen Chemie, Wiley-VCH, 2000.
Weblinks
Einzelnachweise
- ↑ A. Faworski, Journal der Russischen Physikalisch-Chemischen Gesellschaft, 26, 559 (1894); Journal für praktische Chemie, 51,533 (1895).
- ↑ A. Faworski, W. Boshowski: Über isomere Umwandlungen der cyclischen α-Monochlorketone, Journal der Russischen Physikalisch-Chemischen Gesellschaft, 46, 1097-1102 (1914); Chemisches Zentralblatt 1915 I, 984:
- ↑ Robert Berner Loftfield, The Alkaline Rearrangement of α-Haloketones. II. The Mechanism of the Faworskii Reaction, J. Am. Chem. Soc., 1951, 73, 4707–4714 DOI: 10.1021/ja01154a066.
- ↑ J. G. Burr und M. J. S. Dewar, J. Chem. Soc. 1954, 1201.
- ↑ J. M. Conia, J. R. Salaün, Mecanisme de la transposition de Favorski de la bromo-2-cyclobutanone, Tetrahedron Letters 1963, 1175.
- ↑ J. M. Conia, J. R. Salaün, Cyclobutane Ring contractions Not Involving Carbonium Ions, Acc. Chem. Res. 1972, 33-40.DOI:10.1021/ar50049a005.
- ↑ B. Tchoubar und O. Sackur, C. R. Acad. Sci., 208, 1020 (1939).
- ↑ Andrew Kende, The Favorskii Rearrangement, Org. React. 11, 261-316 (1960).
- ↑ B. Föhlisch, E. Gehrlach, G. Henle, U. Boberlin, M. Gekeler, B. Geywitz, M. Ruck, H. Vogl, Reactions of Acyclic α-Chloro- and α-Bromoketones with Alkali Methoxide in Methanol. A Search for Cyclopropanone Hemiacetals, Journal of Chemical Research (S), 1991, 134-135; Journal of Chemical Research (M), 1991, 1401-1461.
- ↑ B. Föhlisch, E. Gehrlach, J. J. Stezowski, P. Kollat, E. Martin, W. Gottstein, Stereoselekive Bildung von Halbacetalen des cis-2,3-Dimethylcyclopropanons aus 2-Halogen-3-pentanonen. [4+3]-Cycloadditionen an konjugierte Dien-Systeme, Chemische Berichte, 119, 1661-1682 (1986).
- ↑ C. Rappe, Acta Chem. Scand 1963, 17, 2766-2769.
- ↑ C. Rappe, R. Adeström, Acta Chem. Scand. 1965, 19, 383-389.
Wikimedia Foundation.