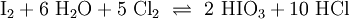- HIO3
-
Strukturformel 
Allgemeines Name Iodsäure Andere Namen Jodsäure
Summenformel HIO3 CAS-Nummer 7782-68-5 PubChem 24345 Kurzbeschreibung weißer Feststoff Eigenschaften Molare Masse 175,91 g·mol−1 Aggregatzustand fest
Dichte 4,63 g·cm−3 [1]
Schmelzpunkt 110 °C [1]
pKs-Wert 0,804[2]
Löslichkeit sehr gut in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Ätzend Brand-
fördernd(C) (O) R- und S-Sätze R: 8-34 S: 17-26-36/37/39-45 WGK 3 – stark wassergefährdend[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Iodsäure, auch Jodsäure, ist eine Halogensauerstoffsäure, wie Chlorsäure und Bromsäure. Sie ist die einzige der Halogen(V)-säuren des Typs HXO3, die sich wasserfrei isolieren lässt.
Inhaltsverzeichnis
Herstellung
Iodsäure wird durch Oxidation von Iod mit starken Oxidationsmitteln wie Salpetersäure (HNO3), Chlor, Chlorsäure oder Wasserstoffperoxid (H2O2) gewonnen:[3]
Die entstehende Salzsäure muss aus dem Gleichgewicht entfernt werden, da sie die Iodsäure wegen der Rückreaktion reduzieren und das Gleichgewicht auf die linke Seite verschieben würde. Dies kann beispielsweise mit Quecksilber(II)-oxid (HgO) erreicht werden.
Eigenschaften
Nach dem VSEPR-Modell ist Iodsäure pyramidal aufgebaut. Iodsäure bildet durchsichtige, farblose, rhombische Kristalle, die sich in Wasser sehr leicht lösen. Der Stoff ist eine mittelstarke Säure mit dem pKs-Wert 0,804 und wirkt stark oxidierend.
Iodate
Iodate sind die Salze der Iodsäure der allgemeinen Formel MeIO3. Sie sind beständiger als Chlorate und Bromate, aber wie diese starke Oxidationsmittel. Aus Iodaten kann man Iodsäure durch Reaktion mit Schwefelsäure freisetzen.
Sicherheitshinweise
Iodsäure und Iodate sind sehr starke Oxidationsmittel und können mit reduzierenden Stoffen wie Schwefel, Metallpulver oder organischen Substanzen explosionsartig reagieren.
Siehe auch
- Iodwasserstoffsäure HI
- Hypoiodige Säure HIO
- Iodige Säure HIO2
- Periodsäure HIO4, H5IO6
Quellen
Wikimedia Foundation.