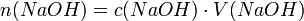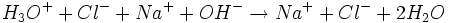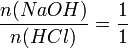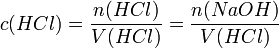- Alkalimetrie
-
Säure-Base-Titration ist ein maßanalytisches Verfahren zur Bestimmung der Konzentration von Säuren oder Basen in einer Lösung. An Stelle des Oberbegriffs Säure-Base-Titration wird die Bestimmung der Konzentration einer Säure gelegentlich Acidimetrie und die einer Base Alkalimetrie genannt.
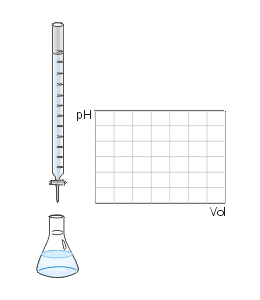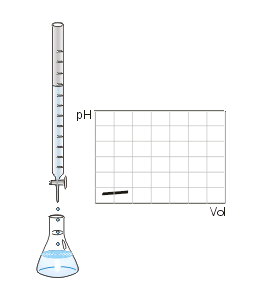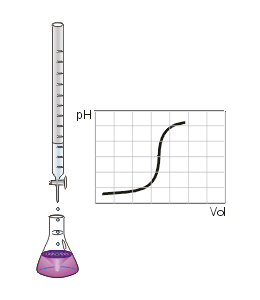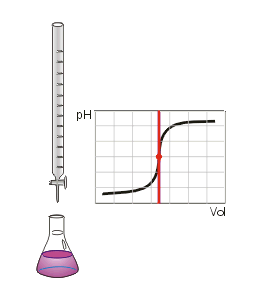
Die Bestimmung erfolgt durch Titration mit einer geeigneten Maßlösung. Für die Acidimetrie wird eine basische Lösung (oft 0,1 molare Natronlauge), für die Alkalimetrie eine saure Lösung (oft 0,1 molare Salzsäure) als Maßlösung eingesetzt. Im Verlauf der Titration verschiebt sich der pH-Wert der Probenlösung durch Neutralisation in Richtung einer neutralen Lösung, da H3O+ bzw. OH− zu H2O umgesetzt werden. Der Endpunkt der Titration ist der Äquivalenzpunkt und wird durch geeignete Indikatoren oder eine pH-Elektrode angezeigt. Der Äquivalenzpunkt liegt nicht bei pH 7, wenn sich in der Probenlösung neben Wasser auch andere Neutralisationsprodukte bilden, was z. B. bei einer Acidimetrie von Essigsäure auftritt.
Inhaltsverzeichnis
Beispiel
Bestimmung der Konzentration von Salzsäure mit Natronlauge
Zu einem bekannten Volumen an Salzsäure mit unbekannter Konzentration wird aus einer Bürette die Maßlösung (Natronlauge mit bekannter Konzentration) bis zum Umschlagspunkt des Indikators (z. B. Methylorange) hinzugetropft. Aufgrund des Volumen der untersuchten Salzsäure und verbrauchten Menge an Natronlauge bis zum Umschlagspunkt kann unter Zuhilfenahme der Reaktionsgleichung die Konzentration der Salzsäure berechnet werden.
Die Stoffmenge n der eingesetzten Natronlauge ergibt sich aus der Stoffmengenkonzentration c und dem Volumen V
Die Reaktionsgleichung der Neutralisation lautet:
Daraus folgt: Salzsäure reagiert mit Natronlauge im Stoffmengenverhältnis eins zu eins:
Die Konzentration der Salzsäure lässt sich nun aus der bekannten Stoffmenge und dem verwendeten Volumen errechnen:
Wahl des Indikators
Die Wahl des Indikators hängt von der verwendeten Säure und Base ab. Der Farbumschlag des Indikators sollte immer möglichst dicht im Äquivalenzpunkt liegen. Für das Beispiel der Titration von Salzsäure mit Natronlauge (starke Säure mit starker Base) eignet sich der Indikator Bromthymolblau, da seine Farbe etwa bei einem pH-Wert von 7 umschlägt, welches genau dem Äquivalenzpunkt der Neutralisationsreaktion von Salzsäure mit Natronlauge entspricht.
Soll man dagegen die Konzentration von schwachen Säuren, wie Essigsäure und Ameisensäure mit Hilfe von Natronlauge bestimmen, so verwendet man zum Beispiel den Indikator Phenolphthalein, dessen Umschlagspunkt von farblos nach rot-lila etwa bei dem pH-Wert von 10 liegt. Das ist nötig, da eine Lösung von gleichen Mengen an Essigsäure und Natronlauge leicht alkalisch reagiert.
Genauigkeit der Titration mit Indikator
Bei der Endpunktsbestimmung gibt es einige Unsicherheiten. Vor allem die Feststellung des Umschlagpunktes des Indikators bringt eine große Ungenauigkeit mit sich, abhängig vom Farbumschlag (abrupt oder sehr schleichend, deutlich unterschiedene Farben oder ähnliche Farbe...) des Indikators.
Durch geschickte Wahl des passenden Indikators bzw. einer Kombination mehrerer Indikatoren kann man die Konzentration jedoch meist sehr genau bestimmen.
Auch die Erfahrung spielt eine große Rolle. So gibt/gab es durchaus Methoden, einen "persönlichen Faktor" zu bestimmen, mit dem der Analysewert korrigiert wurde.
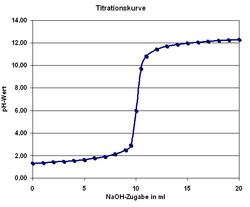
Titration mit einem pH-Meter
Man kann den Endpunkt der Titration auch mit Hilfe eines pH-Meters, also mit einem elektrischen Messgerät bestimmen. Diese Messmethode ergibt ein eindeutiges Ergebnis, das nicht von der Erfahrung des Ausführenden abhängt. Die Schrittweise zugegebenen Maßlösung und der jeweilige pH-Wert der Lösung kann in einer Titrationskurve dargestellt und ausgewertet werden.
Da insbesondere die mehrwertigen Säuren sog. Pufferkapazitäten haben, bei denen der pH-Wert relativ lange während der Titration konstant bleibt und der Neutralpunkt ziemlich plötzlich erreicht werden kann, lässt sich dieses Verhalten mit einem pH-Meter besser beobachten. Es entfällt dann natürlich der Einsatz eines Indikators.
Automatische Titration
Eine Weiterentwicklung der Titration mit dem pH-Meter führt dazu, dass nicht nur der pH-Wert elektronisch durch einen Computer erfasst wird, sondern auch die Zugabe der Titrationsflüssigkeit automatisch geregelt werden kann. Ferner kann der an die Titrationsapparatur angeschlossene Computer die Ergebnisse gleich weiterverarbeiten und z. B. in einen Konzentrationswert umrechnen.
Damit ist die Titration vollständig automatisierbar.
Siehe auch: Laborautomatisierung
Wikimedia Foundation.