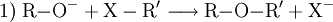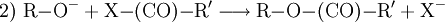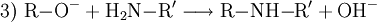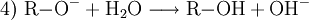- Alkanolat
-
Alkoholate, auch Alkoxide genannt, sind Salze aus Metallkationen und Alkoholatanionen. Die allgemeine Formel lautet (RO)nMe (Me = Metallion; n entspricht der Wertigkeit dieses Metallions). Alkoholationen entstehen durch Deprotonierung aus Alkoholen. In wässrigem Milieu können keine Alkoholate hergestellt werden, da das Hydroxidion zu schwach basisch ist, um die Hydroxygruppe der Alkohole zu deprotonieren. Deshalb werden stärkere Basen, beispielsweise Natriumamid oder elementares Natrium, eingesetzt. Alkoholate werden unter anderem zur Ethersynthese sowie als Kondensations-, Deprotonierungs- und Alkylierungsmittel eingesetzt.
Inhaltsverzeichnis
Darstellung
Alkoholate können durch Reaktion von elementaren Alkalimetallen mit Alkoholen synthetisiert werden.
Beispielsweise entsteht Natriumethanolat (Natriumethylat, C2H5ONa) als weißes bis gelbliches, hygroskopisches Pulver, durch Einwirkung von Natrium auf Ethanol, wobei Wasserstoffgas entweicht:
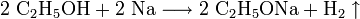
- Ethanol reagiert mit Natrium zu Natriumethanolat und Wasserstoff.
Eigenschaften
In reiner Form sind Alkoholate stark basische Feststoffe, ziehen jedoch aus der Luft Wasserdampf an und zerfließen allmählich, wobei der entsprechende Alkohol und das Metallhydroxid entstehen, z. B. nach:
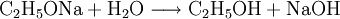
- Aus Natriumethanolat und Wasser entstehen Ethanol und Natriumhydroxid.
Verwendung und Reaktionen
Technisch finden Alkoholate Anwendung in der asymmetrischen Ethersynthese (Williamson-Ethersynthese mit Halogenalkanen) (1) oder als starke Basen. Mit Carbonsäurehalogeniden lassen sich Ester darstellen (2); mit primären Aminen erhält man sekundäre Amine (3). Bei Kontakt mit Wasser reagieren Alkoholate in einer Säure-Base-Reaktion zum entsprechenden Alkohol und Hydroxidionen. (4)
Alkoholate werden hauptsächlich von der Agrar- und der Pharmaindustrie verwendet. Auch bei der Produktion von Biodiesel und Kosmetika werden Alkoholate verwendet.
Weblinks
Wikimedia Foundation.