- Hypervalenz
-
Als Hypervalenz [griech. hyper: über, zu viel, siehe Griechische Präpositionen] wird die positive Abweichung zur Valenzstrukturtheorie bezeichnet, nach der die äußere Schale eines Atoms mehr als die nach der Edelgaskonfiguration von s- und p-Orbitalen möglichen acht Elektronen aufnehmen kann. Sie tritt bei Verbindungen von schweren Hauptgruppenelementen der 3. bis 8. Hauptgruppe mit starken Elektronendonatoren wie Sauerstoff oder Fluor auf. So zum Beispiel in Selenhalogeniden wie Selenhexafluorid (SeF6) oder Iodfluoriden (z. B. IF5, IF7), generell in vielen Edelgas- und Interhalogenverbindungen. Bis vor kurzem wurde hier eine Beteiligung der d-Orbitale des Zentralatoms angenommen, allerdings wird inzwischen eine Beschreibung durch eine elektronenreiche Mehrzentrenbindung bevorzugt.
Beispiele
Hypervalente Iodverbindungen
In der organischen Synthesechemie werden hypervalente Iodverbindungen als milde Oxidationsmittel vielfach eingesetzt. Zu diesen „modernen“ Oxidationsmitteln zählen u. a:
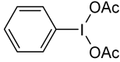
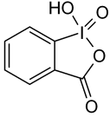
Iodosylbenzol [1][2] Di-acetoxy-iodbenzol (DIB) [1][2][3] Dess-Martin-Periodinan (DMP) [1][2] 2-Iodoxybenzoesäure (IBX) [1][2][3] 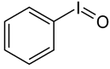
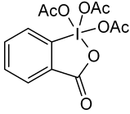
Dess-Martin-Periodinan wird besonders in der so genannten Dess-Martin-Oxidation eingesetzt. Weiterhin gibt es Reagenzien mit hypervalentem Iod, die zur elektrophilen Einführung von Iod (Angriff von I+ auf Nucleophile, z. B. C-C-Doppelbindungen) dienen:
Di-sym-collidin-iodoniumperchlorat [4] 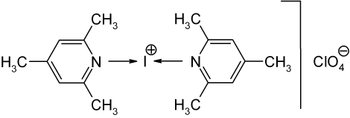
Einzelnachweise
- ↑ a b c d Zhdankin, V. V.; Stang, P. J. Chemical Reviews 2002, 102, 2523−2584
- ↑ a b c d Wirth, T. Angew. Chem. 2005, 117, 3722−3731
- ↑ a b Richardson, R. D.; Wirth, T. Angew. Chem. 2006, 118, 4510−4512
- ↑ Griffith, D. A.; Danishefsky, S. J. J. Am. Chem. Soc. 1990, 112, 5811−5819
Wikimedia Foundation.
