- Kaliumperiodat
-
Strukturformel 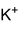
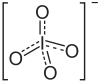
Allgemeines Name Kaliumperiodat Andere Namen - Kaliummetaperiodat
- Kaliumtetroxoiodat(VII)
Summenformel KIO4 CAS-Nummer 7790-21-8 Kurzbeschreibung farb- und geruchloser Feststoff[1]
Eigenschaften Molare Masse 230,00 g·mol−1 Aggregatzustand fest
Dichte 3,62 g·cm−3[1]
Schmelzpunkt Löslichkeit 0,51 % (in Wasser bei 25 °C)[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 

Gefahr
H- und P-Sätze H: 272-315-319-335 EUH: keine EUH-Sätze P: 220-261-305+351+338 [3] EU-Gefahrstoffkennzeichnung [1] 

Brand-
förderndReizend (O) (Xi) R- und S-Sätze R: 8-36/37/38 S: 17-26-37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kaliumperiodat ist das Kaliumsalz der Periodsäure. Es ist ein weißer, kristalliner Feststoff, der sich in Wasser relativ schlecht löst.
Inhaltsverzeichnis
Gewinnung und Darstellung
Zur Darstellung im Labor verwendet man Kaliumiodat, das mit Hilfe von Kaliumperoxodisulfat im Alkalischen (zweckmäßigerweise in Kalilauge, KOH) oxidiert wird:
Die Reaktion wird in siedender Lösung durchgeführt. Danach kann das Salz mittels Neutralisation mit halbkonzentrierter Salpetersäure ausgefällt, mit Eiswasser gewaschen und abfiltriert werden. Eine andere Möglichkeit ist das Einleiten von Chlor in alkalische Kaliumiodatlösung.[4][5]:
Eigenschaften
Kaliumperiodat ist ein starkes Oxidationsmittel. So wird eine wässrige Lösung von Kaliumiodid von Kaliumperiodat zum elementaren Iod oxidiert, Mangan(II)-Salze werden zu Permanganaten oxidiert.[6]
Seine Kristalle sind isomorph mit Kaliumperchlorat. Beim Auflösen in Kalilauge entsteht Kaliumdiperiodat[5], das mit Salpetersäure wieder zum einfachen Kaliumperiodat rückgeführt werden kann.[6][7]
Kaliumorthoperiodat K2H3IO6, das durch Oxidation von Kaliumiodat mit Natriumhypochlorit entsteht[6], gibt bei 100 °C Wasser ab und geht in Kaliumdiperiodat über.[8]
In wäßrigen Lösungen von Periodaten liegen folgende Gleichgewichte vor:[6]
Verwendung
Neben seiner Wirkung als Oxidationsmittel wird Kaliumperiodat als Reagens zur analytischen Bestimmung von Cer verwendet.[9]
Einzelnachweise
- ↑ a b c d Datenblatt Kaliumperiodat bei AlfaAesar, abgerufen am 29. Januar 2010 (JavaScript erforderlich)..
- ↑ D'Ans-Lax, Taschenbuch für Chemiker und Physiker, 4. Auflage, Band 2, Springer Verlag 1982, ISBN 3-540-12263-X.
- ↑ a b Datenblatt Potassium periodate bei Sigma-Aldrich, abgerufen am 7. April 2011.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 325.
- ↑ a b C. Rammelsberg: "Ueber die Ueberjodsäure und ihre Salze" in Ber. d. dt. chem. Ges. 1868, A1, S. 70ff. Volltext
- ↑ a b c d C. E. Housecroft, A. G. Sharpe: "Inorganic chemistry", Verlag Pearson Education, 2005, ISBN 9780130399137. S. 487 (Eingeschränkte Vorschau in der Google Buchsuche)
- ↑ # B. Brehler, H. Jacobi, H. Siebert: "Kristallstruktur und Schwingungsspektrum von K4J2O9" in Zeitschrift für anorganische und allgemeine Chemie 1968, 362(5-6), S. 301-311. doi:10.1002/zaac.19683620510
- ↑ N. I. Nikitina,Z. K. Nikitina: "Thermolysis of disubstituted lithium and sodium orthoperiodates" in Russian Journal of Inorganic Chemistry 2007,52(4), S. 535–541. doi:10.1134/S0036023607040031
- ↑ M. Venugopalan and K. J. George: "Determination of cerium by potassium periodate" in Naturwissenschaften, 43(15), S. 348-349. doi:10.1007/BF00755157
Kategorien:- Brandfördernder Stoff
- Reizender Stoff
- Kaliumverbindung
- Iodverbindung
Wikimedia Foundation.









