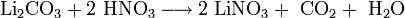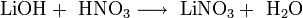- LiNO3
-
Kristallstruktur 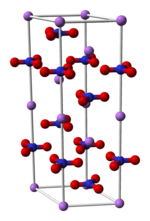
__ Li+ __ N __ O Allgemeines Name Lithiumnitrat Verhältnisformel LiNO3 CAS-Nummer 7790-69-4 Kurzbeschreibung Weißes Pulver Eigenschaften Molare Masse 68,95 g·mol−1 Aggregatzustand fest
Dichte 2,36 g·cm−3[1]
Schmelzpunkt 255 °C[1]
Siedepunkt Zersetzung > 600 °C[1]
Löslichkeit gut (522 g/l bei 20 °C) in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Brand-
fördernd(O) R- und S-Sätze R: 8 S: 24/25 LD50 1426 mg/kg (Ratte, oral)[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lithiumnitrat ist eine chemische Verbindung mit der Summenformel LiNO3, die natürlich in der Form LiNO3·3 H2O vorkommt. Es handelt sich hierbei um das Lithiumsalz der Salpetersäure. Das farblose, hygroskopische Salz besitzt eine Molare Masse von 68,95 g/mol, eine Dichte von 2,36 g·cm−3 und eine Schmelztemperatur von 264 °C. Bei Temperaturen oberhalb von 600 °C erfolgt Zersetzung. Lithiumnitrat ist in Alkohol und Wasser sehr gut löslich.
Gewinnung und Darstellung
Die Herstellung von Lithiumnitrat erfolgt durch Umsetzung von Lithiumcarbonat[3] oder Lithiumhydroxid[4] mit Salpetersäure.
Verwendung
LiNO3 wird zur Herstellung von Rotfeuerwerk[3] verwendet sowie als Wärmeträgermedium[5] genutzt. Des Weiteren kann es zur Herstellung anderer Lithiumverbindungen dienen. Lithiumnitrat wird auch in einem Gemisch mit Kaliumnitrat als Sabalith verkauft. Dieses niedrigschmelzende Eutektikum wird zur Salzbadvulkanisation von Gummimischungen verwendet.[6] Lithiumnitrat-trihydrat wurde auch zur Kühlung des Landers der Venera-Mission verwendet, da es beim Schmelzen (Schmelzpunkt des Trihydrats ca. 30 °C) Wärme aufnimmt und somit bis zum vollständigen Schmelzen eine kontinuierliche Temperatur von 30 °C gewährleistet.[7]
Quellen
- ↑ a b c d e Sicherheitsdatenblatt (Merck)
- ↑ Sicherheitsdatenblatt Sigma-Aldrich
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie 1995, 101. Auflage, de Gruyter. ISBN 3-11-012641-9, S. 1154.
- ↑ D. L. Perry, S. L. Phillips: Handbook of Inorganic Compounds: An Electronic Database. CRC Press, 1995, ISBN 9780849386718, S. 228
- ↑ Europäisches Patent EP0363678 1989, Metzler GmbH
- ↑ Winnacker, Küchler: Chemische Technik: Prozesse und Produkte. 2006, Wiley-VCH Weinheim, ISBN 3-527-31578-0
- ↑ www.Bernd-leitenberger.de
Wikimedia Foundation.