- Anthracen
-
Strukturformel 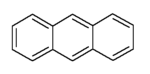
Allgemeines Name Anthracen Andere Namen - Paranaphthalin
- Anthrazen
Summenformel C14H10 CAS-Nummer 120-12-7 PubChem 8418 Kurzbeschreibung Eigenschaften Molare Masse 178,24 g·mol−1 Aggregatzustand fest
Dichte 1,25 g·cm−3 [3]
Schmelzpunkt Siedepunkt 340 °C [1]
Dampfdruck Löslichkeit - gut in siedendem Benzol[2]
- wenig in Ethanol, Chloroform Diethylether und kaltem Benzol[2]
- unlöslich in Wasser[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [4] keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze [4] EU-Gefahrstoffkennzeichnung [1] 

Reizend Umwelt-
gefährlich(Xi) (N) R- und S-Sätze R: 36/37/38-50/53 S: 26-60-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Anthracen (von griech. anthrax, ‚Kohle‘), auch Paranaphthalin oder veraltet Anthrazen ist ein farbloser kristalliner Feststoff, der leicht sublimiert. Es ist ein polycyclischer aromatischer Kohlenwasserstoff und organischer Halbleiter mit der Summenformel C14H10, der aus drei anellierten Benzolringen aufgebaut ist.
Inhaltsverzeichnis
Geschichte
Anthracen wurde 1832 zum ersten Mal von Auguste Laurent und Jean Dumas aus dem Teer isoliert. Laurent stellte auch 1836 durch Oxidation des Anthracens Anthrachinon und Phthalsäure zum ersten Mal her.
Vorkommen
Auf der Erde findet sich Anthracen in Steinkohlenteer. Oxidierte Anthracenderivate - meist Anthrachinone - kommen häufig in Organismen vor. Positiv geladene Anthracenmoleküle wurden sowohl in Meteoriten wie auch kürzlich von der Royal Astronomical Society in interstellarer Materie nachgewiesen.[5] Das komplexeste Molekül, das vor dem Anthracen im interstellaren Raum entdeckt wurde, war Naphthalin.
Gewinnung und Darstellung
Anthracen wird industriell aus Steinkohlenteer gewonnen. Die synthetische Herstellung erfolgt durch Pyrolyse von 2-Methylbenzophenon oder durch Friedel-Crafts-Alkylierung von 2-Brombenzylbromid. Alternativ kann es auch durch Reduktion von Anthrachinon hergestellt werden, welches wiederum durch Diels-Alder-Reaktion von p-Benzochinon mit 1,3-Butadien oder durch Friedel-Crafts-Acylierung von Benzol mit Phthalsäureanhydrid in Gegenwart von Aluminiumchlorid zugänglich ist. Letztere war die ursprüngliche Synthese, die 1883 von Richard Anschütz erfunden wurde. Die am häufigsten verwendeten Reduktionsmittel für Anthrachinon sind:
- Zink im alkalischen Milieu,
- amalgamiertes Aluminium in sekundären Alkoholen,
- Zinn(II)-chlorid und HCl in Essigsäure
- Natriumborhydrid
Eigenschaften
 Dimerisation des Anthracen.
Dimerisation des Anthracen.
Anthracen kristallisiert in farblosen bis gelblichen Blättchen, die violett fluoreszieren[6] und leicht sublimieren. Sie schmelzen bei 216,3 °C und sieden bei 340 °C. Anthracen ist in Wasser nahezu unlöslich (etwa 0,1 mg/l bei 25 °C), wenig löslich in Ethanol (15 g/l) und Ether, und gut löslich in siedendem Benzol. Anthracen riecht nur sehr schwach aromatisch, ist nahezu geruchlos. Da im Anthracen nur ein Sechsring ein π-Elektronensextett enthält, ist es ziemlich reaktiv, reaktiver als das Isomer Phenanthren, das im Gegensatz zum Anthracen zwei Ringe mit einem π-Elektronensextett aufweist. Vor allem die Positionen 9 und 10 stellen hier ideale Angriffspunkte z. B. für Oxidationen dar, durch welche Anthracen beispielsweise in Anthrachinon umgewandelt werden kann. Anthracen dimerisiert durch UV-Licht-Einfluss; das Dimer zerfällt aber schon durch Wärmeeinwirkung wieder.
Der Flammpunkt liegt bei 121 °C, die Zündtemperatur bei 538 °C. Ab einem Luftvolumenanteil von 0,6 % bildet es explosive Gemische. Anthracen ist wassergefährdend (WGK 2).[1]
Verwendung
Anthracen kommt im Steinkohlenteer vor, hierher kommt auch sein Name. Anthracen wird fast ausschließlich zu Anthrachinon weiterverarbeitet,[7] welches den Ausgangspunkt für die Anthrachinonfarbstoffe darstellt und somit die Grundlage für die Alizarin- und Indanthrenfarbstoffe ist. Eine weitere Verwendung findet das Anthracen als Basisstoff für die Herstellung von Schädlingsbekämpfungsmitteln und Gerbstoffen.
Nomenklatur
Nach der IUPAC-Nomenklatur ist für Anthracen eine spezielle Positionsnummerierung der Kohlenstoffatome erklärt, die sich von der (Spezial-) Nummerierung seines Isomers Phenanthren ableitet.[8] Diese Nummerierung wird teilweise auch auf heterocyclische Verbindungen mit derselben Grundstruktur (bei denen ledigliche Kohlenstoffatome durch andere Atome ersetzt sind) übertragen. Ein Beispiel ist Pyrido[3,2-b]benzothiazin und Derivate davon wie Prothipendyl. Dort fällt dann die übliche dominante Rolle der Hetero-Atome bei der Nummerierung weg.
-
Phenanthren mit Spezialnummerierung.
Die Standardnummerierung von Anthracen würde bis zur Position 4 mit der hier gezeigten übereinstimmen, dann aber ohne „Sprünge“ rundum weitergehen. Bei Phenanthren würde hingegen die Standardnummerierung gegensinnig laufen müssen und bei der hier gezeigten Position 4 beginnen.
Einzelnachweise
- ↑ a b c d e f Eintrag zu CAS-Nr. 120-12-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. August 2009 (JavaScript erforderlich).
- ↑ a b c d Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ Wolfgang Gerhartz (Hrsg.): Ullmann's Encyclopedia of Industrial Chemistry, Vol. A 2, VCH, 4. Aufl., Weinheim, 1985, ISBN 3-527-20102-5.
- ↑ a b Datenblatt Anthracen bei Sigma-Aldrich, abgerufen am 9. März 2011.
- ↑ Scinexx: Komplexer Kohlenwasserstoff im All entdeckt. Meldung vom 23. Juni 2010.
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006.
- ↑ Bertram Philipp, Peter Stevens: Grundzüge der Industriellen Chemie, VCH Verlagsgesellschaft mbH, 1987, S. 183, ISBN 3-527-25991-0.
- ↑ IUPAC Nomenclature of Organic Chemistry: Rule A-22.5 (siehe Beispiele).
Kategorien:- Reizender Stoff
- Umweltgefährlicher Stoff
- Polycyclischer aromatischer Kohlenwasserstoff
- Organischer Halbleiter
Wikimedia Foundation.


