- Magnesiumchlorid
-
Kristallstruktur 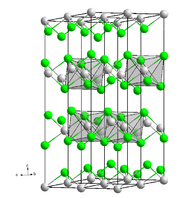
__ Mg2+ __ Cl- Allgemeines Name Magnesiumchlorid Andere Namen E 511
Verhältnisformel MgCl2 CAS-Nummer - 7786-30-3 (wasserfrei)
- 7791-18-6 (Hexahydrat)
Kurzbeschreibung farblose, bitter schmeckende, zerfließliche, hexagonale Kristalle[1]
Eigenschaften Molare Masse Aggregatzustand fest
Dichte 2,32 g·cm–3 (20 °C, wasserfrei) [2]
Schmelzpunkt Siedepunkt 1412 °C [2]
Löslichkeit gut in Wasser (542 g·l−1 bei 20 °C) [2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze EU-Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36/37 S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Magnesiumchlorid, MgCl2, ist das Magnesiumsalz der Salzsäure. Es bildet mehrere Hydrate.
Inhaltsverzeichnis
Vorkommen
Magnesiumchlorid kommt in der Natur im Mineral Bischofit (MgCl2 • 6H2O) sowie als Doppelsalz Carnallit (KMgCl3 · 6 H2O) vor. Eine weitere natürliche Quelle ist das Meerwasser. In manchen Salzseen ist die Konzentration von Magnesium-Ionen sogar höher als die der Natrium-Ionen.
Gewinnung und Darstellung
Die technische Gewinnung von Magnesiumchlorid erfolgt durch Eindampfen der Endlaugen aus der Produktion von Kaliumchlorid. Dabei wird zuerst das Magnesiumchlorid-Hexahydrat (MgCl2 · 6H2O) erhalten. Weiteres Eindampfen liefert ein wasserärmeres Produkt. Wasserfreies Magnesiumchlorid wird durch Umsetzung von Magnesiumoxid mit Koks und Chlor gewonnen:
Im Labor kann Magnesiumchlorid aus Magnesiumhydroxid und Salzsäure
oder durch Umsetzung von Magnesium mit Salzsäure
gewonnen werden.
Eigenschaften
Magnesiumchlorid ist stark hygroskopisch. Seine Neigung zur Hydrolyse ist weniger ausgeprägt als beim Aluminiumchlorid (AlCl3). Wasserfreies Magnesiumchlorid kristallisiert im CdCl2-Gittertyp.
Magnesiumchlorid-Hexahydrat besitzt eine molare Masse von 203,3 g·mol–1, eine Dichte von 1,57 g·cm–3 und einen Schmelzpunkt von ca. 117 °C (Zersetzung).[2] Die Löslichkeit des Hexahydrates beträgt 1700 g/L (bei 20 °C).
Die Standardbildungsenthalpie von Magnesiumchlorid beträgt -642 kJ·mol-1.[4]
Verwendung
- Magnesiumchlorid wird zur Gewinnung von elementarem Magnesium mittels Schmelzflusselektrolyse genutzt:[1]
- Es wird zusammen mit Magnesiumoxid in Estrichzementen verwendet, als Streusalzergänzung und als Lebensmittelzusatzstoff mit der Kennzeichnung (E-Nummer) E 511. Es dient als künstlicher Geschmacksverstärker und ist für Öko-Lebensmittel zugelassen.
- Des Weiteren wird Magnesiumchlorid zur Anhebung der Magnesiumkonzentration in Riffaquarien verwendet.
- Es wird auch zur Staubbindung (Explosionsschutz) im Steinkohlebergbau verwendet.
- Zur Bindung von Straßenstaub wurde es versuchsweise in einer Antistaubit genannten Lauge zu Versuchszwecken verwendet.
- Als Magnesium Oil, eine gesättigte Magnesiumchlorid-Wasser–Lösung mit öliger Konsistenz, wird es in konzentrierter Form zur transdermalen Magnesiumsubstitution (Aufnahme über die Haut) verwendet.
Einzelnachweise
- ↑ a b Helmut Sitzmann, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e f Eintrag zu Magnesiumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. März 2008 (JavaScript erforderlich)
- ↑ Datenblatt Magnesium chloride bei Sigma-Aldrich, abgerufen am 9. April 2011.
- ↑ Eintrag bei www.thieme.de
MagnesiumhalogenideMagnesiumfluorid | Magnesiumchlorid | Magnesiumbromid | Magnesiumiodid
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Magnesiumchlorid [1] — Magnesiumchlorid (Chlormagnesium) MgCl2, kommt in der Natur hauptsächlich als Carnallit (KMgCl3 + 6H2O) und in einigen andern Verbindungen in den Staßfurter Abraumsalzen vor, bei deren Verarbeitung es auch technisch gewonnen wird. Es ist ferner… … Lexikon der gesamten Technik
Magnesiumchlorīd — (Chlormagnesium) MgCl2 findet sich in Verbindung mit Chlorkalium als Carnallit, mit Chlorcalcium als Tachydrit in den Staßfurter Abraumsalzen, gelöst im Meerwasser, in Mineralquellen und Salzsolen; es entsteht beim Verbrennen von Magnesium in… … Meyers Großes Konversations-Lexikon
Magnesiumchlorid [2] — Magnesiumchlorid (Chlormagnesium), MgCl2. – Geschmolzen liefert es durch stärkeres Erhitzen in Gegenwart von Wasserdampf Salzsäure. In wenig Wasser gelöst, ergibt es durch Mischen mit Magnesia, MgO, den sogenannten Sorel Zement,… … Lexikon der gesamten Technik
Magnesiumchlorid — ◆ Ma|gne|si|um|chlo|rid 〈[ klo ] n. 11; unz.; Chem.〉 weißes, nur im Meerwasser vorkommendes Salz ◆ Die Buchstabenfolge ma|gn... kann in Fremdwörtern auch mag|n... getrennt werden. * * * Ma|g|ne|si|um|chlo|rid: MgCl2; farblose, bitter schmeckende… … Universal-Lexikon
Magnesiumchlorid — ◆ Ma|gne|si|um|chlo|rid 〈[ klo ] n.; Gen.: s; Pl.: unz.; Chemie〉 weißes, im Meerwasser vorkommendes Salz ◆ Die Buchstabenfolge ma|gn… kann auch mag|n… getrennt werden … Lexikalische Deutsches Wörterbuch
Magnesiumchlorid — Ma|gne|si|um|chlo|rid [...klo...] das; s, e: farbloses Salz, das im Meerwasser u. in Salzseen vorkommt … Das große Fremdwörterbuch
E511 — Kristallstruktur Mg2+ Cl … Deutsch Wikipedia
E 511 — Kristallstruktur Mg2+ Cl … Deutsch Wikipedia
MgCl2 — Kristallstruktur Mg2+ Cl … Deutsch Wikipedia
Mg2+ — Eigenschaften … Deutsch Wikipedia




