- Resorcin
-
Strukturformel 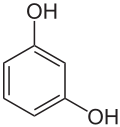
Allgemeines Name Resorcin Andere Namen - 1,3-Dihydroxybenzol
- m-Dihydroxybenzol
- Resorcinol
Summenformel C6H6O2 CAS-Nummer 108-46-3 PubChem 5054 ATC-Code D10AX02
Kurzbeschreibung große, farblose, süß schmeckende Nadeln[1]
Eigenschaften Molare Masse 110,11 g·mol−1 Aggregatzustand fest
Dichte 1,28 g·cm−3[2]
Schmelzpunkt Siedepunkt 277 °C[2]
Dampfdruck pKs-Wert Löslichkeit - sehr gut in Wasser (1400 g·l−1 bei 20 °C)[2], Ethanol, Diethylether und Glycerin[1]
- schlecht in Chloroform und Schwefelkohlenstoff[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [4] 

Achtung
H- und P-Sätze H: 302-319-315-400 EUH: keine EUH-Sätze P: 273-302+352-305+351+338 [2] EU-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [4] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 22-36/38-50 S: (2)-26-61 MAK noch nicht eingestuft[2]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Resorcin (1,3-Dihydroxybenzol) leitet sich formal vom Benzol ab. Der Benzolkern trägt zwei Hydroxygruppen in meta-Stellung. Es gehört zur Stoffgruppe der Phenole (Diphenole) und ist isomer zu Brenzcatechin (1,2-Dihydroxybenzol) und Hydrochinon (1,4-Dihydroxybenzol).
Inhaltsverzeichnis
Gewinnung und Darstellung
Resorcin kann man durch Destillation von Naturharzen (lateinisch resina) gewinnen.
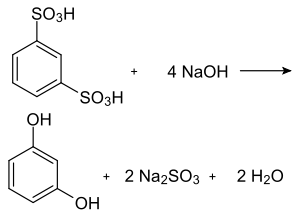
Technisch stellt man es durch Schmelzen von m-Benzoldisulfonsäure mit Natriumhydroxid (Alkalischmelze) her. Dabei fällt Natriumsulfit als Nebenprodukt an.
Eigenschaften
Physikalische Eigenschaften
Resorcin löst sich leicht in Wasser, Ethanol und Ether. Bei 20 °C lösen sich in 100 Gramm Wasser 150 Gramm Resorcin. Die gute Löslichkeit in Wasser wird vor allem durch Wasserstoffbrückenbindungen zwischen den beiden phenolischen Hydroxygruppen und den Lösemittelmolekülen verursacht.
Chemische Eigenschaften
Mit Eisen(III)-chlorid-Lösung geht Resorcin eine für die Phenole charakteristische Farbreaktion ein; es bildet sich eine tiefviolette Lösung.
Wie alle Phenole wirkt Resorcin schwach sauer, da die phenolischen Hydroxygruppen leichter deprotoniert werden als alkoholische; die Säurekonstante für die erste Protolysestufe beträgt pKs = 9,48[3].
Im Gegensatz zu Brenzcatechin und Hydrochinon wirkt Resorcin nur schwach reduzierend und fällt aus ammoniakalischer Silbernitratlösung kein elementares Silber aus. Erst in der Hitze scheidet sich schwarzes Silber ab.
Auch eine alkalische Lösung färbt sich an der Luft nur sehr langsam gelb. Alkalische Lösungen von Brenzcatechin und Hydrochinon verfärben sich dagegen durch Einwirkung des Sauerstoffs rasch braun.
Außerdem lässt sich Resorcin zur Unterscheidung von Fructose und Glucose heranziehen. Mischt man Fructose, Resorcin und konzentrierte Salzsäure zusammen, ergibt sich eine markante Rotfärbung (Seliwanow-Probe). Dieser Nachweis ist äußerst hilfreich, da Fructose, als Ketohexose, eine positive Fehling-Probe liefert, aufgrund der leichten Umwandlung von Fructose zu Glucose, oder auch halbacetalische OH-Gruppen ausbildet.
Reaktionen
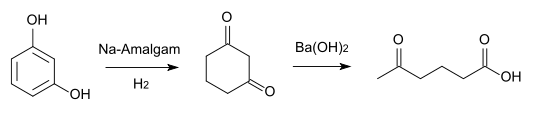
Natriumamalgam reduziert das Resorcin zum Dihydroresorcin (1,3-Cyclohexandion)[6], das mit konzentrierter Bariumhydroxidlösung beim Erhitzen auf 150–160 °C in 4-Acetylbuttersäure (5-Oxohexansäure, CAS 3128-06-1) übergeht.[7]
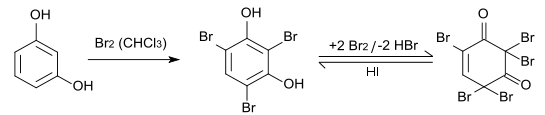
Mit Bromwasser bildet sich 2,4,6-Tribromresorcin.[8][9] Wenn Brom im Überschuss eingesetzt wird, reagiert das 2,4,6-Tribromresorcin zu 2,4,4,6,6-Pentabrom-1-cyclohexen-3,5-dion weiter.[10] Durch Zugabe von Kaliumiodid kann diese Reaktion rückgängig gemacht werden.
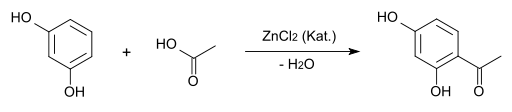
Mit Säuren und Säurechloriden findet in Gegenwart wasserentziehender Mittel Acylierung statt, so entsteht bei der Reaktion mit Eisessig mit Zinkchlorid als Katalysator bei 145 °C Resacetophenon.[11]
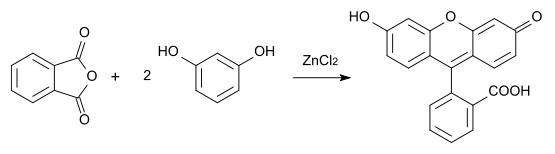
Mit den Anhydriden von zweibasigen Säuren entstehen Fluoresceine, z.B. aus Phthalsäureanhydrid entsteht Fluorescein:[12][13]
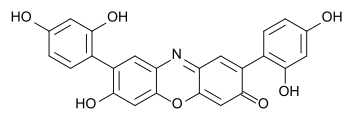
Mit Natriumnitrit bildet sich eine wasserlösliche, blaue Substanz, die sich bei Säurezugabe rot färbt. Diese Substanz wird als Lacmoid oder Resorcinblau bezeichnet und wird als Indikator eingesetzt.[14]
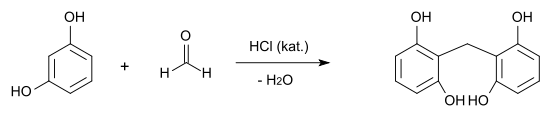
Resorcin kondensiert mit Aldehyden, so bildet sich mit Formaldehyd in Gegenwart von Salzsäure als Katalysator das Methylendiresorcin. Mit Chloralhydrat bildet sich in Anwesenheit von Kaliumbisulfat als Katalysator das Lacton der Tetraoxydiphenylmethancarbonsäure.[15]
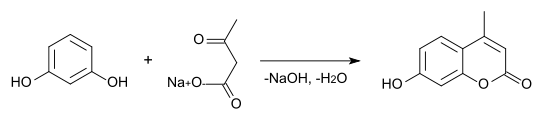
In alkoholischer Lösung kondensiert Resorcin mit Natriumacetylacetat zu Methylumbelliferon.[16]
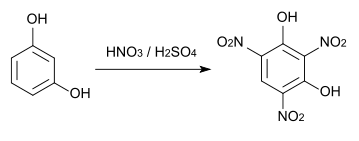
Das Trinitroresorcin (Styphninsäure) wird bei Reaktion mit konzentrierter Salpetersäure und kalter konzentrierter Schwefelsäure gebildet. Styphninsäure und vor allem sein Bleisalz werden als Sprengstoffe eingesetzt.
Mit Aldehyden kann Resorcin unter Brønstedt-Säurekatalyse zu Resorcinarene kondensieren.
Verwendung
Resorcin wird zur Herstellung von Farbstoffen, besonders Triphenylmethanfarbstoffen (Fluorescein, Eosin Y), und Kunststoffen (Phenoplaste) verwendet. Hauptverwendung von Resorcin und Resorcinharzen ist die Haftvermittlung zwischen den Gewebeeinlagen oder Stahlcord mit den Gummicompounds im Reifenbau. Resorcinformaldehydharze (Phenol-Resorcin-Formaldehyd-Kleber) werden auch noch vielfach als Klebstoff bei großen Holzkonstruktionen verwendet. Neuere Anwendungen sind Flammschutzmittel auf Phosphorsäureesterbasis und lichtbeständige, transparente Polymere.
Pharmakologische Wirkung
In höherer Konzentration ist Resorcin giftig, in verdünnten Lösungen entfaltet es antiseptische Wirkung und wird daher in der Dermatologie zur Heilung von Ekzemen in Salben oder Haarwässern verwendet, wie auch als Keratolytikum bei Dermatosen der behaarten Kopfhaut.
Einzelnachweise
- ↑ a b c Ullrich Jahn, in: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e f g Eintrag zu CAS-Nr. 108-46-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. Januar 2008 (JavaScript erforderlich).
- ↑ a b c CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b Eintrag zu CAS-Nr. 108-46-3 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ a b Sicherheitsdatenblatt Hedinger.
- ↑ Merling, in: Ann., 1894, 28, S. 278.
- ↑ Ralf Krelaus: "Synthese von bicyclischen Lactamen durch Ugi-Reaktion und Ringschlussmetathese", Dissertation, Universität Paderborn, 2003.
- ↑ Timo Liebig: "Konkave N-Heterocyclische Katalysator-Systeme", Dissertation, Universität Kiel, 2006.
- ↑ Michael Abbass: "Konkave 1,10-Phenantroline mit zusätzlicher Funktionalität in 4'-Position", Dissertation, Universität Kiel, 2002.
- ↑ H. P. Latscha, H. A. Klein, G. W. Linti: "Analytische Chemie" (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ M. Nencki, N. Sieber, in: J. Prakt. Chem., 1881, 23, S. 147.
- ↑ Arbeitsvorschrift auf www.oc-praktikum.de.
- ↑ Reaktionsmechanismus für die Bildung von Fluorescein.
- ↑ M. C. Traub and C. Hock, in: Ber., 1884, 17, S. 2615.
- ↑ J. T. Hewitt and F. G. Pope, in: Jour. Chem. Soc., 1897, 75, S. 1084.
- ↑ A. Michael, in: J. Prakt. Chem., 1888, 37, S. 470.
Kategorien:- ATC-D10
- Gesundheitsschädlicher Stoff
- Umweltgefährlicher Stoff
- Arzneistoff
- Natürliches Polyphenol
- Sekundärer Pflanzenstoff
- Nachweisreagenz
Wikimedia Foundation.