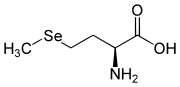
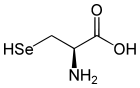
- Selenarmut
-
Klassifikation nach ICD-10 E59 Alimentärer Selenmangel E64.8 Folgen sonstiger alimentärer Mangelzustände ICD-10 online (WHO-Version 2006) Bei Selenmangel steht dem Körper das essentielle Spurenelement Selen nicht in ausreichender Menge zur Verfügung.
Gefährdet für das Auftreten eines relevanten Selenmangels sind insbesondere Personen, die in Gegenden mit ausgeprägter Selenarmut der Böden leben, aber auch Veganer und Menschen, die über längere Zeit künstlich ernährt werden müssen.
Selenmangel bewirkt eine verminderte Funktion selenabhängiger Enzyme, die in nahezu allen Organen vorkommen, kann also Störungen verschiedenster Organsysteme verursachen. Selenabhängig sind zum Beispiel die Enzyme aus der Gruppe der Glutathionperoxidasen, die eine wichtige Rolle in der Bewältigung von oxidativem Stress spielen, und bestimmte Dejodasen (jodentfernende Enzyme), die wichtig für die Wirkung der Schilddrüsenhormone an den Körperzellen sind.
Die Bedeutung des Selens für die Stoffwechselprozesse des Menschen wurde erst in der zweiten Hälfte des 20. Jahrhunderts erkannt, zunächst nur ansatzweise. Die erste Erkrankung, für die zweifelsfrei belegt wurde, dass sie durch Selenmangel verursacht wird, war die Keshan-Krankheit. Das ist eine Erkrankung des Herzmuskels, bei der allerdings zusätzlich auch das Vorhandensein bestimmter Viren eine wichtige Rolle spielt. Die Keshan-Krankheit kann durch Gaben von Selen sowohl behandelt als auch verhindert werden. Auch andere eindeutig durch Selenmangel bedingte Erkrankungen lassen sich durch Gaben von Selen mildern.
Die wissenschaftlichen Ergebnisse zu den Auswirkungen des Selenmangels auf viele Organsysteme sind zum Teil noch widersprüchlich. Einige Erkrankungen, für die (bisher) nicht Selenmangel als Ursache identifiziert wurde, sprechen trotzdem auf Selengaben an. Einheitliche Empfehlungen zur Substitution von Selen zur Behandlung dieser Erkrankungen existieren aber nicht. Die Angaben darüber, welche Mengen von Selen gesunde Individuen täglich aufnehmen sollten, sind ebenfalls uneinheitlich.
Das Gegenteil von Selenmangel – eine Überversorgung mit Selen – wird als Selenose bezeichnet.
Inhaltsverzeichnis
Grundlagen
Selen gelangt in die Nahrungskette, indem es in anorganischer Form von Pflanzen aus dem Boden aufgenommen und organisch gebunden wird. Der Selengehalt der Pflanzen hängt dabei nicht nur von dessen Konzentration im Boden ab (selenarm sind saure Böden oder solche vulkanischen Ursprungs), sondern wird auch durch das gleichzeitige Vorhandensein anderer Elemente (beispielsweise Schwefel, Aluminium und Eisen) negativ beeinflusst.[1]
Selenhaushalt des Menschen
Selen findet sich in allen Geweben des menschlichen Körpers. Sein Gesamtgehalt an Selen beträgt etwa 10 bis 20 mg. Davon finden sich etwa 60 % in Nieren, Leber und Muskulatur sowie weitere etwa 30 % im Skelettsystem.[2] Die optimale Menge an Selen zur Versorgung des menschlichen Körpers mit diesem essentiellen Spurenelement ist bis heute nicht bekannt.[3]
- Aufnahme und Bedarf
Die Aufnahme von Selen über den Magen-Darm-Trakt ist abhängig von seiner chemischen Wertigkeit in der Verbindung, in der es zugeführt wird, nicht vom Versorgungszustand des Körpers. Die Aufnahmerate liegt zwischen 50 und 100 %. Sie ist besonders hoch bei Natrium-Selenit (Na2SeO3) und etwas schlechter bei Selenomethionin (C4H9NO2Se) sowie Selenocystein (C3H7NO2Se).[4][5] Als tägliche Zufuhr für Erwachsene werden von den Gesellschaften für Ernährung in Deutschland (DGE), der Schweiz (SGE/SVE) und Österreich (ÖGE) 30 bis 70 µg (bis maximal 300 µg) empfohlen.[6][5][7] In den USA werden 55 µg für Frauen und 70 µg für Männer empfohlen[8] und bei Kindern gewichts- und altersabhängig zwischen und 5 und 60 µg täglich.[9][7] Bei den Empfehlungen handelt es sich um Schätzwerte, die aufgrund der Aktivität eines Enzyms, das zwingend Selen benötigt (Glutathionperoxidase s. u.), erstellt wurden.[4] Die Aktivität der Glutathionperoxidase im Blutserum (GPX 3) erreicht ihren Maximalwert, wenn die tägliche Zufuhr bei 1 µg pro Kilogramm Körpergewicht liegt, die optimale Konzentration des Transportproteins Selenoprotein P wird im Blutserum erst bei einer weit höheren Zufuhr erreicht.[3] Gesichert sind das Auftreten von Mangelerscheinungen bei einer langfristigen Aufnahme von unter 10 µg und von Vergiftungszeichen bei über 400–800 µg täglich.[9][2][4]
Selenreiche Lebensmittel sind Meeresfrüchte[8], Fleisch, Innereien (Niere 1200 µg/100 g, Leber 800 µg/100 g), Fisch, Käse (60 µg/100 g), Milch (10 µg/1000 g), Eier (40 µg/100 g), Getreideprodukte (40 µg/100 g) und Hülsenfrüchte.[10][8][11] Regionen mit besonders niedrigem Gehalt von Selen im Boden sind Teile von Skandinavien, China und Neuseeland.[8]
Die Einschätzung der Versorgungssituation in Deutschland wird in der Literatur nicht einheitlich dargestellt, sie reicht von „Mangelgebiet“ bis „gesichert“.[4][12][13] Es gibt Hinweise, dass in Deutschland etwa 70 % der Bevölkerung zu wenig Selen aufnehmen (im Median 40 µg).[14] Die Aufnahme in den USA liegt bei 60 bis 200 µg täglich.[9]
- Transport
Im Blut wird Selen an Plasmaproteine gebunden transportiert. Auf diesem Weg gelangt es in alle Gewebe (einschließlich Haare und Knochen).[15][2] Dabei sind über 60 % des Selens an das größtenteils von der Leber produzierte Serumglykoprotein Selenoprotein P gebunden (bei guter Versorgungssituation bis zu 10 Atome pro Molekül).[2][3]
- Speicherung
Selen wird als Selenomethionin im Körper gespeichert und daraus bei Bedarf mobilisiert. Selenocystein hingegen ist die biologisch aktive Form. Ungebunden kommt Selen im Körper nicht vor.[4] Das Transportprotein Selenoprotein P scheint ebenfalls für die Speicherung eine nennenswerte Bedeutung zu haben.[3]
- Ausscheidung
Die Ausscheidung von Selen ist abhängig vom Selenstatus des Körpers, sie erfolgt vermehrt bei Überversorgung. Selen wird in erster Linie über den Urin, aber auch über den Stuhl ausgeschieden. Insbesondere bei vermehrter Aufnahme wird es zusätzlich als Dimethylselenid (C2H6Se) abgeatmet, wobei ein knoblauchähnlicher Geruch entsteht.[2][4][5]
Physiologie
In Eiweiße wird Selen vom menschlichen Körper ausschließlich als Selenocystein eingebaut. Diese Eiweiße werden dann als Selenoproteine bezeichnet. Selenocystein liegt unter gesunden Bedingungen im Körper in ionisierter Form und damit als effektiver Redox-Katalysator vor (wesentlich wirkungsvoller als Cystein, das Schwefel anstatt Selen enthält). Im Rahmen der Proteinfaltung gelangt es ins aktive Zentrum des jeweiligen Selenoproteins. Das Erbgut des Menschen enthält 25 Gene, die die Erbinformation für etwa 30 bis 50 Selenoproteine umfassen (fachsprachlich als "dafür kodieren" bezeichnet). In manchen Fällen kodieren mehrere Gene für ein Protein. Die Funktion von 15 dieser Proteine ist zumindest teilweise bekannt. Systematisch gesehen werden die Selenoproteine beim Menschen in 17 unterschiedliche Gruppen eingeteilt. Das sind neben den Glutathionperoxidasen (dafür kodieren 5 Gene) die Thioredoxin-Reduktasen (3 Gene), die Dejodasen (3 Gene) und die Selenophosphat-Synthetasen. Die übrigen Proteine werden alphabetisch als Selenoprotein 15, SelH, SelI, SelK, SelM, SelN, SelO, SelP, SelR, SelS, SelT, SelV und SelW bezeichnet.[5][3][1]
Die Bildung der Selenoproteine ist ein komplexer intrazellulärer Prozess, der sich grundlegend von der Biosynthese anderer Proteine unterscheidet. Unter Verbrauch von Guanosintriphosphat dient dabei das Stopcodon U-G-A[16] der Messenger-RNA (mRNA) als Signal für den Einbau von Selen. Für diesen Vorgang werden das SE-CIS-Binding Protein 2 (SBP2), ein selenspezifischer Elongationsfaktor (EFsec) und eine mit Selenocystein beladene Transfer-RNA (tRNA) benötigt. Im Rahmen dieser Translation der mRNA gelangt dabei die Aminosäure Selenocystein in die im Anwachsen befindliche Peptidkette.[5][3]
- Glutathionperoxidasen
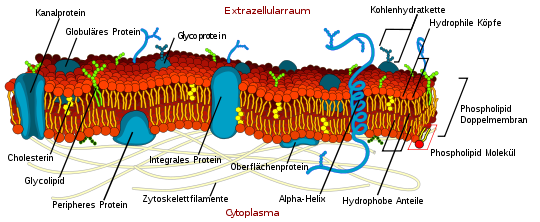 Schematische Darstellung einer Zellmembran, die großteils aus einer Doppellipidschicht besteht.
Schematische Darstellung einer Zellmembran, die großteils aus einer Doppellipidschicht besteht.Glutathionperoxidasen (GPX 1–7) tragen zur Verminderung oxidativer Zell- und Gewebeschäden bei,[2][5] indem sie ungesättigte Lipide der Zellmembran entgiften.[17] Von den 7 beim Menschen bekannten Formen sind 5 selenabhängig (GPX 1–4 und 6).[1]
Die insbesondere aus dem Stoffwechsel der Erythrozyten bekannte GPX 1 ist im Zytosol weitgehend aller Körperzellen nachweisbar. Weitere selenabhängige Glutathionperoxidasen finden sich beispielsweise in Zellen des Magen-Darmtrakts (GPX 2), dem Blutplasma (GPX 3), an Membranoberflächen unterschiedlicher Zellen, sowie im Kern von Spermien (GPX 4) und in den Riechzellen (GPX 6) .[2][1]
Die grundsätzliche Funktion der Glutathionperoxidasen besteht darin, dass sie Wasserstoffperoxid (H2O2) zu Wasser (H2O) reduzieren. Dabei oxidieren sie Glutathion.
Im Körpergewebe vorhandene Peroxide setzen OH--Radikale frei, die zu Schädigungen von Zellen und Geweben führen. Diese Reaktion spielt eine bedeutsame Rolle bei Zellalterung und der Leberschädigung (durch Alkohol und Tetrachlorkohlenwasserstoff). Bei der Reduktion der Peroxide durch Glutathionperoxidasen handelt es sich folglich um einen antioxidativen Schutzmechanismus. Er ist außerdem notwendig um die Integrität der roten Blutkörperchen aufrecht zu erhalten, indem er deren Membranlipide vor Peroxidation schützt.[9][2][15]
- Dejodasen
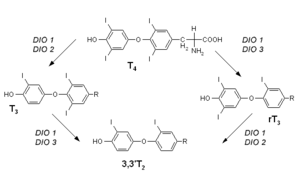 Funktion der Dejodasen
Funktion der Dejodasen
T4 – Thyroxin, T3 – Trijodthyronin, rT3 – reverses Trijodthyronin, 3,3'T2 - Dijodtyrosin, DIO 1–3 – Dejodase 1–3Bei den Dejodasen handelt es sich um selenabhängige Enzyme, die für den Stoffwechsel der Schilddrüsenhormone bedeutsam sind. Derzeit sind drei unterschiedliche Formen bekannt (DIO 1–3). Ihre Aufgabe ist die Dejodierung (Entfernung von Jodatomen) der Schilddrüsenhormone, wodurch diese aktiviert (Thyroxin zu Trijodthyronin) oder deaktiviert (Trijodthyronin zu Dijodtyrosin) werden. Die (Typ 1-)Thyroxin-5'-Dejodase kommt vornehmlich in Leber, Nieren und Muskulatur vor. Die anderen Dejodasen finden sich beispielsweise im ZNS und fetalem Gewebe. Der Steuerungsmechanismus, der der Bildung der Dejodasen zugrunde liegt und an dem auch Trijodthyronin und TSH beteiligt sind, ist bislang noch weitgehend unverstanden. Bei Selenmangel werden diese Enzyme in manchen Geweben (beispielsweise ZNS) bevorzugt gebildet.[2][4][1]
- Thioredoxin-Reduktasen
Thioredoxin-Reduktasen sind Eiweißstoffe, die im Zellstoffwechsel eine wichtige Rolle spielen. Dabei wirken sie als Katalysatoren bei Thiol-Disulfid-Austauschreaktionen und sind bei der Proteinfaltung (Disulfidbrückenbildung) sowie für das Enzym Ribonukleotidreduktase, das für die Zellteilung benötigt wird, von Bedeutung.[5] Sie kommen sowohl im Zytosol, als auch im Zellkern vor, neutralisieren reaktive Sauerstoffspezies, regulieren redox-sensitive Vorgänge und aktivieren Transkriptionsfaktoren.[18]
Ursachen eines Selenmangels
Selenarme Lebensmittel oder extrem einseitige Ernährung, aber auch Malabsorption und Medikamente können für einen Selenmangel ursächlich sein. Gefährdet sind daher nicht nur Personen, die in selenarmen Gegenden leben, sondern auch Veganer und Patienten, die einer künstlichen Ernährung bedürfen.[9][2][4][19] Die Selenversorgung von Vegetariern gilt dagegen als gesichert und liegt etwa auf dem gleichen Niveau wie bei Personen, die sich mit Mischkost ernähren.[20]
Pathophysiologie
Selenabhängige Enzyme werden bei Selenmangel in geringeren Mengen gebildet.
Auch kann es im Rahmen genetischer Defekte zu Störungen selenabhängiger Enzyme kommen. In diesen Fällen ist dann auch bei ausreichender Zufuhr des essentiellen Spurenelementes die Aktivität der betroffenen Enzyme messbar verringert. Derartige genetische Defekte „simulieren“ also einen Selenmangel. Dies wird im Rahmen der klinischen Grundlagenforschung dazu genutzt, die Bedeutung von Selen für das Auftreten krankhafter Veränderungen besser zu verstehen.
Es gibt Hinweise, dass bei Selenmangel Gehirn, endokrine Drüsen und Keimdrüsen bevorzugt versorgt werden. Zudem scheint der Körper in Phasen des Mangels Selen aus Glutathionperoxidase 1 (GPX 1) und Dejodase 1 (Thyroxin-5'-Dejodase) umzuverteilen.[2] Im Rahmen von Entzündungen oder Infektionskrankheiten kommt es zu einer Umverteilung von Selen aus dem Blut in andere Bereiche des Körpers (beispielsweise Muskulatur). Ursache, Bedeutung und Auswirkungen diese Phänomens sind bislang noch unklar.[3]
Die Glutathionperoxidasen scheinen typspezifisch in unterschiedlicher Weise für die Verhinderung von Erkrankungen verantwortlich zu sein. So konnte in Tierversuchen beispielsweise gezeigt werden, dass GPX 1 Bedeutung für die Abwehr von Virusinfekten und die Verhinderung der Entstehung von bösartigen Tumoren hat, Mangel an GPX 2 insbesondere im Magen-Darmtrakt zu vermehrten bakteriellen Infektionen und bösartigen Veränderung führt sowie Minderwuchs auslöst und GPX 4 eine wesentliche Rolle bei der Spermabildung spielt. Veränderungen bei den Dejodasen beeinflussen den Stoffwechsel der Schilddrüsenhormone und damit auch die Regulation der Körpertemperatur, das Wachstum, das Hörvermögen und besonders auch die Entwicklung des Gehirns beim Ungeborenen.[1]
Klinisches Bild
Durch Selenmangel können verschiedene Organsysteme in unterschiedlicher Weise betroffen sein. Den Erkrankungen liegen letztlich die verminderten Funktionen der unterschiedlichen selenabhängigen Enzyme und deren Auswirkungen zugrunde. Der oft diskutierte Einfluss selenabhängiger Enzyme auf die Entstehung bösartiger Tumoren ist von zahlreichen weiteren Faktoren abhängig und bislang noch nicht vollständig aufgeklärt.[1]
Typische Befunde sind Veränderungen der Nägel, schuppige Haut, Blutarmut, verminderte Qualität des Spermas, Leberschädigungen, Wachstums- und Knochenbildungsstörungen, sowie schmerzhafte Funktionsstörungen und strukturelle Erkrankungen der Muskulatur (Myopathie). Durch letztere ist in manchen Fällen die Gehfähigkeit betroffener Patienten beeinträchtigt. Ist die Herzmuskulatur betroffen (Kardiomyopathie oder degenerative Herzmuskelveränderungen), können Herzrhythmusstörungen und Herzschwäche auftreten. Bei Kindern und Jugendlichen drohen bei chronischem Selenmangel zudem Erkrankungen von Knochen, Knorpel und Gelenken, sowie Zwergwuchs (Kashin-Beck-Krankheit).[2][4][13] Eine latente Unterversorgung kann nicht anhand klinischer Zeichen diagnostiziert werden.[3]
Bei Säugetieren kann Selenmangel sowohl zu Lebernekrosen, als auch zu gehäuftem Auftreten von Leberkrebs führen. Ferner kann er die Reifung der Samenzellen beeinträchtigen und damit Unfruchtbarkeit hervorrufen. Zudem wird der Mangel an Glutathionperoxidasen in der Augenlinse für das vermehrte Auftreten eines grauen Stars verantwortlich gemacht.[21]
Herz- und Skelettmuskulatur
Der Entstehungsmechanismus von Schädigungen der Muskulatur (Skelettmuskulatur und Herzmuskulatur) bei Selenmangel ist bislang noch unklar,[5] die Muskulatur weist (bei Mensch und Tier) eine charakteristische Blässe auf.[22] Im Tierversuch zeigten sich bei weitgehend selenfreier Fütterung und ausreichender Gabe aller anderen essentiellen Nahrungsbestandteile deutliche Anstiege der Enzymaktivitäten von GOT und CK als Zeichen für Muskelschädigungen.[23] Entsprechende Aktivitätsanstiege sind auch beim Menschen nachweisbar.[24]
Beim Menschen mit Störungen der Skelettmuskulatur bei Selenmangel durch Malabsorption oder künstlicher Ernährung konnte durch alleinige Gabe von Selen eine Besserung erzielt werden. Da umgekehrt aber nicht alle Patienten mit diesen Formen ernährungsbedingten Selenmangels unter Störungen der Muskulatur leiden, ist davon auszugehen, dass grundsätzlich auch andere Faktoren (z. B. virale Infekte) zusätzlich beteiligt sind.[24] Muskelerkrankungen, bei denen Selenmangel als eine (Mit-)Ursache gilt, sind in der Veterinärmedizin bei Wiederkäuern, Schweinen und Truthähnen bekannt. Sie werden als Weißmuskelkrankheit, nutritive Muskeldystrophie, oder enzootische Muskeldystrophie bezeichnet.[25][26][27]
Als Ursache für die Muskelschädigungen wird eine Verminderung des selenabhängigen Selenoprotein N diskutiert.[28] Mutationen des für das Selenoprotein N kodierenden Gens SEPN1 sind in Zusammenhang mit einer Reihe seltener angeborener, meist autosomal-rezessiv vererbter Muskelerkrankungen, die zum Teil auch mit einer Kardiomyopathie einhergehen, beschrieben worden. Dazu zählen die Multicore-Myopathie[29], die Rigid-Spine-Muskeldystrophie Typ1 (RSMD1)[30]und die Desmin-related myopathy with Mallory body-like inclusions.[31]
Das Selenoprotein N findet sich im endoplasmatisches Retikulum, seine Funktion ist unbekannt. Auch durch Selenmangel mitausgelöste Erkrankungen des Nervensystems können ursächlich für muskuläre Störungen sein.[3][32] In der Muskulatur findet sich auch Selenoprotein P, von dem ebenfalls angenommen wird, dass es (mit-)verantwortlich für bei Selenmangel auftretende Muskelerkrankungen sein kann.[2]
- Keshan-Krankheit
Die klassische, durch Selenmangel ausgelöste Erkrankung des Herzens wird als Keshan-Krankheit bezeichnet. Sie tritt bei einer Aufnahme von unter 10 µg täglich (Selenspiegel im Blutserum <20 μg/l) auf[9][2][33][4] und äußert sich typischerweise als durch eine dilatative Kardiomyopathie verursachte Herzschwäche.[17] Ursächlich für die dabei auftretenden Herzrhythmusstörungen und die Herzschwäche ist, dass Teile der Herzmuskulatur absterben.[2][4][13] Die feingeweblichen Veränderungen des Herzens ähneln denen der Friedreich's Kardiomyopathie.[34][35]
 Geographische Lage des Kreises Keshan in der chinesischen Provinz Heilongjiang
Geographische Lage des Kreises Keshan in der chinesischen Provinz HeilongjiangDiese Erkrankung wurde vor allem bei Kindern und jungen Frauen beobachtet, die in Gegenden Chinas leben, in denen die Aufnahme von Selen aus der Nahrung besonders niedrig ist. Der Name leitet sich von dem selenarmen Kreisgebiet Keshan in der chinesischen Provinz Heilongjiang ab.[8][4]
Als ursächlich werden Schäden an den Zellmembranen infolge verminderter Aktivität der antioxidativen, selenhaltigen Enzyme angenommen[36]. Insbesondere aus Tierversuchen gibt es jedoch Hinweise, dass eine Verbindung zwischen Selenmangel, Coxsackie-Virus-Infektion, Herzmuskelentzündung und Entwicklung einer dilatativen Kardiomyopathie (Charakteristikum der Keshan-Krankheit) besteht, wofür der durch Selenmangel geschwächte Abwehrmechanismus ursächlich sein könnte.[37][28] Als weitere, aus Tierversuchen bekannte Ursache wird eine Funktionsminderung der Thioredoxin-Reduktase (TrxR2) angenommen.[34]
Die Substitution von Selen verhindert das Fortschreiten der Erkrankungen, macht bereits bestehende Veränderungen jedoch nicht rückläufig.[38] Durch Ergänzen der Nahrung der in dem entsprechenden Gebiet lebenden Personen mit Selen konnte die Keshan-Krankheit weitgehend ausgerottet werden.[28]
In einer Kasuistik beschrieben 2002 Burke e.a. bei einer Frau das Erstauftreten einer Kardiomyopathie im mittleren Lebensalter. Bei ihr war ein langfristiger Selenmangel dokumentiert. Die Untersuchung des Herzens nach ihrem Tod zeigte Veränderungen, wie sie für die Keshan-Krankheit typisch sind.[36]
- Koronare Herzkrankheit
Eine typischerweise bei Selenmangel auftretende Verminderung der Glutathionperoxidasenaktivität im Serum (GPX 3) gilt als Risikofaktor für kardiovaskuläre Erkrankungen.[3] Niedrige Selenwerte im Blut stehen mit einer erhöhten Häufigkeit der Koronaren Herzkrankheit in statistischer Beziehung; die Daten dazu sind nicht einheitlich, sodass zum gegenwärtigen Zeitpunkt Vorbeugemaßnahmen mittels selenhaltiger Medikamente nicht empfohlen werden.[39][8]
Schilddrüse
In der Schilddrüse findet sich besonders viel Selen. Es hat in Bezug auf die Schilddrüse, ihre Funktionsstörungen und Erkrankungen mehrfache Bedeutung. Das gemeinsame Auftreten eines Selenmangels mit Jodmangel kann die Ausprägung des myxödematösen Kretinismus verstärken.[8][40]
- Dejodasen
Dejodasen sind selenabhängige Enzyme, deren klinisch auffälligste Funktion die Umwandlung des Schilddrüsenhormons Thyroxin (T4) in das zehnfach stärker wirksame Trijodthyronin (T3) ist. Daher trägt ein Selenmangel zu einer verminderten Bildung von T3 und damit zur Entstehung einer Hypothyreose bei.[14][9][2]
Die medizinische Grundlagenforschung zeigte, dass eine Genmutation, bei der das selenabhängige SE-CIS-Binding Protein 2 (SBP2 - zuständig für die Translation von Selenoproteinen) in Menge oder Funktionalität vermindert ist, ebenfalls eine derartige Verminderung der Dejodasen hervorrufen kann.[3]
- Autoantikörper
Die Gabe von Selen hemmt die Bildung von Autoantikörpern gegen die Thyreoperoxidase.[5] Es gibt Hinweise auf ein gehäuftes Auftreten von Jodmangelstruma und Morbus Hashimoto (Autoimmunerkrankung der Schilddrüse) bei Selenmangel.[3]
- Oxidativer Stress
Im Rahmen der Produktion von Schilddrüsenhormonen in den Follikelepithelzellen entstehen dort in großer Menge Sauerstoffradikale und Peroxide (oxidativer Stress), die unter normalen Bedingungen von selenhaltigen Peroxidasen abgefangen werden. Bei Selenmangel sind die Konzentrationen dieser Enzyme vermindert, es kommt zu Schädigungen der Zellen und die Häufigkeit papillärer Schilddrüsenkarzinome steigt.[12] Bei Kindern kann es in solchen Fällen zur Atrophie die Schilddrüse kommen (atrophische Thyreoiditis).[40] Es wird zudem diskutiert, ob zusätzlicher Selenmangel die gesteigerte Radikalbelastung unter Jodmangel und damit die Entstehung einer Schilddrüsenautonomie begünstigt.[41]
Andere Organsysteme und Körperfunktionen
- Wachstum
Neben dem bereits oben beschriebenen Einfluss auf die Schilddrüsenhormone kommt es durch Selenmangel auch zum Auftreten einer Schwäche der Muskulatur. Im Tierversuch führte dieser Mangel zu Minderwuchs und verminderter Nahrungsaufnahme.[23]
Selenmangel gilt als eine wichtige Ursache für die Erkrankungen von Knochen, Knorpel und Gelenken (fachsprachlich als Osteoarthropathie oder Osteochondropathie bezeichnet), die in diesen Fällen gehäuft zusammen mit Zwergenwuchs vorkommen. Dieses Krankheitsbild wird als Kashin-Beck-Krankheit bezeichnet und imponiert insbesondere auch durch deformierte Gelenke der Extremitäten. Als mitverantwortlich werden bei dieser Erkrankung jedoch auch eine genetische Veranlagung oder eine Virusinfektion (Coxsackie-Virus) diskutiert.[2][4][13]
- Nervensystem
Es gibt Hinweise, dass neben einer Reihe von Muskel- auch Nervenerkrankungen mit Selenmangel einhergehen können.[3] Im Tierversuch zeigte sich, dass dieser Mangel nicht direkt zu Schädigungen führt, aber insbesondere das Gehirn sensibler gegenüber Nervengiften werden lässt und häufiger Störungen der Durchblutung auftreten. Verantwortlich dafür wird die unter Selenmangel reduzierte Aktivität der Glutathionperoxidase-1 (GPX 1) gemacht.[32] Störungen der Dejodasen beeinflussen den Stoffwechsel der Schilddrüsenhormone und damit auch die Entwicklung des Gehirns bereits in der Embryonalphase.[1]
- Reproduktion
Selenabhängige Enzyme haben eine wesentliche Bedeutung bei der Reifung von Samenzellen.[21] Darüber hinaus gibt es Hinweise, dass bei Selenmangel die Beweglichkeit der Spermien beeinträchtigt ist.[42]
Eine genetisch bedingte Beeinträchtigung des selenabhängigen Enzyms Glutathionperoxidase-4 (GPX 4) führt zu einer Verminderung der männlichen Fertilität und einer verminderten Qualität des Spermas.[3]
- Immunsystem
Selen besitzt eine immunmodulierende Wirkung[5] und es gibt Hinweise, dass Selenmangel das Immunsystem beeinträchtigt.[3] Eine zusätzliche tägliche Zufuhr von 100 µg Selen führte im Rahmen einer experimentellen Virusinfektion zu einem Anstieg der Zytokinine und zu einer Vermehrung von T-Zellen.[43]
Aus Tierversuchen gibt es Hinweise, dass durch Selenmangel die zelluläre Immunantwort (beispielsweise gegen Cryptosporidium parvum) geschwächt wird[44] und bestimmte Viren, wohl aufgrund dieser Abwehrschwäche, an Virulenz zunehmen. Dieser Umstand kann (mit-)ursächlich für Erkrankungen (beispielsweise des Herzens) sein.[37]
Epidemiologische Studien fanden einen Zusammenhang von Selenmangel und vermehrtem Auftreten von Prostata-, Dickdarm-, Brust-, Eierstock- und Lungenkrebs. Bei Tieren, nicht jedoch beim Menschen konnte die Häufigkeit des Auftretens von Krebserkrankungen durch eine Selenanreicherung der Nahrung reduziert werden.[2] Als mögliche Ursachen werden ein Minderung der antioxidativen Wirkung der Glutathionperoxidasen, eine mangelhafte Verarbeitung von Prokarzinogenen und eine Veränderung der DNS-Reparaturmechanismen diskutiert.[2]
- Leber
Selenmangel begünstigt die Entstehung einer Nekrose der Leber.[15] Im Tierversuch konnte bei Selenmangel hier als mögliche Ursache eine Verminderung der Glutathionperoxidaseaktivität nachgewiesen werden.[23] Bereits in den 1950er Jahren war in Tierversuchen festgestellt worden, dass die Gabe von Selen (damals „Faktor 3“ genannt) das Absterben von Leberzellen unter entsprechender Ernährung verhindern kann.[45] Einen weiteren Hinweis auf die schützende Wirkung von Selen liefert die Verminderung der Häufigkeit des Auftretens einer bestimmten Form von Leberkrebs in extremen Selenmangelgebieten Chinas. Ursächlich für die Entstehung dieses Krebses werden dabei Hepatitis B, die in diesen Regionen sehr verbreitet ist, und der gleichzeitig hohe Aflatoxingehalt der Nahrung gesehen.[1]
- Blut
Selenmangel kann als eigenständiger Risikofaktor für das Auftreten einer Blutarmut bei Mensch und Tier angesehen werden. Als mögliche Ursache wird die Verminderung der Glutathionperoxidase (GPX 1) in den roten Blutkörperchen betrachtet, weil es Hinweise gibt, dass die Gabe von Selen diese Blutzellen vor Zerstörung durch oxidativen Stress schützt.[33] Als weitere, aus Tierversuchen bekannte mögliche Ursache wird eine Funktionsminderung der ebenfalls selenabhängigen Thioredoxin-Reduktase (TrxR2) angenommen, die die Blutbildung beeinträchtigt.[34]
Untersuchungsmethoden
Geeignet, relevante Hinweise auf den Selengehalt des Körpers zu erfassen, ist der Blutselenwert (Selengehalt im Blutplasma oder auf den roten Blutfarbstoff der Erythrozyten bezogen). Einen zuverlässigen Anhaltswert für die aktuelle Versorgungssituation gibt die Bestimmung von Selenoprotein P im Blut,[3] für die längerfristige Versorgungslage des Organismus der Gehalt in Nägeln und Haaren.[1]
Selenabhängige Enzyme werden bei Selenmangel in geringeren Mengen gebildet. Dies ist an deren messbar verminderter Enzymaktivität erkennbar, daher ist als indirekter Nachweis auch die Aktivität der Glutathionperoxidase in Blutplasma oder Erythrozyten geeignet.[3]
Der Blutselenwert liegt in Deutschland bei etwa 60–80 µg/l und in den USA bei 100–180 µg/l. Bei Werten unter 50 µg/l lassen sich Einschränkungen von Enzymfunktionen (Glutathionperoxidasen) nachweisen. Um diesen Mindestspiegel zu erhalten bedarf es einer Aufnahme von 0,67 µg pro Kilogramm Körpergewicht. Um den optimalen Wert der Glutathionperoxidaseaktivität im Serum (GPX 3) zu erreichen, braucht es jedoch eine Zufuhr von etwa 1 µg pro Kilogramm Körpergewicht. Bei der Interpretation ist zu beachten, dass die Aktivität der Glutathionperoxidase im Plasma (GPX 3) von der Nierenfunktion und dem Selengehalt der Tubuluszellen der Nieren abhängt. Sie erreicht bereits bei kurzfristig guter Selenversorgung rasch einen Normalwert. Entsprechende Parameter aus den roten Blutkörperchen (Lebensdauer etwa drei Monate) zeigen die durchschnittliche Versorgungssituation während der etwa 90 Tage vor der Untersuchung auf.[9][2][4][3]
Therapie
Für die Behandlung von selenmangelbedingten Erkrankungen sind einerseits ursachenbezogen die Verabreichung von ausreichend Selen notwendig, andererseits können aber auch symptombezogene Maßnahmen angezeigt sein, wenn es um die Behandlung von Folgezuständen geht.
Vorbeugung
Das Ziel vorbeugender Maßnahmen ist es, die tägliche Aufnahme von ausreichend Selen aus der Nahrung zu gewährleisten. In Selenmangelgebieten ist dazu auch die Anreicherung von Düngemitteln geeignet. So wurde beispielsweise in Finnland, dessen Böden und Trinkwasser nur wenig Selen enthalten, dem Kunstdünger Natriumselenat beigemischt, wodurch eine verbesserte Versorgung der Bevölkerung mit diesem essentiellen Spurenelement erreicht werden konnte.[9] Der Gehalt an Selen in der Milch ist direkt abhängig von seinem Anteil im verwendeten Tierfutter. Diesen Zusammenhang nutzte man ebenfalls in Finnland und auch in Schweden, um die Versorgung der Bevölkerung zu verbessern.[11]
Substitution von Selen
Die bislang einzig gesicherten Indikationen für die Anwendung von selenhaltigen Präparaten sind ein nachweislicher Selenmangel und die Hauterkrankung „seborrhoische Dermatitis“ zur lokalen Anwendung.[2][40] Die Anwendung bei Autoimmunthyreoiditis und zur Vorbeugung von Krebs sind umstritten (s. u.). Die tägliche Gabe von 200 µg Selen wird bei HIV-Infektion als einfache und kostengünstige unterstützende Behandlung empfohlen, da positive Auswirkungen auf Viruslast und CD4-Zellen nachgewiesen werden konnten.[46] Eine Überdosierung selenhaltiger Nahrungs- oder Arzneimittel kann zur Selenose führen.
- Krebs
Die Einnahme von Nahrungsergänzungsmitteln, die Selen enthalten, verringert in einigen Patientengruppen das Auftreten von Prostatakrebs, Lungenkrebs und Darmkrebs. Die Aufnahme hat aber keinen Einfluss auf die Inzidenz von Hautkrebs.[47] Präkanzerosen im Oropharynx sprechen auf Selen an.[48] Eine allgemeine Empfehlung der Selensupplementierung zur Vorbeugung von Krebserkrankungen kann nicht gegeben werden.[49]
- Autoimmunthyreoiditis
Es konnte gezeigt werden, dass bei der überwiegenden Mehrzahl der Patienten mit Hashimoto-Thyreoiditis, einer Autoimmunerkrankung der Schilddrüse, eine tägliche Zufuhr von 200 µg Selen zu einem deutlichen Absinken der Thyreoperoxidase-Antikörper (TPO-Ak) und einer Normalisierung des sonographischen Echomusters führt. Für Patienten mit Hashimoto-Thyreoiditis werden daher teilweise höhere tägliche Selenaufnahmen empfohlen (Kinder 50 µg, Jugendliche 150 µg, Erwachsene 200 µg),[40][14] andere Quellen halten die Studienlage dagegen für nicht ausreichend, um eine Gabe von Selen zu empfehlen.[49] Bei Schwangeren, die positiv für TPO-Ak waren, konnte durch Gaben von Selen die Rate an Postpartum-Thyreoiditis und Hypothyreose deutlich gesenkt werden.[50] Bei der Behandlung eines Kretinismus infolge kombinierten Jod- und Selenmangels ist zu beachten, dass Selen erst supplementiert werden darf, wenn der Jodspiegel wieder normalisiert ist. Ansonsten würde die dadurch bewirkte Zunahme der Dejodasenaktivität zu einen weiteren Verlust von Jod aus der geschädigten Schilddrüse führen.[1]
Geschichtliche Aspekte
Die Entdeckung von Selen als chemisches Element geht auf Jöns Jakob Berzelius im Jahre 1817 zurück. Klaus Schwarz und Calvin M. Foltz fanden 1957 heraus, dass Selen ein essentielles Spurenelement ist.[51] Sie hatten seine Schutzfunktion vor einer bestimmten Art von Lebererkrankung (Lebernekrose) aufgezeigt. Die ersten selenhaltigen Proteine wurden 1973 in Einzellern entdeckt und als Glutathionperoxidasen klassifiziert. 1990 gelang der Nachweis, dass die für die Funktion der Schilddrüsenhormone bedeutsamste Dejodase (Typ 1) von Selen abhängt. Bis zum Jahre 2006 konnten drei Gene für entsprechende Isoenzyme beschrieben werden.[11][3]
1935 wurde die Keshan-Krankheit erstmals beschrieben. 1964 fiel ihr gehäuftes gemeinsames Auftreten mit einer Muskelerkrankung bei Tieren (Weißmuskelkrankheit) auf. 1965 behandelte ein Landarzt aus der Shanxi-Provinz, dessen Name in Vergessenheit geraten ist, die Herzerkrankung erstmals erfolgreich bei Menschen durch die Gabe von Natriumselenit. Kurz darauf bestätigte die „Chinesische Akademie der Medizinischen Wissenschaften“ den Zusammenhang zwischen Selenmangel und Keshan-Krankheit. Von 1974 bis 1977 wurde eine prospektive Studie an Kindern in endemischen Bezirken der Sichuan Provinz durchgeführt, die die Verringerung der Häufigkeit des Auftretens und der Sterblichkeitsrate, sowie des klinischen Verlaufes dokumentierte.[52]
1979 veröffentlichte Andre M. van Rij in einer Kasuistik das Auftreten einer Muskeldystrophie bei einem selenarm künstlich ernährten Patienten, die unter Gabe von Selen eindeutig rückläufig war.[3][53]
Einzelnachweise
- ↑ a b c d e f g h i j k Laura Vanda Papp, Jun Lu, Arne Holmgren und Kum Kum Khanna: From Selenium to Selenoproteins: Synthesis, Identity, and Their Role in Human Health. In: Antioxidants & Redox Signaling. Comprehensive Invited Review. 9, Nr. 7, Mary Ann Liebert, Inc., New Rochelle, New York Juli 2007, ISSN 1523-0864, S. 775-806 (doi:10.1089/ars.2007.1528) (hier online ; Stand: 1. Mai 2009).
- ↑ a b c d e f g h i j k l m n o p q r s t u Biesalski H.-K., e.a.: Ernährungsmedizin: Nach dem Curriculum Ernährungsmedizin der Bundesärztekammer, Georg Thieme Verlag, 2004, S. 171ff, 207, 330, ISBN 313100293X, hier online
- ↑ a b c d e f g h i j k l m n o p q r s t J. Köhrle, L. Schomburg: Selen, Selenproteine, Selenmangel, Selenvergiftung. In: Olaf Adam, Peter Schauder, Günter Ollenschläger (Hrsg.): Ernährungsmedizin: Prävention und Therapie. 3 Auflage. Elsevier, Urban & Fischer, 2006, ISBN 9783437229213, III.6, S. 149-158 (hier online ; Stand: 1. Mai 2009).
- ↑ a b c d e f g h i j k l m n Leitzmann C., e.a.: Ernährung in Prävention und Therapie, Thieme Verlag, 2003, S. 75ff., ISBN 383045273X, hier online
- ↑ a b c d e f g h i j Petro E. Petrides: Spurenelemente. In: Georg Löffler, Petro E. Petrides, Peter C. Heinrich (Hrsg.): Biochemie und Pathobiochemie. 8 Auflage. Springer Verlag, Berlin 2006, ISBN 3540326804, 22, S. 676 (hier online ; Stand: 21. April 2009).
- ↑ Deutsche Gesellschaft für Ernährung (www.dge.de): D-A-CH-Referenzwerte für die Nährstoffzufuhr, 2008, hier online; zuletzt eingesehen am 9. März 2009
- ↑ a b German Nutrition Society (DGE): Reference Values for Nutrient Intake. Umschau/Braus, Frankfurt/Main, 2000, S. 177., ISBN 3-8295-7114-3, pdf
- ↑ a b c d e f g Robert M. Russell (für die deutsche Ausgabe: Hans-Joachim F. Zunft). Vitamine und Spurenelemente – Mangel und Überschuss. In: Manfred Dietel, Joachim Dudenhausen, Norbert Suttorp (Hrsg.) Harrisons Innere Medizin. Berlin 2003 ISBN 3-936072-10-8
- ↑ a b c d e f g h i Kasper H.: Ernährungsmedizin und Diätetik, Urban&FischerVerlag, 2004, S.67ff., ISBN 3437420119, hier online
- ↑ Cornelia A. Schlieper. Selen. In: Schlieper. Grundfragen der Ernährung. Verlag Dr. Felix Büchner 2000 ISBN 3-582-04475-0
- ↑ a b c Töpel A.: Chemie und Physik der Milch, Behr’s Verlag DE, 2004, S.341-3, ISBN 3899471318, hier online
- ↑ a b Burgis E.: Intensivkurs allgemeine und spezielle Pharmakologie, Urban&FischerVerlag, 2008, S. 443, ISBN 3437426133, hier online
- ↑ a b c d Meyer-Rankes K., e.a.: Leitfaden Ernährungsmedizin, Urban&FischerVerlag, 2006, S.68-70, ISBN 3437565303, hier online
- ↑ a b c Lothar-Andreas Hotze, Petra-Maria Schumm-Draeger. Schilddrüsenkrankheiten. Diagnose und Therapie. Berlin 2003 ISBN 3-88040-002-4
- ↑ a b c Petro E. Petrides: Spurenelemente. In: Georg Löffler, Petro E. Petrides (Hrsg.): Physiologische Chemie. 4 Auflage. Springer Verlag, Berlin 1988, ISBN 3-540-18163-6, 21, S. 589f.
- ↑ Die wundersame Aminosäure Selenocystein. In: Florian Horn et al. Biochemie des Menschen. Stuttgart 2005 ISBN 3-13-130883-4 S. 41
- ↑ a b Karlson P., e.a.: Karlsons Biochemie und Pathobiochemie, Thieme Verlag, 2005, S.605, ISBN 3133578154, hier online
- ↑ Paunescu K.: DNA-Stabilität und Thioredoxin/Thioredoxin Reduktase im Zellkern, www.opus-bayern.de/uni-wuerzburg/volltexte/2003/699/, 2003, pdf
- ↑ Vaddadi K. S., e.a.: Low blood selenium concentrations in schizophrenic patients on clozapine. In: Br J Clin Pharmacol. 2003 March; 55(3): 307–309, hier online
- ↑ Claus Leizmann. Vegetarismus. München 2007 ISBN 978-3-40644776-1 S. 76
- ↑ a b Wolfgang Kaim, Brigitte Schwederski: Bioanorganische Chemie. Zur Funktion chemischer Elemente in Lebensprozessen. 4 Auflage. Vieweg + Teubner Verlag, 2005, ISBN 3519335050, 16.8, S. 329-335 (hier online ; Stand: 21. April 2009).
- ↑ Leserbrief zu: White muscle disease in humans: myopathy caused by selenium deficiency in anorexia nervosa under long term total parenteral nutrition. In: J Neurol Neurosurg Psychiatry 1999;67:829-830, hier online
- ↑ a b c Julia Fischer, Astrid Bosse, Josef Pallauf: Effect of selenium deficiency on the antioxidative status and muscle damage in growing turkeys. In: Archives of Animal Nutrition. 62, Nr. 6, Taylor & Francis, Dezember 2008, ISSN 0003-942X, S. 485-497 (doi:10.1080/17450390802453468).
- ↑ a b Patrick Chariot, Olivier Bignani: Skeletal muscle disorders associated with selenium deficiency in humans. In: Muscle & Nerve. 27, Nr. 6, John WIley, New York 2003, ISSN 0148-639X, S. 662-688 (hier online ; Stand: 21. April 2009).
- ↑ Waldemar Hort: Dilatative Kardiomyopathie. In: Waldemar Hort (Hrsg.): Pathologie des Endokard, der Kranzarterien und des Myokard. 1 Auflage. Springer Verlag, Berlin 2000, ISBN 3540631216, 6.L.III.2. Selenmangel, S. 992 (hier online ; Stand: 21. April 2009).
- ↑ Klaus Bickhardt: Ernährungsbedingte Muskeldegeneration durch Vitamin-E- und Selenmangel. In: Karl-Heinz Waldmann, Michael Wendt (Hrsg.): Lehrbuch der Schweinekrankheiten. Parey Verlag, Stuttgart 2004, ISBN 3830441045, S. 255ff (hier online ; Stand: 20.4.2009).
- ↑ Klaus Bickhardt: Vitamin-E- und Selenmangel. In: Martin Ganter (Hrsg.): Lehrbuch der Schafkrankheiten. Weißmuskelkrankheit, Nutritive Muskeldystrophie, Enzootische Muskeldystrophie. 4 Auflage. Parey Verlag, Stuttgart 2001, ISBN 3826331869, 2.10, S. 139-145 (hier online ; Stand: 21. April 2009).
- ↑ a b c Rajeev K., e.a.: Selenoprotein expression is essential in endothelial cell development and cardiac muscle function. In: Neuromuscul Disord. 2007 February; 17(2): 135–142, hier online
- ↑ Ferreiro et al.: Mutations of the selenoprotein N gene, which is implicated in rigid spine muscular dystrophy, cause the classical phenotype of multiminicore disease: reassessing the nosology of early-onset myopathies. Am J Hum Genet. 2002;71:739-49. PMID 12192640 Volltext bei Pubmed Central
- ↑ Moghadaszadeh et al.:Mutations in SEPN1 cause congenital muscular dystrophy with spinal rigidity and restrictive respiratory syndrome. Nat Genet. 2001;29(1):17-8. PMID 11528383
- ↑ Ferreiro et al.: Desmin-related myopathy with Mallory body-like inclusions is caused by mutations of the selenoprotein N gene. Ann Neurol. 2004;55(5):676-86. PMID 15122708
- ↑ a b Schweizer U., e.a.: The Neurobiology of Selenium: Lessons from Transgenic Mice. In: The American Society for Nutritional Sciences J. Nutr. 134:707-710, April 2004, hier online
- ↑ a b Semba R. D., e.a.: Low Serum Selenium Is Associated with Anemia Among Older Women Living in the Community: The Women’s Health and Aging Studies I and II. In: Biol Trace Elem Res. 2006 August; 112(2): 97–107, hier online
- ↑ a b c Conrad M., e.a.: Essential Role for Mitochondrial Thioredoxin Reductase in Hematopoiesis, Heart Development, and Heart Function In: Mol Cell Biol. 2004 November; 24(21): 9414–9423, hier online
- ↑ Ein ergänzender Übersichtsartikel zur „Friedreich's Kardiomyopathie“ mit histologischen Abbildungen: James T. N.: Coronary disease, cardioneuropathy, and conduction system abnormalities in the cardiomyopathy of Friedreich's ataxia. In: Br Heart J. 1987 May; 57(5): 446–457, pdf
- ↑ a b Burke M.P, e.a.: Fulminant heart failure due to selenium deficiency cardiomyopathy (Keshan disease). In: Med Sci Law. 2002;42:10–3, hier online
- ↑ a b Beck M.A., e.a.: Selenium deficiency and viral infection. J Nutr. 2003 May;133(5 Suppl 1):1463S-7S, PMID: 12730444, hier online
- ↑ Miller T.L., e.a.: Nutrition in Pediatric Cardiomyopathy. In: Prog Pediatr Cardiol. 2007 November; 24(1): 59–71, hier online
- ↑ Gemma Flores-Mateo, Ana Navas-Acien, Roberto Pastor-Barriuso und Eliseo Guallar: Selenium and coronary heart disease: a meta-analysis. In: Am J Clin Nutr. 2006 October; 84(4): 762–773, hier online
- ↑ a b c d Gärtner R.: Autoimmunthyreoiditis – Wann Schilddrüsenhormonsubstitution? – Wann zusätzlich Selen?- Infoline Schilddrüse hier online, (DocCheck-Passwort erforderlich)
- ↑ Krohn K.: Oxidativer Stress in Schilddrüsen von Mäusen und Ratten unter Jod- und Selen-Defizienz. In: Universität Leipzig, Forschungsbericht 2006 - Projekte, hier online; zuletzt eingesehen am 11. März 2009
- ↑ Ingrid Gerhard, Axel Feige (Hrsg.): Andrologische Störung. In: Geburtshilfe integrativ: Konventionelle und komplementäre Therapie. 1 Auflage. Elsevier, Urban & Fischer, 2005, ISBN 978-3437565106, 10, S. 402-403 (hier online ; Stand: 1. Mai 2009).
- ↑ Broome C. S., e.a.: An increase in selenium intake improves immune function and poliovirus handling in adults with marginal selenium status. In: American Journal of Clinical Nutrition, Vol. 80, No. 1, 154-162, July 2004, hier online
- ↑ Wang C., e.a.: Induced Susceptibility of Host Is Associated with an Impaired Antioxidant System Following Infection with Cryptosporidium parvum in Se-Deficient Mice In: PLoS ONE. 2009; 4(2): e4628, hier online
- ↑ Bunyan J., e.a.: Protective Effect of Trace Elements other than Selenium against Dietary Necrotic Liver Degeneration. In: Nature 181, 1801 (28 June 1958), hier online
- ↑ Hurwitz B. E., e.a.: Suppression of Human Immunodeficiency Virus Type 1 Viral Load With Selenium Supplementation: A Randomized Controlled Trial. In: Arch Intern Med. 2007;167:148-154, hier online
- ↑ Adriane Fugh-Berman (für die deutsche Ausgabe: Dietrich Grönemeyer und Yvonne Kalliope Maratos). Alternative Medizin/Alternative Medizinische Heilverfahren. In: Manfred Dietel, Joachim Dudenhausen, Norbert Suttorp (Hrsg.) Harrisons Innere Medizin. Berlin 2003 ISBN 3-936072-10-8
- ↑ Otis W. Brawley, Barnett S. Kramer (für die deutsche Ausgabe: Steffen Hauptmann). Prävention und Früherkennung von Krebserkrankungen. In: Manfred Dietel, Joachim Dudenhausen, Norbert Suttorp (Hrsg.) Harrisons Innere Medizin. Berlin 2003 ISBN 3-936072-10-8
- ↑ a b Gibt es Indikationen für eine Selengabe? Pharmainformation 20 (2). Innsbruck, Juni 2005 hier online
- ↑ R. Negro et al. The influence of selenium supplementation on postpartum thyroid status in pregnant women with thyroid peroxidase autoantibodies. J Clin Endocrinol Metab. 2007 Apr;92(4):1263-8. PMID 17284630 doi:10.1210/jc.2006-1821
- ↑ Klaus Schwarz, Calvin M. Foltz: Selenium as an integral part of factor 3 against dietary necrotic liver degeneration. In: J. Am. Chem. Soc., 1957, 79 (12), pp 3292–3293, doi:10.1021/ja01569a087
- ↑ Cheng T. O.: Selenium deficiency and cardiomyopathy. In: J R Soc Med. 2002 April; 95(4): 219–220, hier online
- ↑ van Rij A. M., e.a.: Selenium deficiency in total parenteral nutrition.. In: Am J Clin Nutr. 1979 Oct;32(10):2076-85, pdf
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.