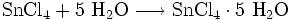- SnCl4
-
Strukturformel Keine Strukturformel vorhanden Allgemeines Name Zinn(IV)-chlorid Andere Namen - Zinnchlorid
- Zinntetrachlorid
- Stannichlorid
Summenformel SnCl4 CAS-Nummer 7646-78-8 Kurzbeschreibung klare, rauchende Flüssigkeit Eigenschaften Molare Masse 260,53 g·mol−1 Aggregatzustand flüssig
Dichte Schmelzpunkt Siedepunkt 114 °C[1]
Dampfdruck Löslichkeit gut löslich in vielen organischen Lösungsmitteln. in Wasser Zersetzung
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Ätzend (C) R- und S-Sätze R: 34-52/53 S: (1/2)-7/8-26-45-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Zinn(IV)-chlorid, manchmal auch einfach Zinnchlorid genannt, ist ein Chlorid des Zinns. Es ist eine klare, rauchende Flüssigkeit, die einen stechenden, salzsäureähnlichen Geruch besitzt. Mit Wasser erfolgt unter starker Erwärmung Hydrolyse zu Zinndioxid und Salzsäure.
Inhaltsverzeichnis
Geschichte
Die erste Erwähnung des Zinnchlorids findet sich 1605 bei Andreas Libavius (daher Spiritus fumans Libavii), aber schon 1630 benutzten es die Holländer in der Cochenillefärberei.
Herstellung
Man erhält Zinn(IV)-chlorid, indem man Zinn(II)-chlorid-Lösungen von 60 °C mit Salzsäure versetzt und bei 40 °C durch Salpetersäure oxidiert. Die Flüssigkeit erstarrt dann beim Erkalten zu Zinnchlorid mit fünf Molekülen Kristallwasser. Man kann das Zinn(II)-chlorid (Zinnchlorür) auch durch Einleiten von Chlor oxidieren.
Zur Darstellung von Zinnchlorid aus Weißblechabfällen, die 3–5 % Zinn enthalten, werden dieselben mit Chlor behandelt und das verflüchtigte Zinnchlorid in Schlangenkühlern verdichtet. Die Lösung des Zinnchlorids gibt beim Verdampfen große, zerfließende Kristalle mit fünf Molekülen Kristallwasser. Die verdünnte wässrige Lösung zersetzt sich beim Erhitzen unter Abscheidung von Zinnsäure.
Die Dämpfe von Zinnchlorid geben mit Wasserdampf bei Rotglut Zinnsäureanhydrid, mit Schwefelwasserstoff Zinnsulfid. Zinnchlorid dient als Beize in der Färberei und Zeugdruckerei, zur Darstellung von Anilinblau und Farblacken, auch zum Verzinnen. Ammoniumzinnchlorid (NH4)2SnCl6 entsteht beim Vermischen konzentrierter Lösungen von Zinnchlorid und Salmiak als farbloses kristallinisches Pulver, welches sich in drei Teilen Wasser löst, in konzentrierter Lösung Siedetemperatur verträgt, dessen verdünnte Lösung aber beim Erhitzen Zinnhydroxid abscheidet.
Eigenschaften
Zinnchlorid bildet eine farblose Flüssigkeit mit einem spezifischen Gewicht von 2,234 und raucht an der Luft sehr stark. Die Verbindung, die noch bei −20 °C flüssig ist und bei 114 °C siedet, wirkt höchst ätzend. Sie löst Schwefel, Iod und Phosphor. An der Luft oder wenig Wasser bildet sich das Pentahydrat (Zinnbutter) als kristalline Masse.
In größeren Mengen Wasser löst sich das Zinn(IV)-chlorid unter weitgehender Hydrolyse auf. Lösungen von Zinnchlorid erhält man auch beim Behandeln von Zinnsäure mit Salzsäure, von Zinnchlorürlösung mit Chlor, beim Behandeln einer mit Salzsäure versetzten Zinnchlorürlösung mit Salpetersäure, beim Lösen von Zinn in Königswasser. Letztere Lösung enthält auch Zinn(II)-chlorid (Zinnchlorür) und führt in der Färberei den Namen salpetersaures Zinn, Scharlach-, Zinnkomposition, Zinnsolution, Physik, Rosiersalz, Rosasäure. Statt dieser Lösungen von unsicherem Gehalt kommt jetzt häufiger Zinnchlorid in fester Form in den Handel.
Verwendung
Zinn(IV)-chlorid wird als Dampf in der Heißendvergütung von Behälterglas eingesetzt, wobei sich auf der heißen Glasoberfläche eine dünne Zinnoxidschicht abscheidet, die das Glas widerstandsfähiger gegenüber Abrieb und Verkratzen macht. Man benutzt Zinn(IV)-chlorid als Beize in der Zeugdruckerei (wo die freie Säure enthaltende Zinnchloridlösung nicht anwendbar ist, benutzt man Ammoniumhexachlorostannat, Pinksalz), zur Darstellung von Teerfarben und Farblacken, auch zum Verzinnen.[3]
Weiterhin dient Zinn(IV)-chlorid zur Herstellung von organischen Zinnverbindungen.
Quellen
- ↑ a b c d Eintrag zu Zinn(IV)-chlorid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 10.11.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7646-78-8 im European chemical Substances Information System ESIS
- ↑ Meyers Großes Konversations-Lexikon. 20, Leipzig 1909, Zinnchlorid, S. 944–945 (Webdigitalisierung, zeno.org).
Wikimedia Foundation.