- Staphylococcus aureus
-
Staphylococcus aureus 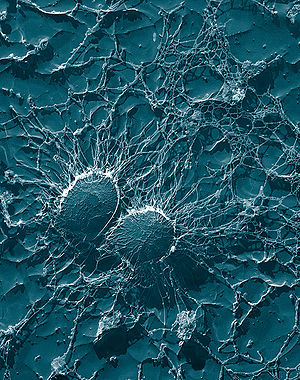
Staphylococcus aureus
sekundärelektronenmikroskopische AufnahmeSystematik Abteilung: Firmicutes Klasse: Bacilli Ordnung: Bacillales Familie: Staphylococcaceae Gattung: Staphylococcus Art: Staphylococcus aureus Wissenschaftlicher Name Staphylococcus aureus Rosenbach 1884 Staphylococcus aureus ist ein kugelförmiges, Gram-positives Bakterium, das häufig in Traubenform angeordnet ist (Haufenkokken). Staphylokokken sind unbeweglich und bilden keine Sporen. Die Größe des Bakteriums liegt üblicherweise zwischen 0,8 und 1,2 µm. S. aureus kommt fast überall in der Natur, auch auf der Haut und in den oberen Atemwegen von 25 bis 30 % aller Menschen vor. Meist löst es keine Krankheitssymptome aus. Man spricht in diesem Falle von einer klinisch asymptomatischen Besiedlung oder Kolonisation der Person mit dem pathogenen Bakterium („Kolonisationskeim“). Bekommt das Bakterium durch günstige Bedingungen oder ein schwaches Immunsystem die Gelegenheit, sich auszubreiten, kommt es beim Menschen zu Hautinfektionen (Furunkel, Karbunkel), Muskelerkrankungen (Pyomyositis), in ungünstigen Fällen auch zu lebensbedrohlichen Erkrankungen wie Lungenentzündung, Endokarditis, Toxisches Schock-Syndrom (TSS) und Sepsis. Falls diese Bakterien Resistenzen gegen mehrere wichtige Antibiotika erwerben (Multiresistenz), sind sie besonders schwer zu eliminieren und werden bei Übertragung auf Dritte auch für diese zur Gefahr. Bei Tieren ist S. aureus einer der wichtigsten Verursacher von Mastitis.
Inhaltsverzeichnis
Name
Die Bezeichnung Staphylococcus aureus besteht aus einem latinisierten Singular zweier altgriechischer Bestandteile, nämlich σταφυλή staphylé ‚Weintraube‘ und κόκκος kókkos ‚Kern‘, ‚Korn‘[1], sowie dem lateinischen aureus ‚der goldene‘. Die Farbbezeichnung rührt daher, dass die meisten Stämme von S. aureus orangegelb („goldgelb“) gefärbt sind (seine Kolonien auf Agargelplatten sind so gefärbt) und dass S. aureus lange Zeit als der Erreger des sog. „goldgelben“ Eiters galt.
Pathomechanismen
 Staphylococcus aureus in der Gramfärbung, man erkennt die charakteristischen namensgebenden traubenförmigen Zusammenballungen.
Staphylococcus aureus in der Gramfärbung, man erkennt die charakteristischen namensgebenden traubenförmigen Zusammenballungen.
Staphylococcus aureus besitzt zahlreiche Pathogenitätsfaktoren, darunter eine Polysaccharidkapsel mit Protein A, die das Bakterium vor Aufnahme in Makrophagen (Phagozytose) schützt. Das Protein A bindet Antikörper an deren Fc-Fragment, also genau „verkehrt herum“, als es für eine effektive Opsonierung notwendig wäre. Dadurch erkennen Makrophagen den Fc-Teil nicht und eine Aufnahme und Zerstörung unterbleibt. Staphylococcus aureus ist ein fakultativ intrazellulärer Erreger und kann mittels Fibronektin bindender Proteine indirekt an Integrin α5β1 binden und über einen Zipper-Mechanismus in die Wirtszelle eindringen. Dies ist einerseits wichtig für die Erregerpersistenz als auch bei der Entstehung invasiver Krankheitsbilder wie Endokarditis, Sepsis und Mastitis[2].
Die Koagulase und der Clumping-Faktor A bewirken eine lokale Gerinnung von Fibrin und damit die Ausbildung eines Fibrinwalls, mit dem S. aureus sich umkleidet und von Antikörpern nun nicht mehr erkannt wird. Der Clumping Faktor ist ein auf der Zelloberfläche befindlicher Fibronektinrezeptor. Erst wenn sich das Bakterium stark vermehrt hat, wird mit Hilfe von Staphylokinase Fibrinolysin gebildet und der Wall aufgebrochen. Mittels der bakteriellen Enzyme Hyaluronidase, DNase, Lipase und Hämolysin ist es nun im Stande, interzelluläres Bindegewebe und Parenchymzellen zu lysieren und invasiv in den Wirtsorganismus vorzudringen. Leukocidin hilft dabei, die zellulären Bestandteile der Immunantwort (Granulozyten und Makrophagen) zu schädigen. Auf diesem Wege verursacht S. aureus pyogene (eitrige) Infektionen, die lokal-oberflächlich (beispielsweise Furunkel, Karbunkel) auftreten können, aber auch schwere tiefe, systemische Prozesse (Osteomyelitis, Pneumonie, Endokarditis, Abszesse, Empyeme, Sepsis) mit hoher Letalität bedingen können.
Die Koagulase und der Clumping Faktor werden zum Nachweis von S. aureus herangezogen.
S. aureus kann mehrere Toxine produzieren, die zu verschiedenen typischen Erkrankungen führen:
- Enterotoxine sind Superantigene. Da sie sehr hitzebeständig sind und durch Kochen nicht zerstört werden, spielen sie eine große Rolle bei Lebensmittelvergiftungen (Durchfall, Erbrechen mit kurzer Inkubationszeit von wenigen Stunden).
- Exfoliatine A und B (in etwa 5 % der S. aureus-Isolate vorhanden) sind neben der Invasion der Bakterien beteiligt am Staphylococcal Scalded Skin Syndrome (Morbus Ritter von Rittershain, Pemphigus neonatorum oder Syndrom der verbrühten Haut: Blasenbildung im Bereich der Haut, Rötung, Juckreiz, Lethargie, Fieber oder Hypothermie, Schleimhäute nicht mitbetroffen (im Gegensatz zum Lyell-Syndrom), Blasen ohne Erreger, hauptsächlich bei Kleinkindern und immunsupprimierten Erwachsenen über 60 Jahre, Therapie: symptomatisch: Flüssigkeit, Haut wie bei Brandverletzten (ITS), Clindamycin als Antibiotikum der Wahl)
- Impetigo bullosa: Blasenbildung nur am Ort der Infektion, bei immunkompetenten Patienten mit Antikörpern gegen Exfoliatine
- TSS: Toxic Shock Syndrome (klassisch bei Tampon benutzenden Frauen aufgetreten, da das Toxin nur bei Magnesiummangel produziert wird. Heutige Tampons sind sicher. Toxin wirkt als Superantigen und aktiviert viele T-Zellen gleichzeitig: Hautrötung, Fieber, Schock usw.)
- Panton-Valentine-Leukocidin: Nekrotisierende Pneumonien mit hoher Letalität.[3]
Staphylococcus aureus zählt zu den wichtigsten Erregern im Krankenhaus erworbener (nosokomialer) Infektionen. Der Erreger kann jedoch auch über Haut oder Schleimhaut von Mensch und Tier aufgenommen werden. Durch Husten oder Niesen besteht die Möglichkeit der Übertragung auf Lebensmittel.
Das Bakterium ist äußerst widerstandsfähig gegen Austrocknung und kann zusätzlich eine Reihe von Resistenzen gegenüber Antibiotika aufweisen.
Multiresistenz
 Ausschnitt aus einer MRSA-Kolonie (elektronenmikroskopische Aufnahme)
Ausschnitt aus einer MRSA-Kolonie (elektronenmikroskopische Aufnahme)
Gebräuchliche Abkürzungen:
- MRSA = Methicillin-resistenter Staphylococcus aureus
- MRE = Multi-resistente Erreger
- ORSA = Oxacillin-resistenter Staphylococcus aureus
- VISA = Vancomycin-intermediate Staphylococcus aureus
- VRSA = Vancomycin-resistenter Staphylococcus aureus
- aber auch
- MRSA = Multi-resistenter Staphylococcus aureus[4]
Unter MRSA (gleichbedeutend auch als ORSA bezeichnet) versteht man im engeren Sinne Staphylococcus aureus-Stämme, die gegen alle bisher marktverfügbaren β-Lactam-Antibiotika (z. B. Penicillin) resistent sind. Sie sind allerdings in der Regel multiresistent, verfügen also meist auch über Resistenzen gegenüber anderen Antibiotikaklassen, so gegen Chinolone, Tetracycline, Aminoglykoside, Erythromycin, Sulfonamide. Daher gilt MRSA vereinfachend als Sammelbezeichnung für alle Antibiotika-resistenten SA-Stämme. VRSA besitzen zusätzlich eine verminderte Empfindlichkeit gegenüber Vancomycin und anderen Glykopeptidantibiotika. Die wenigen bisher beschriebenen VRSA-Stämme sind resistent gegenüber Vancomycin und anderen Glykopeptidantibiotika.
Methicillin wurde historisch für den Antibiotika-Sensitivitätstest von Bakterien eingesetzt. Eine Therapie erfolgt im positiven Fall meist mit Vancomycin, solange keine Resistenzen gegen dieses Arzneimittel vorliegen. Die Behandlung sollte sich am Antibiogramm orientieren, denn auch gegen Vancomycin sind schon Resistenzen aufgetreten (VRSA).
Methicillin und Oxacillin gehören zu den Penicillinase-stabilen Penicillinen. In Deutschland wird unter anderem Oxacillin eingesetzt. Weitere Vertreter dieser Stoffklasse sind Cloxacillin, Dicloxacillin und Nafcillin (in den USA verwendet). Methicillin wird nicht mehr zur Therapie verwendet.
Erstmals beschrieben wurden MRSA Anfang der 1960er Jahre in Großbritannien.[5][6]
In Deutschland bekannt wurden sie auch durch den Fernseh-Dokumentarfilm „Tatort Krankenhaus“ von Tilman Wolff. Darin wurde 2008 verdeutlicht, dass in deutschen Krankenhäusern jährlich etwa 160.000 Menschen mit MRSA infiziert werden und dass es im Klinikalltag vielfach an elementaren Hygienemaßnahmen wie Händewaschen mangelt.[7]
2011 wurden in einer Studie in den USA in Geflügelfleisch Erreger nachgewiesen, die gegen neun Antibiotika resistent sind.[8][9]
Mechanismus der Resistenz
Gegen Antibiotika resistente Erreger kommen vermehrt dort vor, wo ständig Antibiotika verwendet werden. Die Antibiotika töten zwar fast alle Individuen der Erreger ab, aber einige wenige können überleben, weil sie aufgrund einer Mutation gegen das angewendete Antibiotikum resistent sind. Diese resistenten Individuen vermehren sich dann trotz der Antibiotika-Therapie weiter - eine klassische Selektion im evolutionsbiologischen Sinne. Die Resistenz vermittelnden Gene werden dabei auch artübergreifend weitergegeben, d. h. z. B. von Staphylococcus aureus zu anderen Arten.[10] Die Entstehung von Resistenzen gegen Antibiotika wird allerdings auch durch die Verwendung von Reinigungsmitteln, die sogenannte quartäre Ammoniumverbindungen (QAV) mit desinfizierender Wirkung enthalten, begünstigt. Denn die selben Gene der Bakterien, welche die QAV-Resistenz liefern, vermitteln ihnen auch die Resistenz gegen Antibiotika.[10] Zu den insofern kritischen Stoffen gehören die meisten marktüblichen kationischen Tenside. Ähnliches gilt für Triclosan, das als Desinfektions- und Konservierungsstoff in Haushaltsreinigern, Waschmitteln, Zahnpasten, Deodorantien und Seifen enthalten ist.
MRSA besitzen das Resistenzgen mecA, das für ein modifiziertes Penicillin-Bindeprotein (PBP2a, syn. PBB2') kodiert. Dieses Protein – die bakterielle Transpeptidase – ist normalerweise für die korrekte Verknüpfung der Bausteine der Zellwand verantwortlich. β-Lactam-Antibiotika imitieren einen solchen Baustein, binden aber irreversibel an die Transpeptidase welche dadurch dauerhaft inaktiviert wird. Wenn genügend Transpeptidasen auf diese Weise zerstört werden, können keine neuen Verknüpfungen mehr gebildet werden und die Zellwandsynthese kommt zum Erliegen. (β-Lactam-Antibiotika wirken deshalb nur auf wachsende Zellen.)
Das modifizierte Penicillin-Bindeprotein baut jedoch keine β-Lactam-Antibiotika in die Zellwand ein und führt dazu, dass MRSA gegen alle β-Lactam-Antibiotika (Penicilline, Cephalosporine und Carbapeneme) resistent sind. Charakteristisch für MRSA war bis vor kurzem, dass sie auch gegen weitere Antibiotikaklassen (beispielsweise Tetracycline, Aminoglykoside, Makrolide) Resistenzen erworben haben und damit eine Multiresistenz aufweisen. Seit wenigen Jahren beobachtet man zusätzlich eine neue Gruppe von MRSA, die diese Multiresistenz nicht aufweisen und als sog. community-acquired MRSA (auch community onset MRSA) bezeichnet werden.
Ein weiterer Resistenzmechanismus gegen β-Lactame, der aber nicht nur bei den MRSA anzutreffen ist, beruht auf der Bildung eines Enzyms, das Penicillin abbauen kann (Betalactamase).
Allerdings sind auch Infektionen mit nicht resistenten Staphylococcus-Stämmen, etwa im Mittelohr oder in den Atemwegen, häufig nur sehr schwer mit Antibiotika zu bekämpfen. Diese Infektionen neigen dazu, chronisch zu werden, das heißt, sie flammen immer wieder auf. Offenbar sind diese Bakterien in der Lage, in Körperzellen einzudringen.[11] Dort fahren die Krankheitserreger ihren Stoffwechsel stark herunter. Durch den Einschluss in Körperzellen dem Immunsystem des Wirts entzogen und durch Absenkung des Stoffwechsels geschützt vor Antibiotika können sie so Tage bis möglicherweise Wochen ausharren, um anschließend ihren Stoffwechsel wieder hochzufahren, sich zu vermehren und sich erneut auszubreiten.
Verbreitung von MRSA
Auffallend sind die großen Unterschiede in der Häufigkeit von MRSA zwischen Staaten ansonsten gleichen Niveaus des Gesundheitswesens.[12] Während in den skandinavischen Ländern der Anteil von MRSA unter den S. aureus-Stämmen gering ist und in den Niederlanden bei ca. 3 % liegt, beträgt die MRSA-Rate im benachbarten Deutschland durchschnittlich etwa 25 %,[13] wobei es – vermutlich je nach Krankenhaushygiene – starke lokale Unterschiede gibt (bis über 50 %). In den südeuropäischen Ländern, den USA sowie in vielen asiatischen Ländern (Japan) liegen die Werte sogar bei 30 bis über 70 %. Auch in Gefängnissen, ambulanten Diensten, öffentlichen Duschen und dergleichen finden sich MRSA.
In Einrichtungen der Alten- und Krankenversorgung
MRSA stellen weltweit vor allem in Kliniken eine Gefahr dar. Besonders betroffen sind die chirurgischen Intensivstationen, Abteilungen für Brandverletzungen und Neugeborenenstationen.
Der Anteil von Personen mit MRSA zu nicht betroffenen Personen (Prävalenz) bei Bewohnern von Altenheimen und Patienten von Reha- und Akutkliniken lag im Kreis Höxter zwischen 1,2 und 3,4 %.[14] In Deutschland infizieren sich etwa 50.000 Patienten je Jahr mit MRSA. In manchen Kliniken beruhen bis zu 30 % der dort erworbenen Infektionen auf MRSA.
Eine unbekannte Anzahl von Patienten ist schon bei der Aufnahme in die Klinik infiziert, ohne es zu wissen. Hier kann nur eine Eingangsuntersuchung Klarheit verschaffen, wie sie in den Niederlanden durchgeführt wird.
Nach Angaben der Techniker-Krankenkasse Schleswig-Holstein ist die Zahl der MRSA-Erkrankungen in den Kliniken dieses Bundeslandes von 2006 bis 2009 um 192 % gestiegen (von 191 auf 557 Fälle). Auch die Zunahme in anderen Bundesländern lag bei teilweise über 200 %.[15]
Außerhalb von Kliniken
Zum ersten Mal beschrieben wurden Methicillin-resistente S. aureus-Stämme 1993 bei australischen Ureinwohnern, die nie Kontakt zum Gesundheitswesen hatten.[16] Ende der neunziger Jahre des 20. Jahrhunderts wurden solche Stämme zum ersten Mal in den USA beobachtet. Seither haben ambulant erworbene MRSA-Infektionen stetig an Bedeutung gewonnen.
MRSA werden zunehmend auch außerhalb von Krankenhäusern gefunden. Im englischsprachigen Schriftgut werden diese Erreger als Community-acquired methicillin-resistant Staphylococcus aureus (cMRSA oder caMRSA bzw. CA-MRSA) bezeichnet. Darunter gibt es Stämme wie den Pulsed-Field Gelelektrophorese (PFGE)-Typ USA300 (entspricht dem Multi Locus Sequence Typing (MLST)-Typ ST 8) mit besonders aggressivem Verhalten, die das sogenannte Panton-Valentine-Leukocidin aufweisen (PVL-MRSA).
In manchen Regionen der USA wurde CA-MRSA in der Mehrzahl schwerer Haut- und Weichteilinfektionen nachgewiesen. Im Gegensatz zu nosokomialen MRSA-Stämmen spricht CA-MRSA oft auf die Therapie mit einigen nicht-β-Lactam-Antibiotika an.[17]
Nach einer französischen Studie schleppen viele Patienten, die sich im Krankenhaus infiziert haben, diese Bakterien nach ihrer Entlassung in ihre Wohnungen ein.[18][19]
In den USA wurden an fünf von zehn untersuchten öffentlichen Meeresstränden in den Bundesstaaten Kalifornien und Washington MRSA gefunden.[20]
Auch in Klärschlämmen verschiedener Regionen Englands wurden resistente Stämme von Staphylococcus aureus nachgewiesen.[10]
MRSA sind darüber hinaus nicht auf den Menschen beschränkt. In einer Studie wurden 2007 in kanadischen Schweinefarmen MRSA gefunden. Menschen waren in der Hälfte dieser 20 Farmen kolonialisiert, Schweine in einem Viertel. Die genetische Information der Bakterien war jeweils identisch, was eindeutig auf eine Übertragung zwischen Mensch und Tier hinweist.[21]
Schon früher ist man auch in den Niederlanden auf MRSA in der Schweinezucht gestoßen. Es hat sich dort gezeigt, dass in Betrieben, in denen Schweine routinemäßig mit Antibiotika behandelt wurden, 60 % der Schweine mit MRSA infiziert waren. In Betrieben, in denen die Schweine nicht routinemäßig Antibiotika erhielten, waren nur 5 % mit MRSA infiziert.[22]
In einer internationalen Studie wurde die Rate kolonialisierter Schweinezucht-Arbeiter mit 12 % bestimmt, wobei Schutzkleidung offensichtlich keinen Nutzen hatte.[23]
Bei einer weiteren niederländischen Studie waren 41 % von 540 Schlachtschweinen MRSA-infiziert. Auch im Rahmen des Viehhandels sowie des Schlachtvorganges können die Bakterien verschleppt und dann in Lebensmitteln von entsprechenden Tieren nachgewiesen werden, so in Puten-, Hähnchen- oder Kalbfleisch sowie in Rohmilch.[24]
Todesfälle durch MRSA
In den USA starben im Jahr 2005 etwa 19.000 Menschen allein an Infektionen mit MRSA.[25]
Für Deutschland gehen die Schätzungen der Todesfälle durch im Krankenhaus erworbene Infektionen weit auseinander, von jährlich etwa 1500 Todesopfern[26] bis zu etwa 40.000.[27] Auch die Deutsche Gesellschaft für Krankenhaushygiene schätzte 2009 etwa 40.000 Todesfälle jährlich durch in deutschen Krankenhäusern zugezogene Infektionen.[28] Das wäre deutlich mehr als die durchschnittliche jährliche Übersterblichkeit durch die saisonale Influenza. Die ungenauen Angaben liegen unter anderem darin begründet, dass MRSA in Deutschland – anders als beispielsweise in Großbritannien – nicht im Totenschein als Diagnose vermerkt wird. Es müsste zudem unterschieden werden, ob die MRSA-Infektion tatsächlich todesursächlich war oder nur eine klinisch unbedeutende Infektion bzw. Kolonisation mit MRSA bestand.
Eine MRSA-Infektion erhöht in Deutschland das Risiko, bei einem Klinikaufenthalt zu sterben, um den Faktor 2,7.[29]
Therapie
Zwar kann versucht werden, Infektionen mit MRSA mit so genannten Reserveantibiotika wie Vancomycin und neuerdings Linezolid, Daptomycin, Tigecyclin oder Quinupristin/Dalfopristin zu behandeln. Letztere sind auch gegen vancomycinresistente Staphylococcus aureus wirksam, Linezolid kann auch oral verabreicht werden. Nachdem es im Zusammenhang mit Linezolid-Anwendung zu erhöhter Sterblichkeit kam (weil nicht gegen gram-negative Erreger wirksam, s. Warnhinweise des BfArM[30]), gelten Tigecyclin, Daptomycin neben Vancomycin als Mittel der Wahl. Doch im klinischen Alltag gestaltet sich die Therapie von Patienten mit MRSA-Infektionen oft schwierig und langwierig. Bei manchen Patienten, die bereits auf dem Weg der Besserung sind, ist es möglich, die Antibiotikabehandlung zu beenden. Dann kann sich auch die normale Mikroorganismengesellschaft von Haut- und Schleimhaut regenerieren und verdrängt die MRSA wieder.
Bakteriophagen wurden bis zur Einführung der Antibiotika gegen Infektionen eingesetzt und könnten eine Behandlungsoption gegen multiresistente Bakterien bieten. Aktuelle Erfahrungen gibt es bislang nur in der ehemaligen Sowjetunion [31] und Polen[32].
Aktuelle japanische Studien haben ergeben, dass ein verwandtes Bakterium, Staphylococcus epidermidis, ein Enzym bildet, das den Biofilm des Staphylococcus aureus zerstören und Bildung neuer Biofilme verhindern soll.[33]
Vorsorge
Es sind vor allem falsche und schlecht durchgeführte Therapien, durch die resistente Erreger gezüchtet werden.[34] Das Auftreten von MRSA-Stämmen im Krankenhaus erfordert gezielte antiepidemische Maßnahmen mit Isolierung des Patienten oder mehrerer mit MRSA besiedelten Patienten in einem Zimmer – sogenannte Kohortenisolierung. Da die Erreger im Krankenhaus meist von Pflegepersonal und Ärzten (iatrogen) verbreitet werden, ist die wichtigste Maßnahme gegen die Ausbreitung multiresistenter Erreger die gründliche Händedesinfektion. Je nach der zu verrichtenden Tätigkeit am Patienten oder der Lokalisation des MRSA beim Patienten werden zusätzlich Einmalhandschuhe, Schutzkittel und Mundschutz getragen. Die strikte Einhaltung der Händehygiene ist der wichtigste Teil der Vorsorge. Isolierungsmaßnahmen können die Übertragungsrate in Krankenhäusern deutlich verringern.[35] Führungskräften kommt dabei eine wichtige Vorbildfunktion zu.[36]
Vom Robert-Koch-Institut (RKI) werden Screening-Untersuchungen in Krankenhäusern bisher nur für bestimmte Gruppen empfohlen:
- bei Patienten mit beispielsweise chronischer Pflegebedürftigkeit, liegenden Kathetern, chronischen Wunden
- beim Krankenhauspersonal bei Ausbruch, d. h. bei gehäuftem Nachweis von MRSA bei mehr als zwei Patienten, die in einem räumlichen und zeitlichen Zusammenhang stehen, und bei nachgewiesener klonaler Identität des MRSA.
Dagegen hält das RKI bisher das Screening aller zur Aufnahme kommenden Patienten und des gesamten Personals noch für zu aufwändig, und das Gesundheitsministerium des Bundes verweist auf die Zuständigkeit der Länder.[37] So hat das Bayerische Landesamt für Gesundheit und Lebensmittelsicherheit Ende 2009 eine Landes-Arbeitsgemeinschaft Multi-Resistente Erreger (LARE) eingerichtet, die auch eine Telefon-Hotline und Website unterhält.[38]
In Deutschland haben nur fünf Prozent der deutschen Kliniken einen Hygienearzt – mit sinkender Tendenz. In den Niederlanden hingegen umfassen die Schutzmaßnahmen das Screening aller zur Aufnahme kommenden Patienten, den Einsatz eines Hygienefacharztes in jeder Klinik und die Abstimmung jeder Antibiotika-Behandlung mit einem Mikrobiologen. Hierunter kam es zu einer massiven Absenkung der MRSA-Prävalenz mit einer Häufigkeit von 20% der im benachbarten Deutschland auftretenden Fälle.[34] Auch ist die Häufigkeit von MRSA des benachbarten Raums Münster gesunken, nachdem dort seit 2006 in über 40 Kliniken im Rahmen des EUREGIO-Projektes MRSA-net ein Verfahren ähnlich dem niederländischen eingeführt wurde.[39][40]
Experten halten ein ähnliches Vorgehen für den Rettungsdienst und Krankentransport für sinnvoll. Da viele Patienten, die in klinischer Behandlung waren, Träger von MRSA sind, ohne es zu wissen oder die entsprechenden Symptome zu zeigen, sollte das Rettungsfachpersonal die Anamnese auch auf solche Krankheiten hin betreiben. Der Transport eines MRSA-positiven Patienten erfordert vom Rettungsfachpersonal das Tragen von Schutzkleidung und Einmalhandschuhen sowie eine Schlussdesinfektion des kompletten Fahrzeugs. Hierbei steht nicht der Schutz des Personals im Vordergrund (Eine Kolonialisation mit MRSA bleibt für Gesunde in der Regel folgenlos), sondern eine Eindämmung der Verbreitung von MRSA, da der Rettungs- bzw. Krankentransportdienst durch die hohe Zahl von Patientenkontakten und den häufigen Aufenthalt in Kliniken einen wirksamen Vektor darstellt.[41] Dies zusätzlich deshalb, weil bisher bei der Entlassung von infizierten Patienten eine Dekolonisierung ausbleibt, da deren Kosten bis heute nicht von den Krankenkassen getragen werden.[36]
Zum 1. Januar 2011 soll im deutschen Bundesland Baden-Württemberg eine neue Hygieneverordnung für Kliniken, Vorsorge- und Rehabilitationseinrichtungen verbindlich in Kraft treten, um die Anzahl der Klinikinfektionen einzudämmen und eine landeseinheitliche Systematik für die Infektionsprävention zu schaffen.[42][43] Dabei soll ein effizientes Hygienemanagement etabliert werden, das heißt u. a. soll die Erstellung von Hygieneplänen sowie die Benennung von Ansprechpersonen und Beauftragten, welche sich um die Einhaltung von Vorschriften kümmern sollen, verbindlich geregelt und vorgeschrieben werden.
Im häuslichen Bereich sollen die üblichen konservativen Hygienemaßnahmen eingehalten werden, also ohne die Verwendung von Desinfektionsmitteln (siehe oben: Resistenzbildungen eben durch Desinfektionsmittel), Fleisch nicht roh verzehrt und insbesondere Kleinkindern keine rohe Milch zu trinken gegeben werden.[24]
Zusammenfassend können Neuentstehung und Ausbreitung von MRSA durch drei Vorgehensweisen bekämpft werden:
- durch den rationellen und erregerorientierten Einsatz von Antibiotika sowie durch deren Nichtanwendung, falls es nicht erforderlich ist (beispielsweise bei leichteren Virusinfektionen der Atemwege ohne größere Gefahr der Zweitinfektion mit Bakterien)
- durch konsequentes Umsetzen von (vorbeugenden) Hygienemaßnahmen im Krankenhaus
- durch Screening aller Patienten sofort bei der Aufnahme im Krankenhaus mit Isolierung und Sanierung betroffener Patienten, wie es weiter oben unter "Niederlande" beschrieben wurde. Ein Kostenvergleich des niederländischen Systems mit dem in Deutschland bislang vorherrschenden sollte inzwischen möglich sein. Trotzdem wären Kosten allein nicht relevant, da die Vermeidung von Todesfällen und schweren Komplikationen selbstverständlich Vorrang hat.
Psychosoziale Effekte einer MRSA-Infektion wurden in Deutschland bisher (März 2010) völlig unzulänglich erforscht.[44]
Meldepflichten, Versorgung und Kennzeichnung von Verstorbenen mit MRSA
Seit dem 1. Juli 2009 müssen MRSA-Infektionen in Blut oder Hirnwasser den zuständigen Gesundheitsbehörden gemeldet werden.[45] Wenn aber Patienten, die anderweitig Träger vom MRSA waren, in der Klinik oder einer anderen Einrichtung sterben, so ist diese Besiedelung nach dem Infektionsschutzgesetz nicht meldepflichtig. Der die Leichenschau durchführende Arzt wird deshalb auf der Todesbescheinigung in solchen Fällen unter Infektionsgefahr NEIN ankreuzen, und es gelten beim Umgang mit diesen Leichen die üblicherweise erforderlichen (einfacheren) Hygienemaßnahmen als ausreichend.
Phytotherapie
Extrakte verschiedener Pflanzenarten zeigen im Labor teilweise hohe Aktivität gegen MRSA mit mehreren Resistenzen, die in manchen Fällen synergistisch mit Penicillinen ist (hier: verstärkend auf das eingenommene Penicillin reagiert) : hohe Aktivität zeigte Indisches Basilikum (Ocimum tenuiflorum), weiterhin Darjeeling-Tee (Camellia sinensis), der Flammenbaum (Delonix regia), Holarrhena antidysenterica, der Hennastrauch (Lawsonia inermis), Granatapfel (Punica granatum), Terminalia chebula und Terminalia belerica (zwei Flügelsamengewächse).
Andererseits waren Knoblauch (Allium sativum) und Orange (Citrus sinensis) wenig aktiv. In allen genannten Pflanzenextrakten konnten Phenole und Flavonoide als Träger der Aktivität festgestellt werden.[46] In einer anderen Laborstudie waren neben dem genannten indischen Basilikum auch Sesamöl und Sojabohnenöl moderat wirksam.[47][48]
Dem Öl der Himalaya-Sorte von Oregano (Oreganum vulgare) wurden 2008 höchst wirksame Eigenschaften gegen MRSA nachgewiesen. In Studien zeigte es eine höhere Effektivität als 18 derzeit im Einsatz befindliche Medikamente. Zuvor waren antimikrobielle Wirkungen des Öls der mediterranen Sorte bekannt. In beiden Fällen ist Carvacrol der Haupt-Wirkstoff.[49][50]
In der klinischen Routine werden diese Stoffe angesichts noch nicht ausreichender Wirksamkeitsnachweise (Stand 2008) nicht eingesetzt.
Siehe auch
- Hygienebeauftragter Arzt
- Krankenhaushygieniker
- Wäscherei
- Desinfektion
- Kommission für Krankenhaushygiene und Infektionsprävention am Robert Koch-Institut
- Deutsche Gesellschaft für Hygiene und Mikrobiologie
- Infektionsepidemiologisches Jahrbuch (herausgegeben vom Robert Koch-Institut)
Literatur
- Kipp, Frank; Friedrich, Alexander W.; Becker, Karsten; von Eiff, Christof: Bedrohliche Zunahme Methicillin-resistenter Staphylococcus-aureus-Stämme: Strategien zur Kontrolle und Prävention in Deutschland Dtsch Arztebl 2004; 101(28-29): A-2045 [2]
- Mitteilung der Kommission für Krankenhaushygiene und Infektionsprävention am RKI: Empfehlung zur Prävention und Kontrolle von Methicillin-resistenten Staphylococcus aureus-Stämmen (MRSA) in Krankenhäusern und anderen medizinischen Einrichtungen Bundesgesundheitsblatt 1999, 42 (12) S. 954-958 Seite des RKI mit Informationen zu MRSA, als PDF von dort downloadbar
- Medizinische Wirksamkeit und Kosten-Effektivität von Präventions- und Kontrollmaßnahmen gegen MRSA-Infektionen im Krankenhaus 47 kB, Kurzfassung des DIMDI-HTA-Berichts vom 17. März 2010, abgerufen am 10. April 2010
- Köck, R. et al.: Methicillin-resistenter Staphylococcus aureus in Deutschland: Epidemiologie. In: Dtsch Arztebl Int. Nr. 108(45), 2011, S. 761-7 (Übersichtsarbeit).
Weblinks
 Commons: Staphylococcus aureus – Album mit Bildern und/oder Videos und Audiodateien
Commons: Staphylococcus aureus – Album mit Bildern und/oder Videos und Audiodateien- Staphylokokken und MRSA – Informationen des Robert Koch-Instituts
- Antibiotikaresistenznetzwerk Südwest
- MRSA net, Seite mit zwei Bereichen für Öffentlichkeit und Fachpersonal
- MRSA Netzwerk Ostwestfalen - Lippe, Seite mit Bereichen für Fragen von Angehörigen und Betroffenen
- Infoseite der Uni Köln zu MRSA
- Der wichtigste Erreger im Zusammenhang mit der chronischen/rezidivierenden Furunkulose
- MRSA: Neuer Problemkeim www.sueddeutsche.de, vom 17. Januar 2008
- SARI Antibiotika-Anwendung und Resistenzentwicklung auf deutschen Intensivstationen
- New Strategy Cracks Staph Bacterium's "Golden Armor," Making It Vulnerable To Treatment
- www.badische-zeitung.de, Ratgeber Gesundheit und Ernaehrung, 6. September 2010, Michael Brendler: Problemkeime im Krankenhaus mit Übersicht zu Fallzahlen in Südwest-Baden-Württemberg im Jahr 2010
- Staphylococcus aureus - Krankenhauskeim mag menschliches Blut, bei Spiegel.de
- Telepolis 16. April 2011: USA: Fleisch und Geflügel in hohem Maß mit multiresistenten Bakterien kontaminiert
Einzelnachweise
- ↑ Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. München/Wien 1965.
- ↑ Christof R. Hauck, Franziska Agerer, Petra Muenzner, Tim Schmitter: Cellular adhesion molecules as targets for bacterial infection. In: European Journal of Cell Biology. 3-4, Nr. 85, 2006, S. 235-242, doi:10.1016/j.ejcb.2005.08.002.
- ↑ M. Labandeira-Rey, F. Couzon, S. Boisset, E. L. Brown, M. Bes, Y. Benito, E. M. Barbu, V. Vazquez, M. Hook, J. Etienne: Staphylococcus aureus Panton-Valentine Leukocidin Causes Necrotizing Pneumonia. In: Science. 315, Nr. 5815, 2007, S. 1130–1133, doi:10.1126/science.1137165.
- ↑ http://www.uni-koeln.de/med-fak/immh/hygiene/mrsa.html
- ↑ Jevons M: “Celbenin” - resistant Staphylococci. In: Br Med J. 5219, Nr. 1, Januar 1961, S. 124–5. Volltext bei PMC: 1952888.
- ↑ SUTHERLAND R, ROLINSON GN: CHARACTERISTICS OF METHICILLIN-RESISTANT STAPHYLOCOCCI. In: J. Bacteriol.. 87, April 1964, S. 887–99. PMID 14137628. Volltext bei PMC: 277108.
- ↑ wdr.de Zusammenfassung des Films Tatort Krankenhaus - Warum Händewaschen Menschleben rettet und Links zu weiteren Sachinformationen
- ↑ http://www.heise.de/tp/blogs/10/149683
- ↑ http://cid.oxfordjournals.org/content/early/2011/04/14/cid.cir181.abstract
- ↑ a b c Wolfgang W. Merkel: Seifen machen gefährliche Bakterien resistent auf Die Welt vom 2. April 2009. Abgerufen am 2. November 2009
- ↑ Warum Staphylococcus aureus so hartnäckig ist, BMC Genomics
- ↑ http://www.rivm.nl/earss/
- ↑ Matthias Günther: Gefährliche Keime: Immer mehr Infektionen in Schleswig-Holsteins Kliniken. abgerufen am 7. Juni 2010: „Nach Schätzungen sind in deutschen Krankenhäusern auftretende Keime zu etwa einem Viertel antibiotikaresistent, in den Niederlanden aber nur zu höchstens drei Prozent.“ Deutschlandfunk, Sprechstunde vom 27. April 2010
- ↑ Woltering R et al: MRSA-Prävalenz in medizinischen und pflegerischen Einrichtungen eines Landkreises / Prevalence of methicillin-resistant Staphylococcus aureus (MRSA) in patients in long-term care in hospitals, rehabilitation centers and nursing homes of a rural district in Germany. In: Dtsch med Wochenschr 2008; 133(19): 999-1003. Abgerufen am 7. Juni 2010 (deutsch/englisch). PMID:18446675
- ↑ http://www.dradio.de/dlf/sendungen/sprechstunde/1171047/
- ↑ Udo EE, Pearman JW, Grubb WB: Genetic analysis of community isolates of methicillin-resistant Staphylococcus aureus in Western Australia.. In: J Hosp Infect 1993;25:97-108. PMID 7903093
- ↑ Bassetti M, Nicco E, Mikulska M: Why is community-asscociated MRSA spreading across the world and how will it change clinical practice? Int J Antimicrob Agents. 2009 Jul;34 Suppl 1:S15-9. PMID 19560669
- ↑ http://www.mrsa-net.nl/de/nieuws.php?type=1&id=75
- ↑ http://www.mrsa-net.nl/de/nieuws.php?type=1&id=72
- ↑ http://www.mrsa-net.nl/de/nieuws.php?type=1&id=80
- ↑ T. Khanna et al.: Methicillin resistant Staphylococcus aureus colonization in pigs and pig farmers. Vet. Microbiol. In Press, Accepted Manuscript, Available online 16 October 2007 doi:10.1016/j.vetmic.2007.10.006
- ↑ Michael Pollan The Way We Live Now - Our Decrepit Food Factories. The New York Times, Available online 23 Februar 2009 2007 [1]
- ↑ M. W. Wulf et al.: Prevalence of methicillin-resistant Staphylococcus aureus among veterinarians: an international study. Clin Microbiol Infect. 6 Nov 2007 doi:10.1111/j.1469-0691.2007.01873.x
- ↑ a b Gudrun Heyn: Problemkeime in der Nahrung in der Pharmazeutischen Zeitung, Ausgabe 19/2009.
- ↑ Online-PDF Klevens et al.: Invasive Methicillin-Resistant Staphylococcus aureus Infections in the United States
- ↑ http://www.mrsa-net.nl/de/zoeken.php?type=1
- ↑ http://www.wdr.de/tv/diestory/sendungsbeitraege/2009/1026/index.jsp Westdeutscher Rundfunk, Fernsehen, "die story", Sendung vom 26. Oktober 2009, Killerbrut, die verschwiegene Katastrophe
- ↑ http://www.dgkh.de/informationen/
- ↑ http://www.badische-zeitung.de/verordnung-soll-toedliche-infektionen-in-kliniken-eindaemmen--29986299.html
- ↑ Linezolid (Zyvoxid®): Erhöhte Mortalität bei schweren Haut- und Weichteilinfektionen, die nicht ausschließlich durch grampositive Erreger verursacht werden – Anwendungsbeschränkungen beschlossen. In: Pharmakovigilanz/Risikoinformationen. Bundesinstitut für Arzneimittel und Medizinprodukte, 16. März 2007, abgerufen am 5. Mai 2010.
- ↑ Kropinski AM: Phage therapy – everything old is new again. Can J Infect Dis Med Microbiol 2006 (17):297–306.
- ↑ Miedzybrodzki R, et al.: Phage therapy of staphylococcal infections (including MRSA) may be less expensive than antibiotic treatment. Postepy Hig Med Dosw (Online) 2007 (61):461-5. PMID: 17679835
- ↑ Tadayuki Iwase (Jikei University School of Medicine, Tokyo) et al.: Nature, Bd. 465, Nr. 7296, S. 346
- ↑ a b http://www.badische-zeitung.de/gesundheit-ernaehrung/problemkeime-im-krankenhaus--35081308.html www.badische-zeitung.de, 6. September 2010, Ratgeber Gesundheit und Ernährung, Michael Brendler: Problemkeime im Krankenhaus
- ↑ http://www.mrsa-net.nl/de/nieuws.php?type=1&id=49
- ↑ a b Katja Schmidt: Chefs müssen gute Hygiene vorleben, in Ärztezeitung, vom 26. Juni 2009. Abgerufen am 10. November 2009
- ↑ http://www.wdr.de/tv/diestory/sendungsbeitraege/2009/1026/index.jsp Westdeutscher Rundfunk, Fernsehen, „die story“, Sendung vom 26. Oktober 2009, Killerbrut, die verschwiegene Katastrophe
- ↑ http://www.lgl.bayern.de/gesundheit/lare/index.htm
- ↑ http://www.klinikum.uni-muenster.de/index.php?id=hygiene_umgang-mit-mrsa&no_cache=1&sword_list
- ↑ MRSA-Net
- ↑ Infektionen mit Methicillin-resistentem Staphylococcus aureus: Bedeutung des Pathogenitätsfaktors Panton-Valentine Leukozidin, Deutsche Medizinische Wochenschrift, 2005, März, 18;130(11):582-5; quiz 589-92
- ↑ http://www.badische-zeitung.de/verordnung-soll-toedliche-infektionen-in-kliniken-eindaemmen--29986299.html%7CBadische Zeitung, Freiburg, gedruckte Ausgabe vom 22. April 2010, Seite 8
- ↑ www.badische-zeitung.de/nachrichten/suedwest/keime-in-kliniken-land-setzt-auf-neue-hygieneverordnung, 4. August 2010
- ↑ MRSA im Krankenhaus: Prävention und Kontrolle erfolgreich- Weitere Forschung notwendig, DIMDI- Pressemitteilung vom 17. März 2010, abgerufen am 10. April 2010
- ↑ Patientensicherheit stärken – neue Meldepflicht bei MRSA, EUREGIO MRSA-net Twente/Münsterland, Neuigkeiten vom 28. Mai 2009, abgerufen am 10.April 2010
- ↑ F. Aqil et al.: Effect of certain bioactive plant extracts on clinical isolates of beta-lactamase producing methicillin resistant Staphylococcus aureus. J Basic Microbiol. 45/2/2005. S. 106-14. PMID 15812867
- ↑ S. Singh et al.: Antibacterial activity of Ocimum sanctum L. fixed oil. Indian J Exp Biol. 43/9/2005. S. 835-7. PMID 16187537
- ↑ Klaus Hönninger: in: Ethnoline Peru: Impacto de la combinacion de Croton Lechleri, Piper Angostifolium y Plantago Major en la curacion de Estafiloco Aureus en las vias respiratorias superiores Lima 2006
- ↑ Himalayan Oregano Effective Against MRSA. Medical News Today (24 November 2008). Abgerufen am 26. November 2008.
- ↑ Scientists win SEED award for Himalayan oregano project. University of the West of England (28. Oktober 2008). Abgerufen am 26. November 2008.

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.



