- Sulfuride
-
Sulfide sind Salze oder Ether des Schwefelwasserstoffs (H2S). Die Salze gehören zur Stoffgruppe der Metall-Schwefel-Verbindungen und enthalten das Sulfid-Anion S2- als Bestandteil. Anion selbst wird ebenfalls kurz als Sulfid bezeichnet. Metallsulfide stellen in der Mineralogie eine wichtige Gruppe von Erzen dar. In der Analytik gehören die Metallsulfide in die sogenannte Schwefelwasserstoffgruppe und die Ammoniumsulfidgruppe.
Die Ether gehören zu den Organischen Verbindungen (organischer Rest: R-) und weisen die Struktur R-S-R' auf. Sie können daher auch als Thioether betrachtet werden.
Inhaltsverzeichnis
Vorkommen in Mineralien
 Pyritwürfel im Muttergestein, Pyrit ist ein Eisensulfid
Pyritwürfel im Muttergestein, Pyrit ist ein Eisensulfid Das Mineral Zinnober (Cinnabarit), chemisch: Quecksilbersulfid, ein Pigment
Das Mineral Zinnober (Cinnabarit), chemisch: Quecksilbersulfid, ein PigmentZusammen mit Metall- oder Halbmetall-Kationen entstehen die etwa 600 Sulfid-Minerale, die sich meist durch charakteristische Farben und Strichfarben auszeichnen. Zu ihnen gehören eine Reihe wichtiger Erze, so dass anorganische Sulfide wegen ihres mitunter hohen Metallgehalts als Rohstoffe bei der Gewinnung u.a. von Eisen, Kupfer, Blei, Zink, Quecksilber, Arsen und Antimon dienen. Hier einige sulfidische Mineralien:
- Galenit oder Bleiglanz (PbS)
- Bornit (Buntkupferkies oder Kupfer-Lazur) (Cu5FeS4)
- Covellin (Kupfer(II)-sulfid) (CuS)
- Chalkopyrit (Chalcopyrit oder Kupferkies) (CuFeS2)
- Pyrit (Katzengold oder Narrengold) (FeS2)
- Realgar oder Rauschrot (AsS)
- Stibnit (Antimonglanz oder Grauspießglanz) (Sb2S3)
- Sphalerit oder Zinkblende (ZnS)
- Cinnabarit oder Zinnober (HgS)
Das chemische Element Schwefel bildet, analog dem in der gleichen Hauptgruppe des Periodensystems stehenden Sauerstoff, das zweifach negativ geladene Sulfid-Anion S2-.
Die Sulfide der Alkali- und Erdalkalimetalle können durch Anlagerung von Schwefel an freie Sulfidelektronenpaare auch Polysulfide bilden. Schwermetallsalze bilden mit Sulfid-Lösungen unlösliche Niederschläge - eine Eigenschaft, die man für die Analytische Chemie im Kationentrenngang nutzt.
Chemische Eigenschaften
Metallsulfide wie z. B. Eisensulfid sind als Salze der Schwefelwasserstoffsäure aufzufassen. Sulfide reagieren mit entsprechend stärkeren Säuren (wie z.B. Salzsäure) dementsprechend zu den jeweiligen Metallsalzen (bei Salzsäure eben zu Chloriden) und Schwefelwasserstoff (H2S), welcher sich durch seinen sehr unangenehmen Geruch (faule Eier) bemerkbar macht.
In wässriger Lösung wird das Sulfid-Ion S2− pH-Wert-abhängig protoniert. Im pH-Bereich von 9 - 11 liegt Sulfid hauptsächlich als Hydrogensulfid-Anion (HS−) vor. Dies wird u.a. im Kationentrenngang in der Schwefelwasserstoff- und Ammoniumsulfidgruppe eingesetzt, da die pH-Wert-abhängige Sulfidionenkonzentration eine sukzessive Fällung der unterschiedlich löslichen Sulfide ermöglicht.
Zur Schwefelwasserstoffgruppe gehören nämlich nur diejenigen Elemente, die mit dem Trennmittel schon in saurem Milieu schwerlösliche Sulfide bilden (Fällungsreaktion; Sulfid-Beispiele im Bild rechts, von links nach rechts: Niederschläge mit Mangan(II)-, Kadmium(II)-, Kupfer(II)-, Zink(II)-, Antimon(III)-, Bismut(III)-, Blei(II)- und Zinn(IV)-Kationen). Zur Ammoniumsulfidgruppe gehören die nur im basischen Milieu ausfällbaren Metallsulfide. Sie sind bei Zugabe von Säuren löslich (s.o.). Neben den Sulfiden gibt es noch die ihnen verwandten Thio- und Sulfosalze. Hier sind Sauerstoffatome gegen Schwefelatome ausgetauscht worden (Beispiel: Natriumthiostannat und -thioantimonat, Natriumthiosulfat/Fixiersalz).
Nachweis
Sulfid-Ionen (S2−) lassen sich mit Bleiacetatpapier nachweisen, wobei eine schwarze Färbung des Papiers eintritt, hervorgerufen von Bleisulfid:
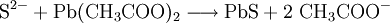
- Sulfid-Ionen reagieren mit Blei(II)-acetat zu schwarzem Blei(II)-sulfid und Acetat-Ionen.
Eine weitere Möglichkeit ist das Ansäuern einer festen Probe mit einer starken Säure. Es entsteht ein abscheulicher, charakteristischer Geruch nach faulen Eiern, hervorgerufen durch das Gas Schwefelwasserstoff, welches mit der Säure aus dem Sulfid verdrängt werden konnte.
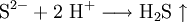
- Sulfid-Ionen reagieren mit Wasserstoff-Ionen zu dem Gas Schwefelwasserstoff (ähnlicher Geruch wie faule Eier).
Sulfidische Metallfällung
 Sulfide - hier detaillierter im Reagenzglas dargestellt - sind z.T. farbig, so dass sie abfiltriert und als Pigmente dienen können; von links nach rechts: Niederschläge aus dem Kationentrenngang von Mangan(II)-, Kadmium(II)-, Kupfer(II)-, Zink(II)-, Antimon(III)-, Bismut(III)-, Blei(II)- und Zinn(IV)-Sulfid
Sulfide - hier detaillierter im Reagenzglas dargestellt - sind z.T. farbig, so dass sie abfiltriert und als Pigmente dienen können; von links nach rechts: Niederschläge aus dem Kationentrenngang von Mangan(II)-, Kadmium(II)-, Kupfer(II)-, Zink(II)-, Antimon(III)-, Bismut(III)-, Blei(II)- und Zinn(IV)-SulfidDie chemische Fällung von Metallsulfiden spielt nicht nur bei den technischen Herstellungsprozessen eine Rolle, beispielsweise bei der Herstellung von Pigmenten, sondern auch bei Abwasserreinigungsprozessen. Dabei wird die geringe Löslichkeit der Metallsulfide genutzt, um möglichst geringe Metall-Restkonzentrationen zu erzielen. Meist sind Sulfide wesentlich geringer löslich als Hydroxide, beispielsweise: Bleisulfid, Cadmiumsulfid, Eisensulfid, Kupfersulfid, Nickelsulfid, Silbersulfid oder Zinksulfid. Als sulfidisches Fällungsmittel wird in der Regel Natriumsulfid oder Natriumhydrogensulfid verwendet.
Organische Sulfide
Viele Geruchsstoffe natürlicher Aromen sind organische Sulfide (z.B. in Kaffee). Die natürliche Aminosäure Methionin ist ein Sulfid. Zu organischen Sulfiden siehe: Thioether
Siehe auch
- Schwefel
- Sulfit (SO32-)
- Sulfat (SO42-)
- Abwasser und Abwasserpumpwerk
Literatur
- D. Weismann, M. Lohse (Hrsg.): Sulfid-Praxishandbuch der Abwassertechnik; Geruch, Gefahr, Korrosion verhindern und Kosten beherrschen! 1.Auflage, VULKAN-Verlag, Deutschland 2007, ISBN 978-3-8027-2845-7
Weblinks
Wikimedia Foundation.

