- Tandem-Massenspektrometrie
-
Die Massenspektrometrie ist ein Verfahren zum Messen des Masse-zu-Ladung-Verhältnisses m/q von Teilchen. Dazu wird die zu untersuchende Substanz in die Gasphase überführt, ionisiert und die ionisierten Teilchen durch ein elektrisches Feld beschleunigt. Dieser Teilchenstrahl wird in einem Magnetfeld abgelenkt, aus der Stärke der Ablenkung ergibt sich bei bekannter Ladung (meist 1) die Masse des Teilchens.
Anwendungen
Chemie
In der Chemie dient die Massenspektrometrie als Analyseverfahren zur Bestimmung chemischer Elemente oder Verbindungen. Für einen Analyten (die zu testende Substanz) wird die Häufigkeit, mit der geladene Moleküle (Ionen) und deren Massenfragmente auftreten, bestimmt. Die Massenspektrometrie ist eine wichtige Methode der analytischen Chemie bei der Aufklärung der Struktur und Zusammensetzung von Verbindungen und Gemischen. Der qualitative (Erkennung von unbekannten Substanzen) und quantitative (wie viel Substanz einer Verbindung ist vorhanden) Nachweis sehr kleiner Substanzmengen (ca. > 10-15 g = 1 fg (Femtogramm)) ist möglich.
Physik
In der Physik werden Massenspektrometer verwendet, um die Massen von Elementarteilchen sowie Atomkernen zu ermitteln.
Klimatologie
Das Verhältnis der Häufigkeit bestimmter Isotope in Proben von Sedimenten und Eisbohrkernen lässt Rückschlüsse auf das Klima der Vergangenheit zu. Zum Beispiel verdampft Wasser, das das Isotop O-16 enthält leichter als solches, das das Isotop O-18 enthält. Eiszeiten, bei denen große Mengen des Wassers als Eisschild dem Wasserkreislauf entzogen sind, verschieben die Häufigkeit dieser Isotope im Meer und damit auch im neu fallenden Schnee. Aus der Sauerstoff-Isotopenstufe kann auf die Menge des Inlandeises zu der Zeit geschlossen werden, als die Probe gebildet wurde.
Archäologie
Das Isotopenverhältnis von Kohlenstoff C-14 zu C-12 im organischen Material von archäologischen Funden erlaubt es die Zeit seit der pflanzlichen Bildung der vermessenen Substanz zu ermitteln. Damit können die Jahresringtabellen der Dendrochronologie kalibriert werden.
Andere Isotopenverhältnisse erlauben Rückschlüsse auf die Ernährung der Menschen, deren Knochen untersucht werden.
Biologie
Massenspektrometrie wird in der Proteomik und Metabolomik verwendet, die Verwendung entspricht weitgehend jener in der Chemie. Biologische Proben, insbesondere Proteine, verlangen jedoch aufgrund der Molekülgröße und der speziellen Fragestellung (Identität, Sequenz, chemische Modifikation) im Rahmen der Aufklärung von systemischen Zusammenhängen eine besondere Probenvorbereitung und Messmethodik.
Aufbau eines Massenspektrometers
Ein Massenspektrometer (MS) besteht aus einer Ionenquelle, einem Analysator und einem Detektor. Diese Bauteile werden im Folgenden beschrieben. In Ionenfallen-Massenspektrometern können die Ionenquelle und der Analysator zusammenfallen. Sie werden gesondert beschrieben.
Ionenquelle
In der Ionenquelle wird der Analyt ionisiert. Historisch gibt es sehr viele verschiedene Methoden. In der Praxis dominiert jedoch EI (in Kopplung mit der Gaschromatographie, Erklärung siehe weiter unten), sowie die ESI und die APCI in Kopplung mit der HPLC. Wichtig ist für die Untersuchung von Peptiden (Proteomics) auch die MALDI. Nicht ganz im klassischen Sinne sind die Ergebnisse der ICP-MS die nur quantitativen Einsatz findet.
- Gase oder verdampfbare Flüssigkeiten und Feststoffe können durch Elektronenstoßionisation (EI, Electron impact, Elektronenstoß) ionisiert werden. Es können in den gängigen Geräten Elektronen mit einer Energie von ca. 5 bis 200 eV verwendet werden (aus Stabilitätsgründen verwendet man oft 70 eV). Beim Zusammenstoß der Elektronen mit den Molekülen wird ein weiteres Elektron herausgeschlagen, es entsteht ein Radikalkation. Dieses ist meistens instabil und zerfällt in kleinere Massenfragmente, von denen eines geladen bleibt. Die Größen und Häufigkeiten der Fragmente sind bei gegebener Beschleunigungsspannung der Elektronen für eine Substanz in Datenbanken katalogisiert und können zur Identifizierung herangezogen werden.
- Bei der Chemischen Ionisation (CI) wird ein Gas zugeführt, das durch EI angeregt/ionisiert wird. Die aus dem Gas gebildeten Ionen reagieren dann mit dem Analyten und ionisieren ihn. Der Fragmentierungsgrad ist geringer als bei der Elektronen-Ionisation.
- Bei der Feldionisation (FI) wird ein Gas in einem hohen elektrischen Feld an zahlreichen Spitzen (Graphitdendriten) sehr schonend ionisiert.
- Bei der Felddesorption (FD) wird ein fester oder flüssiger Analyt, der den zahlreichen Graphitdendriten in Lösung zugeführt wird, in einem hohen elektrischen Feld wie bei FI sehr schonend ionisiert.
- Bei der Liquid Injection Field Desorption Ionization (LIFDI) wird durch den Druckunterschied zwischen Normaldruck und Vakuum ein flüssiger Analyt über eine Kapillare direkt auf den Graphitdendriten gespritzt und dort in einem hohen elektronischen Feld wie bei FI sehr schonend ionisiert. Da die Zuführung des Analyt durch eine Kapillare erfolgt ist diese Methode speziell für das analysieren von Luftempfindlichen Substanzen geeignet.
- Flüssigkeiten und Feststoffe können mit schnellen Atomen oder Ionen beschossen werden, worauf sich Ionen lösen. Kommen Atome zum Einsatz, heißt die Methode FAB (Fast Atom Bombardment, Schneller Atombeschuss), bei Ionen SIMS (Secondary Ion Mass Spectrometry, Sekundärionen-Massenspektrometrie). Neben den Sekundärionen werden auch ungeladene Teilchen (Sekundärneutralteilchen) erzeugt. Wenn diese zum Beispiel mit Laserlicht nachionisiert und dann analysiert werden, spricht man von Sekundär-Neutralteilchen-Massenspektrometrie (SNMS).
- Chemische Lösungen geladener oder polarer Substanzen werden bei der ESI (Elektrospray-Ionisation) versprüht, ionisiert und die Tröpfchen dann getrocknet, so dass Ionen des Analyten zurückbleiben. Besonders geeignet für größere Moleküle, wie z. B. Proteine. Sehr beliebt ist diese Technik auch um mittels HPLC-MS sehr selektiv und schnell quantifizieren zu können.
- Die Chemische Ionisation unter Atmosphärendruck (APCI, Atmospheric Pressure Chemical Ionization) funktioniert ähnlich wie ESI, nur dass die Lösung des Analyten vor der Ionisation verdampft wird. Die Lösemittelmoleküle werden an einer spitzen Elektrode bei Atmosphärendruck ionisiert. Die Methode ist auch für weniger polare Analyten geeignet.
- Eine weitere Form der Ionisation unter Atmosphärendruck wird durch Photonen erreicht (APPI, Atmospheric Pressure Photoionisation). Sie wird hauptsächlich an LC-Systeme gekoppelt. Der Eluent wird zunächst verdampft und anschließend durch Photonen ionisiert. Dabei werden die Photonen von einer Entladungslampe senkrecht zum Molekülstrahl ausgesandt.
- Auch mit gepulstem Laserlicht kann von einem Feststoff der Analyt abgedampft und ionisiert werden. Diese Methode heißt MALDI (Matrix-Assisted Laser Desorption/Ionization). Bei dieser Methode wird der Analyt mit einem großen Überschuss an Matrix gemischt und kokristallisiert (Einbindung des Analyten in die kristalline Matrix). Die Matrix hat die Eigenschaft bei der verwendeten Laserwellenlänge Energie zu absorbieren (zum Beispiel Stickstofflaser 337 nm). Vereinfacht gesagt kommt es mit dem Beschuss durch den Laser zum Herauslösen des intakten Analyten, an den ein von der Matrix bereitgestellter Ladungsträger, z. B. ein Proton, gebunden ist.
- Thermische Ionisation (TIMS, Thermische Ionisations Massenspektrometrie) wird in der Festkörpermassenspektrometrie eingesetzt. Dabei wird die Probe (Probenmenge je nach Stoff ng bis µg) zum Beispiel auf ein Wolframfilament aufgebracht. Durch das Filament wird ein Strom geschickt wobei es sich erhitzt und die aufgebrachte Probe verdampft, ein Teil der abgedampften Atome wird dabei ionisiert.
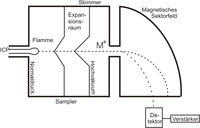
- Bei der Ionisation durch ein induktiv gekoppeltes Plasma (Inductively Coupled Plasma, ICP) werden die meisten Verbindungen in ihre Elemente aufgebrochen und es entstehen vorwiegend einfach positiv geladene Ionen. Das Verfahren wird daher vor allem zur Elementaranalyse von anorganischen Feststoffen/-wässrigen Lösungen angewandt.
- GDI: Ionisation in einem Glow Discharge Plasma
Die Ionen werden meistens mit einem elektrischen Feld aus der Ionenquelle extrahiert und in den Analysator übergeben
Analysator
Im Analysator oder Massenselektor werden die Ionen nach ihrer Masse (genauer: Masse/Ladung-Verhältnis, also m/q) getrennt. Davon gibt es mehrere Methoden, die sich teilweise erheblich in der Auflösung unterscheiden.
Die Massenauflösung bezeichnet den minimalen Massenunterschied dm, den zwei Ionen haben müssen, damit sie noch aufgelöst werden können. Die Auflösung eines Massenspektrometers wird in der Einheit Th (Thomson) angegeben, wobei aber trotzdem öfter nur das Auflösungsvermögen R angegeben wird. Dieses ist als Verhältnis einer Masse zum Massenunterschied der nächsten noch getrennt erscheinenden Masse (R = m / dm) definiert. Zum Beispiel würde man bei einem Auflösungsvermögen von 4000 die Peaks bei 4000 Th und 4001 Th noch getrennt sehen, aber ebenso die Peaks bei 2000 Th und 2000,5 Th da 2000/(2000,5 - 2000) = 4000. In der Praxis werden die beiden Begriffe Auflösung und Auflösungsvermögen leider oft nicht exakt auseinandergehalten.
Es gibt drei verschiedene Definitionen der Auflösung:
- Bei der 10 % Methode definiert man dm als die Massenabweichung bei der die Intensität eines Peaks auf 10 % des Maximums absinkt.
- Bei der 50 % Methode definiert man dm als die Massenabweichung bei der die Intensität eines Peaks auf 50 % des Maximums absinkt.
- Bei der Halbwertsbreitenmethode (FWHM (full width at half maximum height)) definiert man dm als die totale Peakbreite bei der halben Peakhöhe.
Detektor
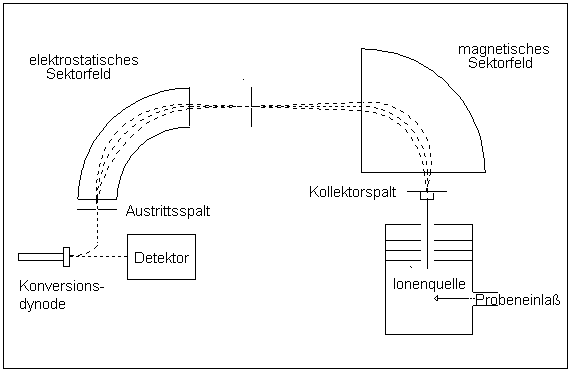
Als Detektor wird meistens ein Photomultiplier, ein Sekundärelektronenvervielfacher (SEV) oder ein Faraday-Auffänger verwendet. Der SEV wird teilweise in Kombination mit einer Konversionsdynode verwendet, bei der die Ionen aufgrund einer angelegten hohen Beschleunigungsspannung (bis zu 25 kV) auf eine Metalloberfläche prallen und der SEV dann die freiwerdenden Elektronen detektiert.
Daneben werden als Detektor auch Daly-Detektoren, Mikrokanalplatten und Channeltrons verwendet. In der Anfangszeit der Massenspektrometrie wurden auch Fotoplatten benutzt.
FT-ICR und Orbitrap Massenspektrometer messen Ströme („image-currents“), welche durch die sich bewegenden Ionenpakete in den Detektorplatten erzeugt werden. In diesem Fall werden die Ionen also nicht vom Detektor absorbiert und können deshalb mehrfach gemessen werden. Das trägt entscheidend zur hohen Messgenauigkeit dieser Instrumente bei.
Typen von Massenspektrometern
Massenspektrometer werden durch den Analysator, der eingesetzt wird, typisiert.
Sektorfeld-Massenspektrometer
In Sektorfeld-Massenspektrometern werden die Ionen in elektrischen und magnetischen Feldern abgelenkt. Der Radius der Kreisbahnen, die sie in den Feldern durchlaufen, hängt von der Energie (im elektrischen Feld) und vom Impuls (im magnetischen Feld) der Ionen ab. In Kenntnis der Ladung, der Energie und des Impulses kann dann die Masse bestimmt werden. Sektorfeld-Massenspektrometer können so gebaut werden, dass Ionen mit leicht unterschiedlicher Geschwindigkeit auf einem Punkt im Detektor abgebildet werden (Geschwindigkeitsfokussierung). Auch Ionen, deren Flugbahn leicht geneigt ist, können auf einen Punkt abgebildet werden (Richtungsfokussierung). Massenspektrometer, die beides gleichzeitig können, nennt man doppelfokussierend. Die Fokussierung ist nötig, um bei hoher Auflösung noch eine akzeptable Intensität des Messsignals zu erhalten. Sektorfeld-Massenspektrometer sind die genauesten, aber auch die teuersten Geräte. Sie erreichen eine Auflösung von bis zu R = 100.000. Daher werden sie häufig in der Stabilisotopenmassenspektrometrie verwendet.
Quadrupol-Massenspektrometer
Das Quadrupol-Massenspektrometer ist ein „Partialdruckmessgerät“ für das Hochvakuum bzw. Ultrahochvakuum. Elektronen, welche auf ca. 100 eV (typischerweise 70 eV, für EI+-Massenspektren) beschleunigt wurden, stoßen mit den Atomen/Molekülen des Probengases (in der Literatur auch als Restgas bezeichnet) zusammen und ionisieren diese dabei. Die erzeugten Ionen werden durch ein statisches, elektrisches Feld beschleunigt und durchfliegen zentral vier parallel liegende Stabelektroden, deren Schnittpunkte mit einer Ebene senkrecht zur Zylinderachse ein Quadrat bilden (Quadrupol). Im Wechselfeld zwischen den Quadrupol-Stäben findet eine m/q-Selektierung statt, so dass jeweils nur Teilchen mit einer definierten Masse das Feld durchlaufen können. Die Ionen treffen in einem Detektor mit Messverstärker auf, der den Ionenstrom misst und von der Software des angeschlossenen PCs zur Zählrate bzw. zum Partialdruck umgerechnet wird. Die Ionisationseinheiten, Quadrupole und Detektoren sind in unterschiedlichsten Varianten für unterschiedliche Anwendungen erhältlich. Es ist in teuren, hochauflösenden aber auch günstigen Varianten (als Restgasanalysator) zu erhalten und hat dadurch eine hohe Verbreitung im F&E-Bereich.
Massen-Selektierung im Quadrupol-Feld
Die gegenüberliegenden Elektroden des Quadrupol befinden sich auf gleichem Potential und zwischen benachbarten Elektroden wird eine Spannung mit einem Gleich- und einem hochfrequenten Wechselspannungs-Anteil angelegt, d. h.
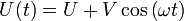 . Die Bahn der Ionen im QMS wird durch die Differentialgleichungen von Mathieu beschrieben. Aus systematischen Untersuchungen dieser Differentialgleichungen ist bekannt, dass es gewisse stabile und instabile Bereiche gibt. Die Arbeitsgerade, d. h. die Gerade auf der alle beobachtbaren Massen liegen, wird durch das Verhältnis
. Die Bahn der Ionen im QMS wird durch die Differentialgleichungen von Mathieu beschrieben. Aus systematischen Untersuchungen dieser Differentialgleichungen ist bekannt, dass es gewisse stabile und instabile Bereiche gibt. Die Arbeitsgerade, d. h. die Gerade auf der alle beobachtbaren Massen liegen, wird durch das Verhältnis  bestimmt. Um ein möglichst gutes Auflösungsvermögen (in der Praxis R = 1.000 bis 4.000) zu erreichen, muss
bestimmt. Um ein möglichst gutes Auflösungsvermögen (in der Praxis R = 1.000 bis 4.000) zu erreichen, muss 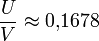 gelten. Der Schnitt aus Arbeitsgeraden und stabilem Bereich der Mathieuschen Differentialgleichungen ist dann sehr klein. Der Wert 0,1678 darf aber auf keinen Fall überschritten werden, ansonsten sind alle Ionen instabil. Instabile Ionen kollidieren während des Durchlaufes mit einem der vier Stäbe.
gelten. Der Schnitt aus Arbeitsgeraden und stabilem Bereich der Mathieuschen Differentialgleichungen ist dann sehr klein. Der Wert 0,1678 darf aber auf keinen Fall überschritten werden, ansonsten sind alle Ionen instabil. Instabile Ionen kollidieren während des Durchlaufes mit einem der vier Stäbe.Über die Einstellung der Frequenz ω oder Spannungen U,V lässt sich festlegen, welche Teilchen mit welchem Masse/Ladungs-Verhältnis den Detektor über die zentrale Flugbahn erreichen. Die Bahn eines Teilchens mit richtigem m/e-Verhältnis ist sinus-förmig mit gleichbleibenden Abständen zur Mittelbahn des Quadrupols. Alle anderen Ionen fliegen zwar auch im Sinustakt durch das Wechselfeld um diesen Sollbahnbereich, werden aber immer weit herausbeschleunigt, so dass sie irgendwann seitlich außerhalb des Quadrupols hinausschießen und den Einflussbereich des EM-Feldes verlassen.
Da die Ionisierung durch Elektronenstoß erfolgt, treten bei fast allen Atome/Moleküle statt einem Peak bei der entsprechenden Masse des Atomes/Moleküles mehrere Peaks im Massenspektrum auf. Dies hat verschiedene Ursachen:
- Die Moleküle können bei der Kollision mit den Elektronen in verschiedene Bestandteile zerbrechen (Fragmentierung). So ruft z. B. Ethanol (C2H5OH) (Masse 46,07 g/mol) einen schwachen Peak bei 46 Th (C2H5OH) hervor, einen stärkeren Peak bei 45 Th (ein Wasserstoff-Atom fehlt) und den stärksten Peak (ca. 10-mal höher als die anderen Peaks) bei 31 Th (CH2OH). Weitere Peaks sind u. a. 17 Th (OH).
- Eine teilweise Rekombination oder Neubildung von Molekülen ist zwar sehr viel seltener. Es ist aber wegen der hohen Genauigkeit des QMS nicht auszuschließen, dass entsprechende Zählraten auftreten können
- Die Bruchstücke der Moleküle bzw. Atome können zweifach oder sogar dreifach ionisiert werden. Da das QMS – wie andere Massenspektrometer – prinzipbedingt nur den m/q-Wert misst, ergeben sich folglich mehrere Peaks, z. B. Argon bei 40 Th und bei 20 Th.
Eine neue, deutlich verbesserte Variante des QMS arbeitet mit der sanften Ionisation - eine Methode die allerdings auch mit einem erheblich höheren technischen Aufwand verbunden ist. Hierbei werden verschiedene Ionengase (z. B. Xe, Ar, Hg) mit geringer Ionisationsenergie (10-14 eV) zur Ionisation der Probengase verwendet statt des direkten Beschusses mit den hochenergetischeren Elektronen (i.d.R. 70-105 eV). Das Ionengas wird zwar auch mittels Elektronenbeschusses erzeugt, aber durch eine Auswahl über Vorfelder erreichen nur einfach ionisierte Atome des Ionengases das zu ionisierende Probengas. Die stark störende Fragmentierung (mehrere Peaks im Spektrum) der Moleküle im Probengas wird dadurch nahezu ganz unterbunden. Da sich zudem unterschiedliche Gase mit gleicher Massenzahl von den Ionisierungsgasen verschieden ionisieren lassen, ist eine Differenzierung dieser massenidenten Teilchen durch analytische Vergleiche möglich.
Flugzeit-Massenspektrometer (TOFMS)
Im Flugzeit-Massenspektrometer (englisch TOFMS: „time-of-flight mass spectrometer“) wird ausgenutzt, dass die Ionen beim Eintritt in den Analysator alle die gleiche Energie haben und leichte Ionen deshalb schneller sind als schwere. Die Auflösung beträgt bis zu R = 15.000 (10 % Methode). Daher erreichen leichte Ionen den Detektor eher als schwere Ionen. In der Praxis haben sich Geräte mit Ionenspiegeln bewährt, bei denen die Flugstrecke durch ein zusätzliches elektrisches Feld am Ende der ursprünglichen Flugrichtung verdoppelt wird. Zusätzlich erreicht man durch diese Technik eine weitere Fokussierung, die die Varianz in der Geschwindigkeit der Ionen aufgrund des Doppler-Effekts minimiert.
TOFMS eignet sich besonders gut im Verbund mit GCxGC, weil damit sehr schnell Massenspektren über einen großen m/q-Bereich aufgenommen werden können. GCxGC-TOFMS bezeichnet ein zweidimensionales chemisch-analytisches Trennverfahren mit massenspektrometrischer Detektion (siehe auch Multidimensionale Chromatographie), genauer, zweidimensionale Gaschromatographie gekoppelt mit einer Flugzeit-Massenspektrometrie (engl.: Comprehensive Two-Dimensional Gas Chromatography Coupled To Time-Of-Flight Mass Spectrometry). Dieses Verfahren erlaubt eine genaue Auftrennung und Detektion verschiedener Verbindungsklassen aus komplexen Matrices (z. B. Erdölproben). Dafür werden zwei GC-Säulen mit unterschiedlicher Polarität über einen Modulator miteinander gekoppelt.
Ionenfallen-Massenspektrometer
In Ionenfallen-Massenspektrometern werden die Ionen durch elektromagnetische Felder in einem definierten Bereich gehalten und können so analysiert und manipuliert werden. In Ionenfallen-Massenspektrometern ist eine mehrfache Wiederholung von Anregung und Massenselektion möglich, ohne dass ein weiteres Bauteil benötigt wird.
Folgende Typen von Ionenfallen-Massenspektrometer existieren:
- Quadrupol Ionenfalle
- Linear Trap
- FT-ICR-MS
- Orbitrap
Quadrupol-Ionenfalle
Die Paul-Falle, ein Quadrupol Ion-Trap (auch 3D-Quadrupole Ion trap genannt), ist eine Ionenfalle, in der ein elektrisches Quadrupolfeld herrscht. Das Feld wird durch drei rotationssymmetrische Elektroden erzeugt: zwei Endkappenelektroden und eine mittlere Ringelektrode. Zwischen der Ringelektrode und den Endkappenelektroden liegt eine Überlagerung einer Gleich- und einer Wechselspannung an. Während einer Analyse wird die Amplitude des Wechselspannungsanteils erhöht. Je nach Ionenmasse werden die Ionen bei Erreichen unterschiedlicher Amplituden aus der Ionenfalle geschleudert und gelangen zum Detektor. Die erreichbare Auflösung ist etwa so groß wie die von Quadrupol-Massenpektrometern. Ionenfallen-Massenspektrometer werden im Gegensatz zu den vorher genannten Spektrometertypen nicht kontinuierlich betrieben, das heißt Ionisation und Analyse laufen nacheinander und nicht parallel ab.
Linear Trap
Statt in einem 3D-Quadrupolfeld werden die Ionen in einem 2D-Quadrupolfeld gehalten. Ein zusätzliches Randfeld wird angelegt, um die Ionen in der Trap zu halten. Das 2D-Quadrupolfeld erhöht gegenüber einem 3D-Quadrupolfeld die Speicherkapazität der Ionenfalle und damit auch die Nachweisempfindlichkeit des Massenspektrometers. Diese erhöhte Nachweisempfindlichkeit geht mit erhöhter Datenrate und chromatographischer Auflösung einher. Moderne chromatographische Verfahren wie Rapid Resolution HPLC oder Nano-HPLC, die mit hoher chromatographischer Auflösung arbeiten, bedienen sich daher mehr der 2D Ionenfallen (Thermo Fisher Scientific LXQ, LTQ), z. B. Nachweis von Proteinen.
Fouriertransformations-Ionenzyklotronresonanz-Massenspektrometrie
Bei der FT-ICR-MS (Fouriertransformations-Ionencyclotronresonanz-Massenspektrometrie) herrscht in der Ionenfalle ein homogenes Magnetfeld, das die Ionen auf Kreisbahnen mit einer massenabhängigen Umlauffrequenz zwingt. Die Ionen werden zunächst mit einem Anregungsimpuls in Phase gebracht. Durch Anlegen eines elektrischen Wechselfeldes senkrecht zum Magnetfeld kann eine Cyclotron-Resonanz erzeugt werden. Stimmen nämlich Frequenz des eingestrahlten Wechselfeldes und Cyclotron-Kreisfrequenz der Ionenmasse überein, so tritt der Resonanzfall ein und der Cyclotronradius des betreffenden Ions vergrößert sich durch Aufnahme von Energie aus dem Wechselfeld. Diese Änderungen des Cyclotronradius führen zu messbaren Signalen an den Detektorplatten des Massenspektrometers. Um Ionen mit unterschiedlicher Masse zu erfassen, wird das eingestrahlte Wechselfeld variiert und das gemessene Signal fouriertransformiert. FT-ICR-MS-Geräte erreichen Massenauflösungen, die auch hochauflösende Sektorfeld-Massenspektrometer vor allem bei höheren Massen bis um das hundertfache übertreffen. Die Auflösung des FT-ICR MS steigt mit der Kraft und auch der Homogenität des Magnetfeldes. Die eingesetzten Feldstärken liegen bei kommerziellen Geräten bei bis zu 15 Tesla. Dies ist nur durch den Einsatz supraleitender Magnete zu erreichen. Die Auflösung ist sehr hoch und kann bis zu R = 2.000.000 betragen.
Orbitrap
Die jüngste Entwicklung der Ionenfallen-Massenspektrometer ist die Orbitrap. In der Ionenfalle befindet sich eine zentrale, spindelförmige Elektrode. Die Ionen werden radial zu dieser Elektrode in die Orbitrap hineingeschossen und bewegen sich aufgrund der elektrostatischen Anziehung auf Kreisbahnen (Orbits) um die zentrale Elektrode herum. Da die Ionen nicht in der Mitte der Kammer, sondern dezentral injiziert werden, schwingen sie gleichzeitig entlang der Achse der Zentralelektrode. Die Frequenz dieser Schwingung erzeugt in Detektorplatten Signale, die durch Fouriertransformation in die entsprechenden m/q Verhältnisse umgewandelt werden. Das Prinzip ist daher ähnlich zum FT-ICR-MS (siehe oben), funktioniert aber mit einem elektrostatischen Feld statt einem Magnetfeld. Orbitraps kommen daher ohne die aufwendige Kühlung mit flüssigem Helium aus. Die Massenauflösung von Orbitraps ist nur unwesentlich schlechter als die von einem FT-ICR Gerät mit einem 7-Tesla-Magneten.
MS/MS (auch Tandem-Massenspektrometrie)
Um Fragmentierungen zu studieren oder auch um die Selektivität und Sensitivität (Nachweisgrenze) einer Quantifizierungsmethode entscheidend zu verbessern, koppelt man entweder mehrere Analysatoren hintereinander oder arbeitet in Ionentraps. Zwischen zwei Analysatoren wird eine sogenannte Kollisionszelle eingebaut um den Ionen durch Stöße mit einem Inertgas (N2 oder Ar) Energie zuzuführen. Daraufhin zerfallen die Ionen sehr spezifisch zu anderen (leichteren) Ionen.
Viele Kombinationen der Analysatoren sind denkbar. Die gängigsten sind Triplequads, QqTOF (Quadropol-Quadrupol-TOF), TOF-TOF, und inzwischen auch TRAP-FTICR und TRAP-Orbitrap.
Am weitesten verbreitet sind sogenannte Tripelquads (QqQ). Dabei wird meist durch ESI ein Pseudomolekülion produziert, im ersten Analysatorquadrupol isoliert und dann im zweiten Quadrupol - der sogenannten Kollisionszelle oder Stoßkammer - angeregt.
In die Stoßkammer kann ein Stoßgas eingespeist werden. Dabei wird der Druck so gewählt, dass im Mittel ein erzeugtes Ion maximal einmal mit einem Gasmolekül kollidiert. Diese Methode ermöglicht es, erzeugte Ionen weiter zu fragmentieren.
Im dritten Quadrupol hat man dann die Möglichkeit zu „scannen“, also alle Produktionen des im ersten Quadrupol isolierten Ions (Parent) zu ermitteln, oder selektiv nur ein bekanntes Fragmention zu beobachten. Scannt man, ermittelt man die „Spektralinformation“ und kann Rückschlüsse auf die Struktur ziehen. Beobachtet man hingegen nur ein oder zwei Fragmentionen, so kann man sehr empfindlich und selektiv quantifizieren. Man spricht dann von MRM (MultipleReactionMonitoring).
Der Vollständigkeit halber sei erwähnt, dass es auch andere Techniken für MS/MS (und sog. MSn) gibt. In Iontraps kann man ein Ion isolieren, und ihm dann entweder durch Kollision (hier aber meist mit He) oder auch durch Strahlung Energie zuführen. Gerade in FT-ICR Geräten verwendet man dazu Infrarotlaser (IRMPD) oder „Elektronenkanonen“ (Electron Capture Dissociation). Eine weitere Methode ist die Electron Transfer Dissociation (ETD), die gerade im Bereich der Proteinidentifikation erste Einsatzmöglichkeiten erfährt.
Kopplung mit Chromatographieverfahren
Bei sehr komplexen Proben ist es nützlich, diese mit einem vorgelegten Trennverfahren aufzutrennen, bevor man sie dem Massenspektrometer zuführt. Man spricht dann von hyphenated separation. In diesem Sinn wird Massenspektrometrie oft zusammen mit Gas- oder Flüssigkeits-Chromatographen betrieben. Diese Kopplungen sind bekannt unter den Kürzeln GC/MS (Gas Chromatography/Mass Spectrometry); LC/MS (Liquid Chromatography/Mass Spectrometry). Weniger weit verbreitet sind CE/MS (Kopplung mit Capilary Electrophoresis) und IMS/MS (Kopplung mit Ionenmobilitäts-Spektrometrie). Manchmal werden sogar drei Trenntechniken gekoppelt, so z. B. bei GCxGC-MS.
Auswertung der Massenspektren
Voraussetzung für die Bestimmung der Masse m ist die Kenntnis der Ladung q des Ions, denn die Analysatoren können die Ionen nur nach dem Verhältnis m/q trennen. q ist jedoch immer ein ganzzahliges Vielfaches der Elementarladung e: q = z·e, und meistens ist z = +1 (einfach positiv geladen). Als Einheit von m/q wurde das Thomson Th vorgeschlagen: [m/q] = Th.
Zunächst muss die Masse des Analyten bestimmt werden. Normalerweise ist das die Masse des schwersten detektierten Ions (Molekülpeak oder Molekülion). Allerdings ist bei der Elektronen-Ionisation oft ein Großteil der Moleküle gespalten. Testweise kann die Elektronenenergie verringert werden, so dass weniger Moleküle gespalten werden und der Molekülpeak deutlicher sichtbar wird.
Die weitere Auswertung basiert darauf, dass die Atome der verschiedenen chemischen Elemente einen unterschiedlichen Massendefekt haben. Daher kann aus einer sehr exakt bestimmten Masse eine Liste möglicher Summenformeln angegeben werden. Bei leichten Molekülen gibt es nur eine oder wenige passende Elementarzusammensetzungen. Mit steigender Masse oder zunehmender Anzahl an Heteroatomen steigt auch die Anzahl möglicher Kombinationen stark an.
Bei schwereren Molekülen stehen jedoch oft sehr viele mögliche Summenformeln zur Auswahl. Weitere Hinweise liefern die Isotopenzusammensetzungen der verschiedenen Elemente. So besteht der Kohlenstoff zum Beispiel zu 98,9 % aus 12C und zu 1,1 % aus 13C. Je nachdem, wie viele C-Atome im Molekül vorhanden sind, sind neben dem Hauptsignal im Spektrum Nebensignale zu finden, die vom Hauptpeak um 1 Th, 2 Th etc. entfernt sind und ein charakteristisches Intensitätsverhältnis zum Hauptsignal haben. Halogene wie Chlor und Brom haben ebenfalls charakteristische Isotopenverhältnisse, die zur Identifizierung benutzt werden können.
Die genannten Methoden sind auch auf die Bruchstücke anwendbar. Moleküle brechen oft an charakteristischen Stellen. Aus der Masse der Bruchstücke und evtl. weiteren Informationen kann schließlich die Strukturformel bestimmt werden.

Grafik: Beispiel eines Massenspektrums: Tetrachlordibenzofuran EI-positiv ionisiertDabei helfen vor allem bei mit positiver EI-Ionisierung erstellten Massenspektren auch Massenspektrenbibliotheken. Die bekanntesten sind unter den Kürzeln ihrer Vertreiber die Wiley- und die NIST-Massenspektrenbibliotheken.
Die Quantifizierung von Verbindungen wird bei der Massenspektrometrie dadurch erleichtert, dass bei der Analytik isotopenmarkierte (13C-gelabelte oder deuterierte) interne Standards verwendet werden können.
Ein Problem bei der Datenauswertung stellen die proprietären Datenformate der einzelnen Gerätehersteller dar. Die Daten werden in eigenen Binärdatenformaten vorgehalten. Meist werden vom jeweiligen Hersteller in die eigene Steuerungs- und Managementsoftware integrierte Auswertungsprogramme mitgeliefert. Um Programme von Dritten zu benutzen, bedarf es oft der Datenkonvertierung zum Datenexport, für die es im Bereich der Forschung frei erhältliche Lösungen gibt.
Literatur
- Herbert Budzikiewicz und Mathias Schäfer: Massenspektrometrie – Eine Einführung. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-30822-4
- Hans-Joachim Hübschmann: Handbuch der GC/MS, Grundlagen und Anwendung, VCH Verlagsgesellschaft mbH, Weinheim 1996, ISBN 3-527-28604-7
- Fred W. McLafferty und Frantisek Turecek (Deutsche Übersetzung): Interpretation von Massenspektren, 4. Ed., Spektrum Akademischer Verlag GmbH, Heidelberg 1995, ISBN 0-935702-25-3
- Andreas M. Boehm et al.: Command Line Tool for Calculating Theoretical MS Spectra for Given Sequences, Bioinformatics, 2004. 20(16): 2889-2891. DOI 10.1093/bioinformatics/bth328
Siehe auch
Weblinks
- http://www.physiksimulation.de/massenspektrograph.php (Simulationen versch. Massenspektrographen)
- Massenspektrometrie – eine umfassende Darstellung der Theorie und der Technik
- Massenspektrometrie (en)
- Probenpräparation für Proteinidentifizierung mittels Nano-LC-MS
- MS-Anwendungsbeispiele in der Proteinanalytik
- http://www.protein-ms.de (Protein-Massenspektrometrie sowie einige Tools zur Massenspektrometrie)
Wikimedia Foundation.