- Vanadium(II)-chlorid
-
Kristallstruktur 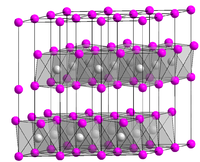
__ V2+ __ Cl- Allgemeines Name Vanadium(II)-chlorid Andere Namen - Vanadiumdichlorid
- Dichlorvanadium
- Vanadin(II)-chlorid
- Vanadindichlorid
Verhältnisformel VCl2 CAS-Nummer 10580-52-6 PubChem 66355 Kurzbeschreibung gelblicher Feststoff[1]
Eigenschaften Molare Masse 121,85 g·mol−1 Aggregatzustand fest
Dichte 3,23 g·cm−3[1]
Schmelzpunkt Siedepunkt ab 910 °C Sublimation[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Gefahr
H- und P-Sätze H: 302-314 EUH: keine EUH-Sätze P: 280-305+351+338-310 [2] EU-Gefahrstoffkennzeichnung [2] 
Ätzend (C) R- und S-Sätze R: 20/21/22-34 S: 26-27-36/37/39-45 LD50 540 mg·kg−1 (Ratte, peroral)[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Vanadium(II)-chlorid ist eine anorganische chemische Verbindung aus der Gruppe der Chloride. Es ist ein hellgelber Feststoff, der ab 910 °C sublimiert.
Inhaltsverzeichnis
Geschichte
Durch Reduktion von Vanadium(II)-chlorid mit Wasserstoff konnte von Henry Enfield Roscoe 1867 erstmals metallisches Vanadium hergestellt werden.
Gewinnung und Darstellung
Vanadium(II)-chlorid kann durch Reduktion von Vanadium(III)-chlorid durch Erhitzung (~675 °C) im Beisein von Wasserstoff gewonnen werden.
Auch die Disproportionierung von Vanadium(III)-chlorid in Stickstoff
oder die direkte Reaktion von Vanadium mit Chlor sind möglich.
Eigenschaften
Vanadium(II)-chlorid ist ein starkes Reduktionsmittel mit welchem die Reduktion von Sulfoxiden zu Sulfiden, organische Aziden zu Aminen, sowie die reduktive Kopplung einiger Alkylhalogenide möglich ist. Bei Lösung in Wasser bildet sich das [V(H2O)6]2+ Ion.
Vanadium(II)-chlorid besitzt eine oktaedrische Kristallstruktur, ähnlich der von Cadmiumiodid.
Einzelnachweise
- ↑ a b c d Webelements: Vanadiumdichloride
- ↑ a b c d Datenblatt Vanadium(II) chloride bei Sigma-Aldrich, abgerufen am 25. April 2011.
VanadiumhalogenideOxidationsstufe (II): Vanadium(II)-fluorid | Vanadium(II)-chlorid | Vanadium(II)-bromid | Vanadium(II)-iodid
Oxidationsstufe (III): Vanadium(III)-fluorid | Vanadium(III)-chlorid | Vanadium(III)-bromid | Vanadium(III)-iodid
Andere Oxidationsstufen: Vanadium(IV)-fluorid | Vanadium(IV)-chlorid | Vanadium(IV)-bromid | Vanadium(V)-fluorid
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Vanadium(III)-chlorid — Kristallstruktur V3+ … Deutsch Wikipedia
Vanadium(IV)-chlorid — Strukturformel Allgemeines Name Vanadium(IV) chlorid Andere Namen … Deutsch Wikipedia
Vanadium(III)-bromid — Kristallstruktur V3+ … Deutsch Wikipedia
Vanadium(III)-fluorid — Kristallstruktur Allgemeines Name Vanadium(III) fluorid … Deutsch Wikipedia
Vanadium(IV)-fluorid — Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Vanadium(IV) fluorid Andere Namen Vanadiumtetrafluorid Vanadin(IV) fluorid Vanadintetrafluorid … Deutsch Wikipedia
Vanadium — Eigenschaften … Deutsch Wikipedia
Vanadium(III)-iodid — Kristallstruktur V3+ … Deutsch Wikipedia
Vanadium(V)-fluorid — Kristallstruktur V5+: F … Deutsch Wikipedia
Vanadium(II)-bromid — Kristallstruktur V2+ … Deutsch Wikipedia
Vanadium(II)-fluorid — Kristallstruktur V2+ … Deutsch Wikipedia



