- Verbrennung (Chemie)
-
Eine Verbrennung ist eine Redoxreaktion, die unter Abgabe von Energie in Form von Wärme und Licht abläuft, also exotherm.
Im allgemeinen Sprachgebrauch versteht man unter Verbrennung die Oxidation eines brennbaren Materials mit Sauerstoff unter Flammenbildung als „Feuer“. Verbrennungen gibt es aber auch bei Reaktionen ohne Sauerstoff, dazu gehört die Reaktion von Fluor und Wasserstoff zu Fluorwasserstoff; hier ersetzt das Fluor den Sauerstoff als Oxidationsmittel.
Inhaltsverzeichnis
Begriffe, Einteilung
Brennchemie
- Verbrennung in Form eines Feuers mit Flammenerscheinung aus glühenden flüchtigen Stoffen. Brennen feste Stoffe mit Flamme, so wird diese durch verbrennende gasförmige Pyrolyseprodukte gebildet
- Verbrennung in Form von Glut verläuft ohne glühende flüchtige Stoffe.
- Als unvollständige Verbrennung bezeichnet man eine Verbrennung, bei der nicht alle möglichen Bindungen zum Oxidationsmittel entstehen. Hierher gehören die Verbrennung von Kohlenstoff zu Kohlenmonoxid oder die Herstellung von Grillkohle, Schwelbrand, Verkoken.
- Langsame kalte Oxidation lässt sich beim Verrosten von Metallen oder in Lebewesen bei der Oxidation von Nährstoffen, also deren „Verbrennung“ feststellen.
Brennphysik
Verbrennungen, bei der vorgemischte Systeme mit einer hohen Verbrennungsgeschwindigkeit, nahezu schlagartig und mit enormer Volumenzunahme (der gasförmigen Bestandteile) reagieren, bezeichnet man als Explosionen. Diese werden unter Berücksichtigung der Verbrennungs- und Ausbreitungsgeschwindigkeit unterteilt.
Nutz- und Schadfeuer
Die Verbrennung in einem Feuer kann kontrolliert (Nutzfeuer), zum Beispiel in einem Ofen, einem Dampfkessel (Feuerung), als Lagerfeuer, oder unkontrolliert als Schadfeuer bei einem Brand erfolgen.
Brandlehre, Brandklassen
Verlauf
Bei der Verbrennung reagiert eine Substanz, der Brennstoff, chemisch mit Sauerstoff oder mit einem anderen Gas. Der Brennstoff selbst kann fest (beispielsweise Holz, Kohle), flüssig (Benzin, Alkohol), flüssig werdend (Wachs) oder gasförmig (Methangas, Erdgas) sein. Letztlich beginnt vor der eigentlichen Verbrennung ein verdampfen oder cracken, sodass die entstandenen Gase mit dem Luftsauerstoff reagieren.
Voraussetzungen für eine Verbrennung
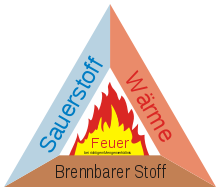
Für eine Verbrennung ist in ausreichender Menge brennbares Material nötig, das mit dem Oxidationsmittel reagiert, meist ist dies der Sauerstoff (siehe Sauerstoffindex). Darüber hinaus ist das richtige Mengenverhältnis des brennbaren Stoffes mit der Umgebungsluft oder dem reaktiven Gas und eine geeignete Zündquelle nötig. Ein Katalysator kann die Aktivierungsenergie, die für den Start der chemischen Reaktion erforderlich ist, herabsetzen. Dadurch kann die Verbrennung beschleunigt oder die zur Zündung notwendige Energie herabgesetzt werden.
Zünden
Die Einleitung des Brennvorgangs, das Zünden (Zuführen der Aktivierungsenergie), wird unterschiedlich bezeichnet. Während allgemein Verbrennungen entzündet werden, können insbesondere Feuer und Deflagrationen angezündet, Detonationen können gezündet werden (Zünder). Dämpfe und Gase entflammen.
Anbrennvorgang und Vollbrand
Sobald eine kleine Brennstoffmenge reagiert hat, bringt die dabei freigesetzte Wärme als Aktivierungsenergie weiteren Brennstoff zum Reagieren, Verbrennung ist in diesem Sinne eine thermische Kettenreaktion. Das bei der Verbrennung freigesetzte Licht stammt aus den glühenden Masseteilchen. Außerdem erhöht sich typischerweise die Temperatur sehr stark, was zur Heizung oder Verrichtung von Arbeit genutzt werden kann.
Zurzeit werden in Anlagen zur Wärmeerzeugung meist Kohlenwasserstoffe mit dem Sauerstoff der Luft zur Reaktion gebracht. Es entsteht dabei Abgas, das neben Luftstickstoff hauptsächlich Kohlenstoffdioxid (CO2) und Wasser (H2O) enthält. Je nach Art der Verbrennungsführung können verschiedene weitere Stoffe im Abgas enthalten sein, häufigste Anteile sind Kohlenmonoxid (CO), Stickoxide (NOx) und unverbrannte Kohlenwasserstoffe. Bei fetter Verbrennung (Kraftstoffüberschuss) von Kohlenwasserstoffen kann Ruß entstehen.
Chemie der Verbrennung
Luftzahl
Für die Verbrennung an Luft wird die sogenannte Luftzahl benötigt. Diese ist ein Verhältniswert aus den Anteilen der Umgebungsluft, hauptsächlich also Sauerstoff und Stickstoff:

Sauerstoffbedarf
Bezogen auf 1 mol Brennstoff erhält man den zur vollständigen Verbrennung erforderlichen Anteil Sauerstoff νO2 über:


Löst man obige Gleichung nach νO2 auf, so erhält man:
 beziehungsweise
beziehungsweise , wobei die Kleinbuchstaben die Anzahl der im Brandstoff enthaltenen Elemente angeben.
, wobei die Kleinbuchstaben die Anzahl der im Brandstoff enthaltenen Elemente angeben.Stöchiometrische Konzentrationen
Die für die vollständige Verbrennung rechnerisch nötige Konzentration von Brennstoff erhält man über
![\mathrm {c_{stoech}={100 \over 1+(1+3{,}76)\times\nu_{O 2}}\,[Vol%]}](e/92eed2bded45e0c9663be975eae37d06.png)
beziehungsweise
![\mathrm {c_{stoech}={Vol% \times M\times10^{-2} \over (0{,}02405)}}\,[g/m^3]](6/066a07f9744068e55cf1ba677bba9c9e.png)
Beispiel
Als Beispiel sei hier die vollständige Verbrennung von Propanol (C3H8O) genannt:


Somit sind zur vollständigen Verbrennung von 1 mol Propanol 4,5 mol Sauerstoff nötig. Weiterhin lässt sich die stöchiometrische Konzentration, die für die Verbrennung nötig ist, berechnen:
beziehungsweise
 Demonstration der Notwendigkeit der Luftzufuhr für eine kontinuierliche Verbrennung
Demonstration der Notwendigkeit der Luftzufuhr für eine kontinuierliche Verbrennung
Verbrennungsrechnung und Abgaszusammensetzung
Verbrennungsrechnungen mit den entsprechenden Abgaszusammensetzungen sind mit einem Rechenalgorithmus nach Werner Boie für den Anwendungsbereich Wärmetechnik besonders effizient möglich.[1]
Physik der Verbrennung
Verbrennungsgeschwindigkeit
Beim brennbaren Material kann es nur zur Oxidation kommen, wenn ein einzelnes Atom oder Molekül des Brennstoffs mit Sauerstoff in direkten Kontakt kommt. Daher sind für die Verbrennungsgeschwindigkeit (Abbrandgeschwindigkeit) die Verfügbarkeit von Sauerstoff und sein inniger Kontakt mit dem Brennmaterial maßgeblich. Einige Löschverfahren beruhen darauf, die Sauerstoffzufuhr zu unterbrechen (Löschdecke, Schaum, CO2-Löschanlage).
Die Versorgung mit Sauerstoff kann man durch stete Zufuhr von Frischluft erreichen, indem man in ein Holzfeuer bläst. Für Holzfeuer ist der Kamin dabei ein ideales Hilfsmittel. In dem sich verengenden Kaminrohr steigen die erwärmten Abgase schnell auf und erzeugen einen steten Unterdruck um das Feuer. Dieser saugt permanent frische Luft heran. Eine extreme Ausprägung sind Feuersturm und Waldbrände, die durch Winde, wie den Mistral, angefacht werden.
Um innigen Kontakt herzustellen, kann die Oberfläche des Brennstoffs vergrößert werden, das Vergasen des Brennstoffs in ein Gas ist eine geeignete Möglichkeit. Bei der Kerze schmilzt das Wachs am Boden des Dochts, steigt als Flüssigkeit auf und verdampft an der heißen Spitze. Das verdampfte Wachs verbrennt. Ein anschauliches Beispiel ist die Mehlstaubexplosion. Wird etwas Mehl in eine Kerzenflamme geblasen, wird das ansonsten unbrennbare Mehl durch die Zerstäubung brennbar und reagiert heftig. Beim Ottomotor erfolgt im Vergaser eine Verdampfung und im Dieselmotor wird der Brennstoff zerstäubt. Flüssiger Dieselkraftstoff lässt sich bei Raumtemperatur kaum entflammen. Durch die Einspritzanlage und eine schlagartige Verdichtung mit der daraus resultierenden Erhitzung im Verbrennungsraum zündet Diesel selbst und verbrennt.
Über allen Flüssigkeiten steht in Abhängigkeit von der Stoffeigenschaft spezifischer Dampfdruck und den Umgebungsfaktoren Druck und Temperatur eine Dampfwolke. Handelt es sich um eine brennbare Flüssigkeit ist diese Dampfschicht in einem bestimmten Bereich (zwischen unterer und oberer Explosionsgrenze) entzündlich. Die kurzkettigen Kohlenwasserstoffe, das Benzin, haben einen niedrigen spezifischen Dampfdruck, sind leicht flüchtig, bilden also schon bei niedrigen Temperaturen eine brennbare Dampfschicht über der Oberfläche aus. Der längerkettige Diesel zündet schwerer, da der Dampfdruck geringer ist.
In einigen chemischen Verbindungen sind das „Oxidationsmittel“ (Sauerstoff) und das zu oxidierende „Material“ in demselben Molekül enthalten, so in vielen Sprengstoffen. Nitroglyzerin mit der Summenformel C3H5N3O9 enthält pro Molekül neun Sauerstoffatome (in drei Nitrat- und Salpetersäureester-Gruppen) und damit mehr als genug, um die im Molekül enthaltenen Kohlen- und Wasserstoffatome vollständig zu Kohlendioxid und Wasser zu oxidieren. Die Verbindung ist instabil und zerfällt explosionsartig schon bei leichten Erschütterungen. Die gasförmigen Oxidationsprodukte nehmen ein Vielfaches des ursprünglichen Volumens ein und erzeugen einen sehr hohen Druck, der die Sprengwirkung verursacht. Auch in den Treibmitteln von Raketentriebwerken ist Sauerstoff in verschiedenen Trägersubstanzen als Oxidationsmittel vorhanden, da dies im Vakuum des Weltalls erforderlich ist.
Materialkunde
Verbrennung von Holz und anderen organischen Feststoffen
Die Verbrennung von Holz beginnt mit einer Erhitzung von außen. Bei nassem Holz unterbricht die Temperaturerhöhung bei etwa 100 °C, je nach Siedepunktserhöhung durch gelöste Stoffe. Ist das Wasser weitestgehend verdampft steigt die Temperatur und die Verbrennung beginnt. Holz kann ungefähr das eigene Gewicht an Wasser speichern und für den Verdampfungsvorgang ist die latente Wärme nötig, so ist feuchtes oder nasses Holz kaum zu entzünden. Trockenes Holz zündet leichter und beginnt ab etwa 150 °C zu verkohlen. Dies ist eine Pyrolyse des Holzes durch hitzebedingte chemische Zersetzung, zum Teil entstehen gasförmige Stoffe, die als Flamme aus dem Holz austreten. Verbleibende Holzkohle als Gemisch aus Kohlenstoff und Asche verglüht anschließend mit weiterem zutretenden Sauerstoff.
Siehe auch
Literatur
- J. Warnatz, U. Maas, R. W. Dibble: Verbrennung. Springer, Berlin, 2001 ISBN 3-540-42128-9.
- Rodewald: Brandlehre. 6. Auflage, W. Kohlhammer, Stuttgart, 2007. ISBN 978-3-17-019129-7.
- M. Lackner, F. Winter, A. K. Agarwal: Handbook of Combustion. Wiley-VCH, Weinheim, 2010. ISBN 978-3-527-32449-1.
- Drysdale: An Introduction to Fire Dynamics. Second Edition 1998, John Wiley & Sons, Ltd, The Atrium, Southern Gate, Chichester West Sussex PO19 8SQ, England, ISBN 978-0-471-97291-4.
Weblinks
-
 Wikibooks: Anorganische Chemie für Schüler/ Erforschen des Verbrennungsvorgangs – Lern- und Lehrmaterialien
Wikibooks: Anorganische Chemie für Schüler/ Erforschen des Verbrennungsvorgangs – Lern- und Lehrmaterialien - Kurzer, populärwissenschaftlicher Artikel über die Grundlagen von Verbrennungsprozessen und ihre Erforschung
Einzelnachweise
Wikimedia Foundation.