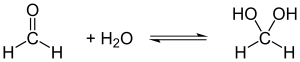- CH2O
-
Strukturformel 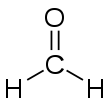
Allgemeines Name Formaldehyd Andere Namen - Methanal
- Methylaldehyd
- Formol
- Oxomethan
- Formylhydrat
- Ameisensäurealdehyd
- Ameisenaldehyd
- Formalin (35- bis 37-prozentige Lösung von Formaldehyd mit Methanol als Anti-Polymerisationszusatz)[1]
Summenformel CH2O CAS-Nummer 50-00-0 Kurzbeschreibung farbloses, stechend durchdringend riechendes Gas [2] Eigenschaften Molare Masse 30,03 g·mol−1 Aggregatzustand gasförmig
Dichte 0,82 g·cm−3 (−20 °C) [2]
Schmelzpunkt Siedepunkt −19 °C [2]
Dampfdruck Löslichkeit leicht löslich in Wasser [2]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Giftig (T) R- und S-Sätze R: 23/24/25-34-40-43 S: (1/2)-26-36/37/39-45-51 MAK 0,3 ml·m−3; 0,37 mg·m−3 [2]
WGK 2 – wassergefährdend [2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Formaldehyd (ausgesprochen Form-Aldehyd) ist der Trivialname für Methanal.
Es gehört zu den chemischen Verbindungen der Aldehyde, daher der zweite Namensteil.
Der erste Namensteil leitet sich von formica, dem lateinischen Wort für Ameise ab, da Methanal der zur Ameisensäure (Methansäure) gehörige Aldehyd ist. Ein Polymer von Formaldehyd ist Paraformaldehyd, das unter anderem in der Zellbiologie genutzt wird.
Inhaltsverzeichnis
Geschichte
Der Formaldehyd wurde von Alexander Michailowitsch Butlerow 1855 entdeckt. Die erste technische Darstellung durch Dehydrierung von Methanol wurde von A. W. v. Hofmann 1867 realisiert. Mit der Entdeckung der Harnstoffharze und der Phenolharze stieg ab Beginn des 20. Jahrhunderts der Bedarf an Formaldehyd stark an.
Vorkommen
In der Natur kommt Formaldehyd zum Beispiel in Säugetierzellen beim normalen Stoffwechsel als Zwischenprodukt vor: Im Menschen werden auf diese Weise pro Tag etwa 50 Gramm gebildet und wieder verstoffwechselt. Das Blut von Säugetieren enthält pro Liter ständig zwei bis drei Milligramm Formaldehyd. Weiterhin entsteht Formaldehyd auch bei der Photooxidation in der Atmosphäre. Auch in Früchten wie Äpfeln oder Weintrauben kommt Formaldehyd natürlicherweise vor. Ebenso kommt Formaldehyd natürlicherweise in Holz vor und diffundiert in geringen Mengen auch nach außen.
Formaldehyd entsteht außerdem bei praktisch allen unvollständigen Verbrennungen.
Formaldehyd gehört auch zu jenen Verbindungen, die mittels Radioastronomie im Weltall nachgewiesen werden konnten.
Formaldehyd entsteht auch bei der Kunststoffverarbeitung der sogenannten POM-Materialien als gasförmiges Nebenprodukt, wenn das Material verbrennt. Bei POM-Materialien ist der Formaldehydanteil bei der Verbrennung sehr hoch.
Gewinnung und Darstellung
Technisch wird Formaldehyd durch katalytische Oxidation von Methanol hergestellt:
Dabei haben sich im wesentlichen zwei Verfahren durchgesetzt, die sich prinzipiell in der Art des Katalysators unterscheiden:
- Silberverfahren: dabei dient metallisches Silber (Ag) als Katalysator
- Metalloxidverfahren: dabei werden bestimmte Metalloxide als Katalysator eingesetzt.
Beide Verfahren weisen unterschiedliche Vor- und Nachteile auf. So ist beispielsweise beim Silberverfahren ein Wechsel des Katalysators deutlich öfter nötig, andererseits kann dieser relativ einfach vom Betreiber der Anlage reaktiviert werden. Mit dem Metalloxidverfahren ist die Herstellung von Harnstoff-Formaldehyd-Konzentrat (UFC) einfacher möglich, die wässrige Formaldehyd-Lösung ist jedoch beim Silberverfahren von höherer Qualität (niedrigerer Gehalt an Ameisensäure).
Die Reaktion ist exotherm – das entsprechend heiße Gasgemisch muss also zur Vermeidung von Nebenreaktionen rasch abgekühlt werden, so dass die anfallende Reaktionswärme zur Erzeugung von Heißdampf genutzt werden kann.
Das entstandene Formaldehydgas wird dann in „Wäschern“ mittels Wasser oder einer Harnstoff-Lösung extrahiert, wobei eine wässrige Formaldehydlösung, beziehungsweise ein Harnstoff-Formaldehyd-Konzentrat entsteht. Die entstandenen Lösungen enthalten neben nicht umgesetzten Methanol auch noch geringe Mengen (etwa 100–300 ppm) Ameisensäure (HCOOH).
Eigenschaften
Physikalische Eigenschaften
Formaldehyd ist ein farbloser, stechend riechender Stoff, der bei Zimmertemperatur gasförmig vorliegt. Als Gas ist sein Geruch noch in Konzentrationen von 0,05–1 ml/m3 wahrnehmbar.
Chemische Eigenschaften
Formaldehyd ist sehr gut in Wasser löslich. In wässriger Lösung bildet sich ein Aldehydhydrat (Methandiol). Das Hydrat reagiert schwach sauer (pKs 13,3).
Sicherheitstechnische Kenngrößen
Formaldehyd bildet mit Luft in einem weitem Konzentrationsgereich explosionsfähige Gemische. Der Explosionsbereich liegt zwischen 7 Vol% (87 g/m3) als untere Explosionsgrenze (UEG) und 73 Vol% (910 g/m3) als obere Explosionsgrenze (OEG).[4]
Toxische Eigenschaften
Formaldehyd kann bei unsachgemäßer Anwendung Allergien, Haut-, Atemwegs- oder Augenreizungen verursachen. Akute Lebensgefahr (toxisches Lungenödem, Pneumonie) besteht ab einer Konzentration von 30 ml/m³. Die meisten Vergiftungen treten dann auch nicht durch direkten Kontakt mit Formaldehyd auf, sondern durch das Trinken von Methanol in minderwertigen Alkoholgetränken. Dabei wandelt sich das Methanol im Körper zunächst durch Alkoholdehydrogenase in Formaldehyd, dann schnell durch Aldehyddehydrogenasen in Ameisensäure um. Diese wird nur langsam metabolisiert und kann zur Azidose führen. Formaldehyd selbst denaturiert Netzhautproteine, was zur Erblindung führen kann.
Die therapeutischen Maßnahmen bei einer Formaldehydintoxikation sind vielfältig. Bei oraler Aufnahme ist die Gabe von Milch bzw. Aktivkohle zweckmäßig. Die Behandlung der Azidose erfolgt durch eine Natriumhydrogencarbonat-Infusion. Eine weiterführende Therapie kann durch Gabe von Hustensedativa, inhalativen β-Sympathomimetika oder inhalativen Glucocortikoiden durchgeführt werden. Durch Ammoniakdämpfe wird die Wirkung von Formalindämpfen unter Bildung von Hexamethylentetraamin aufgehoben.
Krebsrisiko
2004 stufte die Internationale Agentur für Krebsforschung (IARC) der Weltgesundheitsorganisation WHO die Substanz Formaldehyd als „krebserregend für den Menschen“ (CMR-Gefahrstoff) ein. CMR-Stoffe (karzinogene, mutagene und reproduktionstoxische Stoffe) zählen zu den besonders gefährlichen Stoffen und sollten durch weniger gefährliche Stoffe substituiert werden. Auf die Einstufung der WHO gründet sich auch eine neuere Einschätzung des Berliner Bundesinstituts für Risikobewertung (BfR), die Formaldehyd ebenfalls als „krebsauslösend für den Menschen“ einstuft. Vorher war die Chemikalie gemäß der EU-Richtlinie 67/548/EG, Anhang I nur als „möglicherweise Krebs erregend“ (Kategorie 3) klassifiziert. Ein Grund hierfür ist, dass im Tierversuch mit Ratten Formaldehyd nachweislich karzinogene Wirkung gezeigt hat, allerdings erst bei hohen Konzentrationen ab 6 ml/m³. Das BfR nennt neuere epidemiologischen Studien über eine erhöhte Sterblichkeit durch Tumore des Nasen-Rachenraumes bei Arbeitern, die in der Industrie Formaldehyd ausgesetzt waren, als Grund für die Neueinstufung.[5]
Grenzwerte
Im Bereich von Textilien (Bekleidung) gilt bei freiwilligen Schadstoffprüfungen im Rahmen eines Prüfsiegels (etwa Toxproof oder Öko-Tex 100) eine Bestimmungsgrenze von 20 mg/kg (20 ppm). Dies ist zugleich der Grenzwert für Baby-Bekleidung. Für hautnah getragene Kleidung gelten 75 mg/kg für andere Textilien 300 mg/kg. Der zulässige „Grenzwert“ in Deutschland liegt bei 1500 mg/kg (1500 ppm). Dies ist aber kein echter Grenzwert, da nur folgender Hinweis angebracht werden muss (Zitat BedGgstV (Bedarfsgegenständeverordnung)): Textilien mit einem Massengehalt von mehr als 0,15 vom Hundert an freiem Formaldehyd, die beim bestimmungsgemäßen Gebrauch mit der Haut in Berührung kommen und mit einer Ausrüstung versehen sind müssen gekennzeichnet sein: „Enthält Formaldehyd. Es wird empfohlen, das Kleidungsstück zur besseren Hautverträglichkeit vor dem ersten Tragen zu waschen“.
Verwendung
Im Labor wird Formaldehyd unter anderem im Rahmen der Mannich-Reaktion und der Blanc-Reaktion eingesetzt.
Da Formaldehyd wie alle Aldehyde ein starkes Reduktionsmittel ist, wurde er früher zur Keimabtötung verwendet (Formalintabletten).
Formaldehyd ist zudem einer der wichtigsten organischen Grundstoffe in der chemischen Industrie und dient als Ausgangsstoff für viele andere chemische Verbindungen. Allein die BASF hat eine jährliche Produktionskapazität von etwa 500.000 Tonnen Formaldehyd, woran man die Bedeutung dieses Stoffes für die chemische Industrie ermessen kann. Formaldehyd findet unter anderem Anwendung bei der Herstellung von Farbstoffen, Arzneistoffen und bei der Textilveredelung („knitterfrei“). Anfang der 1960er Jahre betrug der Anteil an freiem Formaldehyd (aus Aminoplaste) über zwei Prozent des textilen Warengewichtes und erreichte zu dieser Zeit seinen Höchstwert. Heute müssen Textilien, die beim bestimmungsgemäßen Gebrauch mit der Haut in Berührung kommen und mehr als 0,15 Prozent freies Formaldehyd enthalten wie folgt gekennzeichnet werden: „Enthält Formaldehyd. Es wird empfohlen, das Kleidungsstück zur besseren Hautverträglichkeit vor dem ersten Tragen zu waschen.“. Allerdings liegt die Einhaltung dieser Vorschrift in der Eigenverantwortung der Hersteller.
In der Kosmetik findet Formaldehyd Verwendung als Konservierungsstoff, was wegen des hautreizenden Potenzials des Stoffes als problematisch gilt. In Deutschland werden derzeit noch etwa zwölf Prozent der Kosmetika mit Formaldehydabspaltern konserviert. Da in der EG Formaldehyd von den Herstellern von Kosmetika oder Haarwaschmitteln deklariert werden muss und der Stoff einen schlechten Ruf hat, wird immer häufiger darauf verzichtet.
Polymerisiert als Thermoplastischer Kunststoff Polyoxymethylen (POM-H).
Zusammen mit Phenol kondensiert Formaldehyd zu einem Kunstharz Phenolharz, zum Beispiel dem Duroplast Bakelit.
Mit Harnstoff reagiert Formaldehyd zu Harnstoff-Formaldehyd-Harzen (UF-Harze), mit Melamin zu den Melamin-Formaldehyd-Harzen (MF-Harze), die beide zu den Aminoplasten gehören.
Auch wird Formaldehyd benutzt um Leichen zu konservieren, sowie zur Konservierung von anatomischen und biologischen Präparaten, wie beispielsweise Insekten. Da derart eingelegtes Material jahrelang haltbar ist, kann es problemlos als Anschauungs- oder Vergleichsmaterial in der Medizin und Biologie für Forschungs- und Lehrzwecke herangezogen werden. Auch zu künstlerischen Zwecken wird es eingesetzt. So konservierte der britische Künstler Damien Hirst einen Hai in Formaldehyd. Für diese Verwendungen wird eine 4-8%ige wässrige, gepufferte Lösung, Formalin oder Formol verwendet. Aufgrund der Gesundheitsgefahren durch Formaldehyd wird heute jedoch oft auf andere Konservierungsmittel wie Ethanol oder Isopropyalkohol zurückgegriffen.
In Flächendesinfektionsmitteln ist Formaldehyd immer noch einer der wirksamsten Bestandteile.
Es wird außerdem zur Herstellung folgender Produkte verwendet:
Süßstoffe, Bindemittel, Klebstoffe, Textilhilfsmittel, Düngemittel, Konservierungsmittel, Formsandbinder, Ionenaustauscher, Gießharze, Gerbstoffe, Härtezusätze, Vulkanisationszusatz, Füllungsmittel, Fungizide, Sprengstoffe, Ortschäume, Selbstbräuner.
Emissionsquellen
Bestimmte formaldehydhaltige Materialien (unter anderen Holzwerkstoffe, Bodenbeläge, Möbel und Textilien) können durch Ausgasung eine Kontamination der Atemluft in geschlossenen Räumen bewirken. In den achtziger Jahren sind in diesem Zusammenhang insbesondere Spanplatten und Sperrholz, zu deren Herstellung Aminoplaste als Bindemittel eingesetzt wurden, unter Verdacht gekommen. Es sind jedoch zum einen heute viele formaldehydfrei verklebte Holzwerkstoffe und Möbel im Handel erhältlich. Zum anderen wurden aber auch die Emissionen in den auf Formaldehyd basierenden Holzwerkstoffen deutlich reduziert. Trotzdem kommt es immer noch zu Grenzwertüberschreitungen in Kinderbetten.[6] Die Schadstoffsanierung formaldehydbelasteter Gebäude ist aber vor allem bei älteren Holzfertighäusern nach wie vor ein großes Thema.
Eine weitere wichtige Quelle für die Emission von Formaldehyd sind unvollständig ablaufende Verbrennungsprozesse. Diese finden sich beispielsweise in Verbrennungsmotoren von Kraftfahrzeugen, in Gießereien und bei der Herstellung von Kunststoffartikeln. Auch beim Rauchen entsteht auf diese Weise Formaldehyd, welches nicht unerheblich zur Belastung der Luft beiträgt. Im Gesamtrauch einer einzigen Zigarette finden sich etwa 1,5 mg Formaldehyd.
Problematisch ist auch die Verbrennung von Holz in Kleinfeuerungsanlagen, da hier durch unregelmäßige Beschickung oder feuchtes Holz die Verbrennung häufig unvollständig abläuft. Im Endeffekt entstehen in diesen im Hausbetrieb eingesetzten Anlagen Formaldehydkonzentrationen von 50–100 mg·m-3, was sich für die alten Bundesländer auf eine Gesamtemission von etwa 1000 Tonnen pro Jahr addiert (Schätzung für 1980). Zum Vergleich: Die wesentlich ergiebiger und sauberer arbeitenden industriellen Großfeuerungsanlagen für die Brennstoffe Gas, Öl und Kohle hatten im Jahr 1980 eine Gesamtemission von nur 50 Tonnen pro Jahr.
Nachweis
Ein Nachweis von freiem oder abspaltbarem Formaldehyd ist mit Chromotropsäure durch die Chromotropsäure-Reaktion möglich. Außerdem ist ein Nachweis mit Methylbenzothiazolonhydrazon oder fuchsinschwefliger Säure (Schiffsches Reagenz) möglich.
Das Europäische Arzneibuch lässt bei der Grenzprüfung auf Formaldehyd Acetylaceton zugeben, und die Tiefe der entstandenen Färbung mit einer Referenz vergleichen.
Für Holzwerkstoffe existieren unterschiedliche Methoden und Normen zur quantitativen Bestimmung von Kenngrößen, die letztlich auf das Emissionspotenzial oder das "reale" Emissionsverhalten rückschließen lassen:
- „Perforator-Methode“: Angabe in mg Formaldehyd pro 100 g Probe, siehe Perforator (Chemie)
- Desiccator-Methode: „Kleine“ Probenstücke geben Formaldehyd an Wasser ab, Angabe in mg/l
- „Kammer-Methoden“: Große Plattenproben werden über einen längeren Zeitraum auf ihre Formaldehyd-Emission in einer Prüfkammer untersucht, Angabe beim Pararosanilinverfahren: ppm mit 0,01 ppm = 0,0124 mg Formaldehyd/l Raumluft = 12,4 µg Formaldehyd/l Raumluft, Bestimmungsgrenze 0,01 ppm
Die Bestimmung erfolgt nach DIN EN ISO 14184-1:1999-02 (Ersatz für DIN 54260:1988-029), § 64 LFGB (ehem. § 35 LMBG) B 82.02-1 (freies und freisetzbares Formaldehyd) und DIN EN 717-1 (Holzwerkstoffe, Formaldehydabgabe nach der Prüfkammer-Methode). Und nach DIN EN 120 (Holzwerkstoffe - Bestimmung des Formaldehydgehaltes nach der Perforatormethode)
Entsorgung
Kleine Spritzer kann man mit viel Wasser verdünnt ins Abwasser geben. Größere Mengen sind unter Abfallschlüssel 070703 / Österreich (55370 gem.Ö-Norm S21000 Lösemittelgemische ohne halogen. organische Bestandteile) (Lösemittel) in dicht schließenden Behältern zu entsorgen.
Literatur
- Edmone Roffael: Die Formaldehyd-Abgabe von Spanplatten und anderen Werkstoffen. DRW-Verlag, Stuttgart 1982, 154 S., ISBN 3-87181-301-X
Einzelnachweise
- ↑ Roche Lexikon Medizin. Urban&Schwarzenberg 1998. 4. Auflage. ISBN 3-541-17114-6
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 50-00-0 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 9. August 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 50-00-0 im European chemical Substances Information System ESIS
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003
- ↑ BfR : Formaldehyd - Gefährlicher als bisher angenommen?, Stellungnahme vom 29. November 2004
- ↑ ÖKO-TEST Juni 2008, Test: Kinderbetten
Weblinks
Wikimedia Foundation.