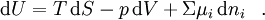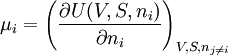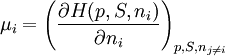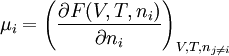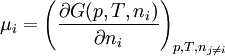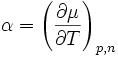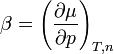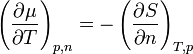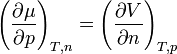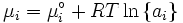- Chemisches Potenzial
-
Das chemische Potential μ charakterisiert die Möglichkeiten eines Stoffes,
- mit anderen Stoffen zu reagieren (chemische Reaktion);
- in eine andere Zustandsform überzugehen (Phasenübergang);
- sich im Raum umzuverteilen (Diffusion).
Eine Reaktion, Umwandlung oder Umverteilung kann freiwillig nur stattfinden, wenn das chemische Potential im Ausgangszustand größer ist als im Endzustand.
Das chemische Potential ist damit geeignet zur Beschreibung aller Arten von stofflichen Umsetzungen, auch von Reaktionen, an denen Photonen, Phononen, Elektronen oder Defektelektronen beteiligt sind.
Es ist definiert durch die Gibbssche Fundamentalgleichung der inneren Energie U:
Dabei ist T die absolute Temperatur, S ist die Entropie, p der Druck, V das Volumen und ni ist die Stoffmenge der Systemkomponente i.
Die Größe μ, die wir heute chemisches Potential nennen, wurde eingeführt von Josiah Willard Gibbs (1839-1903). Er nannte sie Potential eines Stoffes; gelegentlich auch, um Verwechslungen mit anderen Potentialen zu vermeiden, intrinsisches Potential.
Inhaltsverzeichnis
Alternative Formulierungen
Aus der Gibbschen Fundamentalgleichung folgt, dass μ aus der Funktion U(V, S, ni) berechnet werden kann:
Alternativ lässt sich μ auch aus Legendre-Transfomierten von U(V, S, ni) berechnen:
Hier ist H = U + pV die Enthalpie, F = U – TS die freie Energie und G = U + pV – TS die freie Enthalpie.
Der Index gibt die konstant zu haltenden Größen an. Die nj sind die Stoffmengen aller Systemkomponenten außer ni
Gleichgewichtsbedingungen
Im chemischen Gleichgewicht ist das chemische Potential der Edukte gleich dem der Produkte, ähnlich wie im thermischen Gleichgewicht zwischen zwei Systemen deren Temperaturen gleich sind oder im elektrischen Gleichgewicht die elektrischen Potentiale.
Bei geeigneter Prozessführung kann die Bedingung für chemisches Gleichgewicht auch als Extremalprinzip formuliert werden.
Konstanthalten von Größe, deren Wert minimal wird V und S U p und S H V und T F p und T G Da bei chemischen Reaktionen oft Druck und Temperatur konstant gehalten werden, ist das Minimalprinzip der freien Enthalpie G das am meisten verwendete Kriterium. Das allgemeinere Gleichgewichtskriterium ist aber das Verschwinden der chemischen Potenzialdifferenz, denn es gilt unabhängig davon, welche anderen Größen konstant gehalten werden; es gilt auch dann noch, wenn keine der anderen Variablen während des Einstellprozesses des Gleichgewichts konstant bleibt.
Interpretation
μi gibt die Abhängigkeit der thermodynamischen Energiegrößen U, H, F und G von der Zusammensetzung des Systems an.
Jede Potentialdifferenz beschreibt die Fähigkeit des Systems, Arbeit zu verrichten. Daher besitzen chemische Reaktionen solange eine Triebkraft ("Freiwilligkeit des Ablaufens"), bis sich ein Gleichgewicht einstellt, indem sich die chemischen Potentiale aller Stoffe angleichen (Die Summe der chemischen Potentiale multipliziert mit den stöchiometrischen Koeffizienten ergibt Null, oder anders gesagt: die Affinität wird Null).
Für reine Stoffe (einkomponentige Systeme) ist das chemische Potential konstant und gleich der molaren Gibbs-Energie. Die molaren Gibbs-Energien für die Bildung vieler Stoffe unter Standardbedingungen sind tabelliert und erlauben die Berechnung von chemischen Potentialdifferenzen in Reaktionsmischungen. Bei gegebenen p, T, V, S und nj = 1
 k ist damit die Berechnung von Reaktionswärme und Reaktionsrichtung möglich.
k ist damit die Berechnung von Reaktionswärme und Reaktionsrichtung möglich.Für kristalline Festkörper entspricht das chemische Potential der Elektronen bei T = 0 K der Fermi-Energie.
Für Quasiteilchen gilt μ = 0, da für diese die Teilchenzahl nicht erhalten ist.
Werte des chemischen Potentials
Die Werte des chemischen Potentials sind für Standardbedingungen (T = 298,15 K; p = 101,325 kPa) tabelliert, siehe unten unter „Weblinks“. Ist das chemische Potential für einen bestimmten Zustand bekannt (z. B. bei Standardbedingungen), so lässt es sich für Drücke und Temperaturen in der Umgebung dieses Zustandes in linearer Näherung berechnen:
μ(T) = μ(T0) + α(T – T0)
bzw.
μ(p) = μ(p0) + β(p – p0)
Hier ist
der Temperaturkoeffizient und
der Druckkoeffizient.
Mit Hilfe der Maxwell-Beziehungen
und
folgt, dass der Temperaturkoeffizient gleich der negativen molaren Entropie und der Druckkoeffizient gleich dem molaren Volumen ist.
Konzentrationsabhängigkeit
Zur praktischen Definition der Konzentrationsabhängigkeit wird das chemische Potential in einen konzentrationsunabhängigen und einen konzentrationsabhängigen Summanden aufgespalten. Die Definition des konzentrationsabhängigen Terms erfolgt mit Hilfe der thermodynamischen Aktivität der Komponente i:
μi° chemisches Potential unter Standarddruck, welches immer noch von der Temperatur abhängig ist. (Standardbedingungen) 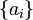
Aktivität des Stoffes, bezogen auf die Standardaktivität (Die geschweiften Klammern sind hier als mathematischer Operator zu verstehen, der bedeutet: "Dividiere ai durch die Standardaktivität.")
Die Aktivität kann in Berechnungen oft mit ausreichender Genauigkeit durch die Konzentration ci (für gelöste Stoffe) bzw. den Partialdruck pi (für Gase) ersetzt werden. Handelt es sich bei dem betrachteten System um einen Elektrolyten, so liefert die Debye-Hückel-Theorie einen Aktivitätskoeffizienten, mit dessen Hilfe sich die Konzentration in die Aktivität umrechnen lässt.
Literatur
- J. Willard Gibbs: The Scientific Papers of J. Willard Gibbs: Vol. I Thermodynamics. Dover Publications, New York 1961.
- G. Job, F. Herrmann: Chemical Potential – a quantity in search of recognition. In: Eur. J. Phys. 27, 2006, S. 353–371 (doi:10.1088/0143-0807/27/2/018, PDF).
Weblinks
- Tabelle chemischer Potentiale und Temperaturkoeffizienten
- Das chemische Potenzial in Experimenten: Schauversuche Marmorauflösung, Ammoniak-Springbrunnen, Karbidlampe (jeweils Versuchsanleitung und Video)
Siehe auch
elektrochemisches Potential, Temperatur, Druck, Entropie, intensive Größe, Nernst-Gleichung
Wikimedia Foundation.