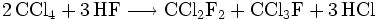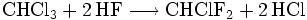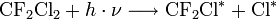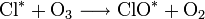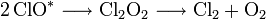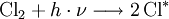- Chlorfluorkohlenstoff
-
Fluorchlorkohlenwasserstoffe (FCKW), chemische Nomenklatur nach IUPAC: Chlorfluorkohlenwasserstoffe (CFKW), sind eine umfangreiche chemische Gruppe niedermolekularer organischer Verbindungen, die als Treibgase oder Kältemittel verwendet werden. FCKW sind Kohlenwasserstoffe, bei denen Wasserstoffatome durch die Halogene Chlor und Fluor ersetzt wurden, sie sind eine Untergruppe der Halogenkohlenwasserstoffe. FCKW, die nur Einfachbindungen enthalten, nennt man gesättigte FCKW. Ist in der Verbindung kein Wasserstoff mehr enthalten, so nennt man sie Chlorfluorkohlenstoffe. Im Laufe der 70er und 80er Jahre des 20. Jh. stellte sich heraus, dass die Freisetzung von FCKW in die Atmosphäre in erheblichem Maße für den Abbau der Ozonschicht in der Stratosphäre (Ozonloch) verantwortlich ist, weshalb der Einsatz von FCKW heute in vielen Anwendungsbereichen verboten ist.
Unter H-FCKW versteht man teilhalogenierte Fluorchlorkohlenwasserstoffe, deren Wasserstoffatome nur teilweise durch Chlor- und Fluoratome ersetzt sind. Sie besitzen ein weitaus geringeres Ozonabbaupotenzial als die FCKW, ihr Treibhauspotenzial liegt ebenfalls weit unter dem der FCKW. Zudem werden die H-FCKW schon in der Troposphäre abgebaut und gelangen nur teilweise in die Stratosphäre.
Inhaltsverzeichnis
Eigenschaften
FCKW sind sehr beständig, unbrennbar, geruchlos, durchsichtig und ungiftig oder haben nur eine geringe Toxizität. Die FCKW der Methan- und Ethanreihe besitzen einen niedrigen Siedepunkt und lassen sich durch Komprimieren leicht verflüssigen. FCKW haben wegen ihrer Reaktionsträgheit eine hohe Verweildauer in der Atmosphäre. Sie steigen deshalb bis in die Stratosphäre auf und werden dort von den UV-Strahlen zerlegt. Dabei werden Chlor- bzw. Fluor-Radikale freigesetzt, welche mit dem Ozon der Ozonschicht reagieren und dieses schädigen. 2007 wurden drei FCKWs mit untypischen Eigenschaften - sehr reaktiv und giftig - in der Atmosphäre nachgewiesen.[1]
Herstellung
Eine direkte Fluorierung von Alkanen ist nur schwer durchführbar, da die hochexotherme Reaktion meist explosionsartig verläuft und fast stets zu einem Gemisch von perfluorierten Verbindungen führt. Technisch gewinnt man Chlorfluoralkane durch Fluorierung der entsprechenden Chloralkane mit wasserfreiem Fluorwasserstoff an Festbettkatalysatoren aus Aluminium- oder Chromfluoriden. Möglich ist auch die Anwendung eines Antimon(V)-chlorid-Katalysators.[2]
- Beispiel 1: Umsetzung von Tetrachlorkohlenstoff mit wasserfreiem Fluorwasserstoff in ein Gemisch von Dichlordifluormethan, Trichlorfluormethan und Chlorwasserstoff:
- Beispiel 2: Umsetzung von Chloroform mit wasserfreiem Fluorwasserstoff in Chlordifluormethan (Freon 22). Hier kommt als Katalysator Antimon(V)-chlorid zur Anwendung.
Möglich ist auch eine Elektrofluorierung nach Simons. Dabei wird die anodische Fluorierung in wasserfreiem Fluorwasserstoff bei einer Spannung durchgeführt, die noch nicht zur Freisetzung von elementarem Fluor ausreicht.
Geschichte und Verwendung
Ende des 19. Jahrhunderts wurden die ersten halogenierten Kohlenwasserstoffe durch Direktfluorierung (Moissan) und elektrophil katalysierten Halogenaustausch (Swarts) hergestellt. Die ersten FCKWs (CFCl3 und CF2Cl2) wurden 1929 durch Thomas Midgley bei General Motors synthetisiert. Ab 1930 wurden die FCKW technisch hergestellt und zunehmend als Kältemittel in Kältemaschinen, als Treibgas für Sprühdosen, als Treibmittel für Schaumstoffe, als Reinigungs- und Lösungsmittel eingesetzt. Der Einsatz als Kältemittel in Kühlschränken ist seit 1995 verboten, da FCKW zur Zerstörung der Ozonschicht beitragen.
Bromhaltige FCKW werden als Feuerlöschmittel eingesetzt und werden auch als Halone bezeichnet.
Vor dem Einsatz von FCKW wurde erstmals 1974 gewarnt, doch dies wurde nicht ernst genommen. Die Entdeckung des Ozonlochs 1985 sorgte für einen Meinungswandel. Im Montrealer Protokoll vom 16. September 1987 verpflichteten sich viele Staaten zur drastischen Reduktion der Herstellung von FCKW. Am 29. Juni 1990 beschloss die internationale Konferenz zum Schutz der Ozonschicht in London, die Herstellung und Anwendung von CFK und FCKW ab dem Jahr 2000 zu verbieten oder zumindest stark einzuschränken. Die Einigung sah vor, den FCKW-Einsatz bis 1995 um 50 %, bis 1997 um 85 % zu reduzieren. Die chemische Stabilität macht diese Gase in der Atmosphäre nur schwer abbaubar (mittlere Verweildauer je nach Produkt zwischen 44 bis 180 Jahre).
Die wichtigsten FCKW-Kältemittel:
Bezeichnung Trivialname Summenformel Siedepunkt Trichlorfluormethan Frigen 11 CCl3F 24,9 °C Dichlordifluormethan Frigen 12 CCl2F2 -30 °C 1,1,2-Trichlor-1,2,2-trifluorethan Frigen 113 CClF2-CCl2F 48 °C 1,2-Dichlor-1,1,2,2-tetrafluorethan Frigen 114 oder Cryofluoran CClF2-CClF2 3,5 °C Umwelteinfluss
Die niedermolekularen, wasserstofffreien CFK gelangen aufgrund ihrer chemischen Stabilität und ihrer großen Flüchtigkeit in die Stratosphäre und reagieren mit der Ozonschicht. Beispiel:
Dabei meint
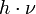 ein Photon geeigneter Frequenz, und Cl * ein Chlorradikal.
ein Photon geeigneter Frequenz, und Cl * ein Chlorradikal.Das Chlorradikal baut Ozon zu bimolekularem Sauerstoff ab. Das an dem Sauerstoff gebundene Chlor wird wieder frei, wobei bimolekulares Chlor entsteht. Durch ein Photon geeigneter Energie werden daraus wieder Chlorradikale freigesetzt, wodurch der Zyklus von vorn beginnen kann:[2]
Dadurch wird die Schutzwirkung der Ozonschicht zerstört und harte UV-Strahlung kann bis zur Erdoberfläche dringen und hat schädigende Wirkung auf Pflanzen, Tiere und Menschen. Zusätzlich absorbieren FCKW Licht im Infrarotbereich (stärker als CO2) und tragen zur globalen Erwärmung bei.
Alternativen
Alternativen zu den FCKW-basierten Treibgasen für Aerosol-Zerstäubung sind u. a. HFA-134a, das die Ozonschicht nicht beeinträchtigt, dafür aber den Treibhauseffekt fördert. Meistens wird jedoch ein durch Druck leicht zu verflüssigendes Alkanegemisch aus Propan und Butan verwendet, weshalb diese Spraydosen das Gefahrensymbol hochentzündlich tragen. Bei den Kältemitteln bieten sich Propan, Butan, Pentan, Ammoniak oder Kohlenstoffdioxid als Alternativen an, wobei zu beachten ist, dass die ersten drei Substanzen feuergefährlich, Ammoniak ätzend und giftig ist.
Als alternatives Kältemittel wurde Stickstofftrifluorid empfohlen, das seither zum Einsatz kommt. Neue Messverfahren wiesen 2008 dessen Konzentration in der Atmosphäre und die bedeutsame Klimaschädigung nach [3].
Quellen
- ↑ J. C. Laube and A. Engel: First atmospheric observations of three chlorofluorocarbons. in: Atmos. Chem. Phys. Discuss.,2008, 8, 6683–6695.
- ↑ a b H. Beyer, W. Walter, Fluorierte Kohlenwasserstoffe. Lehrbuch der organischen Chemie, 22. Auflage, 1991, Hirzel Verlag, Stuttgart, S. 138ff
- ↑ http://www.geowissenschaften.de/wissen-aktuell-9016-2008-10-27.html Super-Treibhausgas in der Atmosphäre entdeckt, Scinexx, Springer
Weblinks
Wikimedia Foundation.