- Additions-Eliminierungsmechanismus
-
Der Additions-Eliminierungs-Mechanismus ist ein Reaktionstyp der Organischen Chemie, der vor allem bei Derivaten von Carbonsäuren auftritt. Hierbei reagieren Carbonsäurederivate wie Carbonsäurehalogenide, Carbonsäureanhydride, Ester, Thioester oder Amide formal in einer der nukleophilen Substitution entsprechenden Reaktion. Ein Nucleophil addiert sich zunächst an die Carbonylgruppe, wodurch ein tetraedrisches Zwischenprodukt entsteht, welches unter Eliminierung einer Abgangsgruppe die Carbonylfunktion zurückbildet.
Der Erfolg der Reaktion ist abhängig von der Nukleophilie des Nukleophils, der Elektrophilie des Carbonsäurederivats, sowie der Qualität der Abgangsgruppe.
Inhaltsverzeichnis
Mechanismus
Die Gesamtreaktion setzt sich aus zwei Teilschritten, Addition und Eliminierung, zusammen, weswegen die Gesamtreaktion als Additions-Eliminierungs-Mechanismus bezeichnet wird. Ein analoger Begriff ist Nucleophile Substitution an Carbonsäurederivaten.
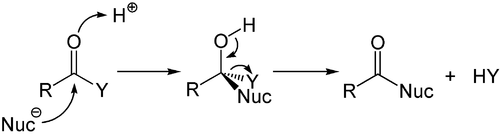
Säurekatalysierte Reaktion
Die Reaktion kann durch Säuren katalysiert werden. Hierbei ist sowohl die Verwendung von Brønsted- als auch von Lewis-Säuren möglich. Die Säure tritt hierbei in Wechselwirkung mit dem Sauerstoffatom der Carbonylfunktion und generiert so eine positive Teilladung am Kohlenstoffatom des Carbonyls, wodurch dessen Elektrophile gesteigert wird.
Beispielsweise Esterhydrolysen oder Deamidierungen können säurekatalysiert durchgeführt werden. Letztere spielt in der Antibiotikaresistenz eine Rolle: resistente Bakterien verfügen über das Enzym Penicillinase, welches Penicillin (ein cyclisches Carbonsäureamid (Lactam)) zu hydrolysieren vermag.
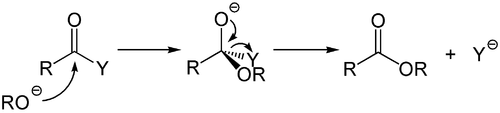
Basenkatalysierte Reaktion
Dieser Mechanismus ist das Analogon zur säureinduzierten Hydrolyse und ebenfalls von großer präparativer und synthetischer Bedeutung. Hierzu zählen die baseninduzierten Hydrolysen vieler Carbonsäurederivate.
Schwache Nucleophile, beispielsweise Wasser oder Alkohole reagieren nur mit sehr elektronenarmen Carbonsäurederivaten ohne Aktivierung bei Raumtemperatur. Durch die katalytische Verwendung einer Base werden aus den schwachen Nukleophilen Hydroxidionen beziehungsweise Alkoholate gebildet, welche deutlich bessere Nukleophile darstellen.
Die Hydrolyse von Carbonsäureamiden läuft meist nur schlecht ab, da das Amidion eine schlechte Abgangsgruppe darstellt. Unter Verwendung von Hydroxidionen als Nukleophil wird eine Carbonsäure gebildet, welche dann vom ausgetretenen Amidion unter Bildung von Ammoniak deprotoniert wird.
Die schwere Hydrolysierbarkeit der Carbonsäureamide ist wichtig in der Biochemie, da Amide Bausteine der Peptide und Proteine sind. Die Stabilität der Peptidbindung, einer amidartigen Bindungen, ist zentral für die gesamte Proteinbiochemie und der Enzymbiochemie.
Hydrolyse unter neutralen Bedingungen
Carbonsäurechloride zählen zu den reaktivsten und instabilsten Carbonsäurederivaten. Die Ursache hierfür ist die hohe Elektronegativität des Chlors, welches das Carbonylkohlenstoff-Atom so stark positiv polarisiert, dass es leicht nukleophil angegriffen werden kann. Carbonsäurechloride reagieren meist schon bei Raumtemperatur unter Neutralbedingungen in einer exothermen Reaktion heftig mit Wasser, wobei Salzsäure gebildet wird.
Falls die eingesetzte Verbindung säurelabil ist, kann die gebildete Säure durch Verwendung nicht-nukleophiler Basen, beispielsweise Pyrimidin, abgefangen werden.
Reaktivität
Bei gleichem Nukleophil ist die Reaktivität des Carbonsäurederivats von der Basizität der Abgangsgruppe abhängig. Die elektronenreichen Carboxylate sind praktisch inert.


Literatur
- Marye Anne Fox/James K. Whitesell: Organische Chemie, Grundlagen, Mechanismen, bioorganische Anwendungen. S. 476 ff., Spektrum, Akad. Verl., 1995, ISBN 3-86025249-6
Wikimedia Foundation.