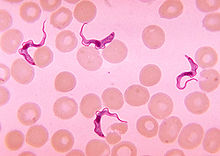
- Afrikanische Trypanosomiasis
-
Klassifikation nach ICD-10 B56.0 Trypanosomiasis gambiensis B56.1 Trypanosomiasis rhodesiensis B56.9 Afrikanische Trypanosomiasis, nicht näher bezeichnet ICD-10 online (WHO-Version 2011) Die Schlafkrankheit ist eine durch Unterarten von Trypanosoma brucei ausgelöste Tropenerkrankung, die auch synonym als Afrikanische Trypanosomiasis bezeichnet wird. Sie kommt in den tropischen Gebieten Afrikas vor und wird von der Tsetsefliege übertragen. Die Erkrankung verläuft in drei Stadien: Einige Wochen nach der Infektion kommt es zu Fieber, Schüttelfrost, Ödemen, Lymphknotenschwellung sowie Hautausschlag und Juckreiz. Im zweiten Stadium nach einigen Monaten stehen Symptome des Nervensystems im Vordergrund: Verwirrtheit, Koordinations- und Schlafstörungen sowie Krampfanfälle. Im Endstadium kommt es zu einem Dämmerzustand, der der Krankheit ihren Namen gegeben hat. Der Nachweis der Erreger erfolgt mikroskopisch im Blut oder Liquor cerebrospinalis sowie mit immunologischen Methoden. Zur Behandlung stehen mehrere verschiedene Wirkstoffe zur Verfügung.
Inhaltsverzeichnis
Erreger
Die Schlafkrankheit wird durch humanpathogene Einzeller (Protozoen) aus der Gruppe der Trypanosomen hervorgerufen. Man unterscheidet 2 Erregertypen:
- Trypanosoma brucei gambiense (Erreger der Westafrikanischen Schlafkrankheit)
- Trypanosoma brucei rhodesiense (Erreger der Ostafrikanischen Schlafkrankheit)
Das Erbgut von Trypanosoma brucei wurde 2005 sequenziert. [1]
Übertragung
Als Erregerreservoir der Trypanosomen dienen Menschen, Rinder und Antilopen. Anders als bei der Malaria sind die Überträger der Schlafkrankheit tagaktive, stechende und blutsaugende sogenannte Zungenfliegen (Tsetsefliegen). Man trifft sie im tropischen Afrika vorwiegend in Feuchtgebieten (Flussläufe, Sümpfe), aber auch in trockenen Savannenlandschaften (z. B. Kalahari) an. Der Stich ist sehr schmerzhaft und kann auch durch Bekleidung hindurch erfolgen. Die Erreger gelangen mit dem Fliegenspeichel in den Stichkanal. Er wird von der Fliege abgesondert, um Gerinnungsprozesse zu verhindern. Durch einen Stich werden mehrere tausend Erreger übertragen. Ein einziges übertragenes Trypanosom könnte genügen, um die Krankheit auszulösen. Bremsen und Stechfliegen könnten (in besonderen Fällen) möglicherweise eine Rolle durch mechanische Übertragung spielen. [2]
Infektionsrisiko
Nicht alle Tsetse-Fliegen sind Trypanosomen-Überträger, so dass nicht jeder Stich zwangsläufig zu einer Infektion führt. Das Infektionsrisiko bei einem Tsetsestich ist regional sehr unterschiedlich und liegt durchschnittlich in der Größenordnung 1:100, denn auch die Durchseuchungsrate der Tsetse variiert stark. Das Risiko steigt also mit der Zahl der Stiche. Die Infektion trifft überwiegend die einheimische Bevölkerung, seltener Touristen.
Epidemiologie
Die Schlafkrankheit kommt mit einem schwer erfassbaren regionalen Verteilungsmuster im gesamten Tropengürtel Afrikas vor. Insgesamt sind nach Schätzungen der WHO mehr als 500.000 Menschen von der Schlafkrankheit betroffen. Durch die instabile politische Situation in vielen Regionen (Flüchtlinge) hat die Erkrankungsrate in den letzten Jahren zugenommen.
Das Parasitenreservoir von T. b. gambiense besteht nach Dönges (1988)[3] hauptsächlich aus den infizierten, eventuell auch nur latent infizierten Menschen, einigen Haustieren, besonders dem Hausschwein (auch bei Desowitz (1981)) und der Riesenhamsterratte Cricetomys gambianus (Langschwanzmäuse). Piekarski (1962) nennt die Antilope unter den Wildtieren. Oft wird T. b. gambiense während des 1. Stadiums im Menschen nicht diagnostiziert und es folgt (oft erst nach Jahren) das schwerer zu behandelnde 2. Stadium.
T. b. rhodesiense fand sich weiterhin am häufigsten bei der Schirrantilope, gefolgt von dem Hausrind, der Kuhantilope, dem Afrikanischen Büffel, der Fleckenhyäne und dem Löwen (Dönges). In begrenzterem Umfang als bei T. b. gambiense ist auch hier der erkrankte Mensch ein Erregerreservoir. Piekarski nennt für beide Trypanosomenunterarten noch Ziegen und Schafe.
Welche Tierarten bei der Übertragung auf den Menschen die bedeutendste Rolle spielen, ist nicht abschließend geklärt, da ein kompliziertes Geflecht von anderen epidemiologischen Parametern beachtet werden muss (z. B. 31 Tsetse-Arten mit Vorlieben für bestimmte Wirtstiere, sowie Regenzeiten, soziale Faktoren, unterschiedliche Erregerstämme etc.). Das Infektionsrisiko ist deswegen lokal und regional sehr unterschiedlich. Die Parasitenreservoire sind zum großen Teil auch für jene Trypanosomen relevant, die bei afrikanischen Haus- und Nutztieren die sog. Nagana verursachen.
Symptomatik
Der Krankheitsverlauf ist abhängig vom auslösenden Erreger. Bei Infektion mit Trypanosoma brucei gambiense ist der Krankheitsverlauf langsamer, bei Infektion mit Trypanosoma brucei rhodesiense in der Regel schneller und ausgeprägter.
Stadium I (Hämolymphatische Phase): In der ersten Woche nach der Infektion kann es an der Einstichstelle zu einer schmerzhaften Schwellung mit zentralem Bläschen, dem sog. Trypanosomenschanker kommen. Dieses Symptom tritt jedoch nur bei einem Teil der Infizierten (5 – 20 %) auf. 1 – 3 Wochen nach der Infektion beginnt die eigentliche Parasitämie, die von Fieber, Schüttelfrost, Kopf- und Gliederschmerzen, Ödemen, Jucken, Exanthem und Lymphknotenschwellung begleitet wird. Häufig tritt diese Lymphknotenschwellung an den hinteren Halslymphknoten oder am Nacken auf und wird dann als Winterbottom-Zeichen bezeichnet. Hinzu treten Anämie und Thrombozytopenie, sowie erhöhte IgM-Spiegel.
Stadium II (Meningoenzephalitische Phase): Ca. 4 – 6 Monate nach Infektion – bei T. b. rhodesiense oft schon nach wenigen Wochen – dringen die Erreger in das Zentralnervensystem ein. Die Patienten leiden unter zunehmenden Verwirrungszuständen, Koordinations- und Schlafstörungen, Krampfanfällen, Apathie und Gewichtsverlust. Es können extrapyramidale Störungen oder ein Parkinson-Krankheit-ähnliches Krankheitsbild auftreten.
Im Endstadium fallen die Patienten in einen kontinuierlichen Dämmerzustand, der der Krankheit ihren Namen gegeben hat. Im Liquor cerebrospinalis ist eine Zellvermehrung (Pleozytose) nachweisbar. Nach einem Verlauf von Monaten bis Jahren endet die Krankheit tödlich.
Immunantwort
Die Trypanosomen sind von Glykoproteinen, den so genannten „variable surface glycoproteins“ (VSGs) umgeben. Die VSGs werden von den Einzellern im Rahmen der Vermehrung ständig variiert, wodurch sie der Immunantwort des Wirts entgehen (Antigenvariation). Im Trypanosomen-Genom sind über 1000 verschiedene VSG-Gene codiert, die abwechselnd exprimiert werden. Das menschliche Immunsystem kann zwar Antikörper gegen die vorherrschenden Antigene produzieren, aber immer nur einen Teil der Erreger eliminieren, da bereits neue Varianten im Blutkreislauf zirkulieren.
Eine andere, von Wissenschaftlern der TU Darmstadt und des Max-Planck-Instituts für Dynamik und Selbstorganisation entdeckte Abwehrmethode ist die Aufnahme der Antikörper durch den Erreger mittels einer strömungsdynamischen Besonderheit. Die Trypanosomen bewegen sich im Blutkreislauf mit hoher Geschwindigkeit voran und lenken die Antikörper dabei an den hinteren Zellpol, wo diese durch Endozytose aufgenommen, abgebaut und somit ihrer Wirksamkeit beraubt werden.[4]
Diagnostik
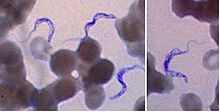 Giemsa-Färbung von Trypanosomia brucei unter dem Mikroskop
Giemsa-Färbung von Trypanosomia brucei unter dem Mikroskop
Im Stadium I werden die Erreger mikroskopisch im Blut („dicker Tropfen“), im Punktat des Schankers, im Knochenmarkaspirat oder mittels Lymphknotenbiopsie nachgewiesen. Zum Ausschluss des Stadium II erfolgt bei Parasitennachweis zusätzlich eine Untersuchung des Liquor cerebrospinalis. Als immundiagnostische Verfahren werden ELISA, IFT und PHA/IHA eingesetzt. Besonders bei der T. b. gambiense im späten Stadium kann der Erregernachweis im Blut misslingen.
Vorbeugung
Zur Zeit (2004) ist weder eine medikamentöse Prophylaxe der Schlafkrankheit noch eine vorbeugende Impfung verfügbar. In der Mitte des letzten Jahrhunderts wurde Pentamidin, intramuskulär injiziert, erfolgreich als Prophylaxe eingesetzt. Diese war für mindestens 6 Monate effektiv (T. b. gambiense). Die heute einzig mögliche Vorbeugung besteht in der Vermeidung von Insektenstichen. Touristen sollten sich mit Repellents, Moskitonetzen und langärmeliger Kleidung schützen. Wichtig könnte auch das Tragen von heller Kleidung sein, da die Tsetsefliege besonders von blau und schwarz angezogen wird. Diese Maßnahmen sind jedoch nur bedingt erfolgreich, da Tsetsefliegen aggressiv vorgehen und schnell eine ungeschützte Stelle am Körper finden.
Therapie
Aufgrund der Toxizität der verfügbaren Medikamente wird die Schlafkrankheit in den meisten Fällen stationär behandelt. Im Stadium II werden Arsenverbindungen eingesetzt, die ausgeprägte Nebenwirkungen auslösen. Die Letalität kann hier bis zu 10 % betragen.
- Stadium I: Gabe von Suramin (T. b. rhodesiense/gambiense) oder Pentamidin (T. b. gambiense). Beide Medikamente wirken nicht auf Erreger im Zentralnervensystem, da sie die Blut-Hirn-Schranke nicht überwinden.
- Stadium II: Gabe von Melarsoprol oder Eflornithin, früher auch Tryparsamid (T. b. gambiense). Beide Medikamente wirken gegen Erreger im zentralen Nervensystem, sind jedoch neurotoxisch.
Inzwischen ist es Forschern gelungen, einen preiswerten Wirkstoff zu entwickeln, der keine Nebenwirkungen zeigt. Allerdings wurde dieser bisher nur an Mäusen getestet.[5]
Geschichte
Sir David Bruce erforschte als einer der Ersten die Epidemiologie der Krankheit in Afrika.
Auf Grundlage der Arbeiten von Harold Wolferstan Thomas und Anton Breinl erforschte Robert Koch die Wirkung von Atoxyl gegen die Erkrankung. Paul Ehrlich entwickelte daraus das Arsphenamin.
Ein wichtiges Medikament ist seit etwa 1920 Suramin (Germanin).
Literatur
- Johannes Dönges: Parasitologie, 1988, 2.Aufl., Georg Thieme Verlag, Stuttgart/ New York, ISBN 3-13-579902-6
- Gerhard Piekarski: Medical Parasitology in Plates. Farbenfabriken Bayer AG (Pharmaceutical Division), Leverkusen 1962
- Robert S. Desowitz: New Guinea Tapeworms and Jewish Grandmothers, tales of parasites and people. Norton Verlag, 1987, ISBN 0-393-30426-4. (bes. zur Geschichte des Viktoriasees)
- Stefan Winkle: Geißeln der Menschheit – Kulturgeschichte der Seuchen. Artemis & Winkler Verlag, 3. erweiterte Auflage, 2005, ISBN 3-538-07159-4
Quellen
- ↑ Berriman M et al: The genome of the African trypanosome Trypanosoma brucei. Science. 2005 Jul 15;309(5733):416–22. PMID 16020726
- ↑ Cherenet T et al: Seasonal prevalence of bovine trypanosomosis in a tsetse-infested zone and a tsetse-free zone of the Amhara Region, north-west Ethiopia. Onderstepoort J Vet Res. 2004 Dec;71(4):307–12. PMID 15732457
- ↑ Moll-Merks C, Werner H, Donges J: Suitability of in-vitro xenodiagnosis: development of Trypanosoma cruzi in Triatoma infestans depending on larval stage of bugs and number of trypomastigotes taken during in-vitro blood meal. Zentralbl Bakteriol Mikrobiol Hyg [A]. 1988 Mar;268(1):74–82. PMID 3134769
- ↑ Engstler M, Pfohl T: Hydrodynamic Flow-Mediated Protein Sorting on the Cell Surface of Trypanosomes. Cell. (2007) 131:505–515
- ↑ Möglicherweise gibt es bald ein neues Medikament gegen die Schlafkrankheit., Forschung aktuell vom 1. April 2010
Siehe auch
Weblinks
- Factsheet der WHO (engl.)
- Informationen zur Schlafkrankheit der Ärzte ohne Grenzen
- Information der CDC (engl.)
- Presse-Information der Max-Planck-Gesellschaft über die Arbeit von Engstler et al.

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- Parasitose des Menschen
- Tropenkrankheit
- Schlafstörung
Wikimedia Foundation.