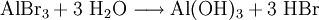- E 173
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Aluminium, Al, 13 Serie Metalle Gruppe, Periode, Block 13, 3, p Aussehen silbrig CAS-Nummer 7429-90-5 Massenanteil an der Erdhülle 7,57 % Atomar Atommasse 26,981538 u Atomradius (berechnet) 125 (118) pm Kovalenter Radius 118 pm Elektronenkonfiguration [Ne] 3s2 3p1 Elektronen pro Energieniveau 2, 8, 3 Austrittsarbeit 4,08–4,25 eV 1. Ionisierungsenergie 577,5 kJ/mol 2. Ionisierungsenergie 1816,7 kJ/mol 3. Ionisierungsenergie 2744,8 kJ/mol Physikalisch Aggregatzustand fest Kristallstruktur kubisch flächenzentriert Dichte 2,7 g/cm3 Mohshärte 2,75 Magnetismus paramagnetisch Schmelzpunkt 933,47 K (660,32 °C) Siedepunkt 2740 K (2467 °C) Molares Volumen 10,00 · 10−6 m3/mol Verdampfungswärme 293,4 kJ/mol Schmelzwärme 10,79 kJ/mol Dampfdruck 2,42 · 10−6 Pa Schallgeschwindigkeit 6420 (long.), 3040 (trans.) m/s bei 293,15 K Spezifische Wärmekapazität 900 J/(kg · K) Elektrische Leitfähigkeit 37,7 · 106 A/(V · m) Wärmeleitfähigkeit 237 W/(m · K) Mechanisch Poissonzahl 0,33 Chemisch Oxidationszustände 3 Oxide (Basizität) Al2O3 (amphoter) Normalpotential −1,66201 V (Al3+ + 3e− → Al) Elektronegativität 1,61 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 25Al 7,183 s ε 4,277 25Mg 26Al 7,17 · 105 a ε 4,004 26Mg 27Al 100 %
Stabil 28Al 2,2414 min β− 4,642 28Si 29Al 6,56 min β− 3,680 29Si NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [1] Pulver

Leicht-
entzündlich(F) R- und S-Sätze R: 15-17 (nicht stabilisiert)
R: 10-15 (phlegmatisiert)
S: (2)-7/8-43 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Aluminium (Al) ist das chemische Element mit der Ordnungszahl 13. Die Bezeichnung leitet sich vom lateinischen Wort alumen für Alaun ab.
Im Periodensystem der Elemente gehört Aluminium zur Bor-Gruppe, die früher auch als Gruppe der Erdmetalle bezeichnet wurde. Aluminium ist das dritthäufigste Element und häufigste Metall in der Erdkruste. Dort tritt es wegen seiner Reaktionsfreudigkeit fast nur in chemisch gebundenem Zustand auf.
Inhaltsverzeichnis
Geschichte
Plinius berichtet als Legende, dass einst im Palast des Kaisers Tiberius, der in den Jahren 14 bis 37 n. Chr. regierte, ein Metallarbeiter erschien und ein metallisches Geschenk anbot, das äußerlich wie Silber aussah, aber auffallend leicht war. Der Kaiser fragte den Arbeiter, wo dieses Metall zu finden wäre, und erhielt die Antwort, dass jener es aus einer tonhaltigen Erde hergestellt hätte. Tiberius fragte weiter, ob sonst noch jemand um das Vorhandensein und die Herstellung dieses Metalls wüsste, worauf der Arbeiter zu seinem Unheil erwiderte, dass außer ihm nur Jupiter das Geheimnis kenne. Der Kaiser aber war von Argwohn erfasst, dass das neue Metall den Wert des Goldes und des Silbers schädigen könnte und ließ daher die Werkstatt des Geschenkgebers zerstören und denselben enthaupten, so dass die Erfindung verloren ging.
Der erste heute noch bekannte Aluminiumgegenstand ist die Gürtelschnalle des chinesischen Generals Chou-Chou (265–316), die aus Funden gediegenen Aluminiums in China angefertigt sein kann.
Sir Humphry Davy beschrieb es als „Aluminum“ und versuchte im Jahre 1808 seine Herstellung. Die gelang erstmalig Hans Christian Ørsted 1825 durch Reaktion von Aluminiumchlorid (AlCl3) mit Kaliumamalgam, wobei Kalium als Reduktionsmittel dient[2]:
Wöhler verwendete 1827 die gleiche Methode, nahm zur Reduktion jedoch metallisches Kalium und erhielt damit ein reineres Aluminium. Zu jener Zeit war der Preis von Aluminium höher als der von Gold.
Nun erinnerte man sich auch wieder des Schicksals des unglücklichen Metallarbeiters über den Plinius berichtet hatte und es verbreitete sich die Meinung, dass es sich bei diesem sagenhaften Metall um Aluminium gehandelt habe. Auch wenn ein wahrer Kern in dieser Erzählung stecken würde, so wäre es gänzlich ungeklärt, wie ein einzelner Arbeiter die technischen Schwierigkeiten hätte überwinden können, die der Aluminiumerzeugung entgegenstehen.
Henri Etienne Sainte-Claire Deville verfeinerte den Wöhler-Prozess im Jahr 1846 und publizierte ihn 1859 in einem Buch. Dadurch fiel der Aluminiumpreis innerhalb von zehn Jahren um 90 Prozent.
1886 wurde unabhängig voneinander durch Charles Martin Hall und Paul Héroult das jetzt nach ihnen benannte Elektrolyseverfahren zur Herstellung von Aluminium entwickelt: der Hall-Héroult-Prozess. Im Jahr 1889 wurde das Verfahren durch Carl Josef Bayer weiter verbessert. Aluminium wird noch heute nach diesem Prinzip großtechnisch hergestellt.
Vorkommen
Aluminium ist mit einem Anteil von 7,57 Gewichtsprozent nach Sauerstoff und Silicium das dritthäufigste Element der Erdkruste und damit das häufigste Metall.
Es gibt einige wenige Fundorte für gediegenes Aluminium: In Russland (Ostsibirien, Ural), in der Volksrepublik China (Guangdong, Guizhou und Tibet), in Aserbaidschan und in Genua (Italien). Auch auf dem Mond ist gediegenes Aluminium gefunden worden.[3]
Die größte Menge befindet sich chemisch gebunden in Form von Alumosilikaten, wo es in der Kristallstruktur die Position von Silicium in Sauerstoff-Tetraedern einnimmt. Diese Silikate sind z. B. Bestandteil von Ton, Gneis und Granit.
Seltener wird Aluminiumoxid (Korund) gefunden, in großen Kristallen bekannt als Rubin und Saphir. Die rote oder blaue Farbe dieser Kristalle beruht auf Beimengungen anderer Metalloxide.
Das einzige wirtschaftlich wichtige Ausgangsmaterial für die Aluminiumproduktion ist Bauxit. Vorkommen befinden sich in Südfrankreich (Les Baux), Guinea, Bosnien und Herzegowina, Ungarn, Russland, Indien, Jamaika, Australien, Brasilien und den USA. Bauxit enthält ca. 60 Prozent Aluminiumhydroxid (Al(OH)3 und AlO(OH)), ca. 30 Prozent Eisenoxid (Fe2O3), und Siliziumoxid (SiO2).
Gewinnung
Die industrielle Erzeugung wurde durch den Pariser Universitätsprofessor Louis Jacques Thénard veranlasst.
Da Aluminium aus den Alumosilikaten aufgrund der Bindungsverhältnisse praktisch nicht isoliert werden kann, ist eine wirtschaftliche großtechnische Gewinnung von metallischem Aluminium nur aus Bauxit möglich. Das in diesem Erz enthaltene Aluminiumoxid/-hydroxid-Gemisch wird zunächst mit Natronlauge aufgeschlossen (Bayer-Verfahren), um es von Fremdbestandteilen wie Eisen- und Siliziumoxid zu befreien und wird dann in Drehrohröfen zu Aluminiumoxid (Al2O3) gebrannt.
Der sogenannte trockene Aufschluss (Deville-Verfahren) hat dagegen keine Bedeutung mehr. Beim trockenen Aufschluss wird feinstgemahlenes Bauxit zunächst ungereinigt zusammen mit Soda und Koks in Drehrohröfen bei rund 1200 °C kalziniert, und das entstehende Natrium-Aluminat erst anschließend mit Natronlauge gelöst.
Die Herstellung von Aluminium erfolgt ausschließlich durch Schmelzflusselektrolyse von Aluminiumoxid nach dem Kryolith-Tonerde-Verfahren (Hall-Héroult-Prozess). Dafür wird das Aluminiumoxid zur Herabsetzung des Schmelzpunktes in einer Kryolithschmelze aufgelöst. Der Prozess ist aufgrund der hohen Bindungsenergie des Aluminiums und seiner Dreiwertigkeit recht energieaufwändig. Der Energieeinsatz liegt bei 13 bis 15 kWh elektrischen Stroms pro produziertem Kilogramm Roh-Aluminium.
Bei der Elektrolyse entsteht an der den Boden des Gefäßes bildenden Kathode Aluminium und an der Anode Sauerstoff, der mit dem Graphit (Kohlenstoff) der Anode zu Kohlendioxid und Kohlenstoffmonoxid reagiert.
Die Graphitblöcke, welche die Anode bilden, brennen wegen des im Prozess entstehenden Sauerstoffs langsam ab und werden von Zeit zu Zeit ersetzt. Die Graphit-Kathode (Gefäßboden) ist gegenüber dem Aluminium inert. Das sich am Boden sammelnde flüssige Aluminium wird mit einem Saugrohr abgesaugt.
Die Aluminiumherstellung ist nur in der Nähe preiswert zur Verfügung stehender Elektroenergie (z. B. bei Wasserkraftwerken) wirtschaftlich.
Eigenschaften
Das reine Leichtmetall Aluminium hat aufgrund einer sich sehr schnell an der Luft bildenden dünnen Oxidschicht ein stumpfes, silbergraues Aussehen. Diese undurchdringliche Oxidschicht macht reines Aluminium sehr korrosionsbeständig, sie erreicht eine Dicke von ca. 0,05 µm[4].
Diese Oxidschicht schützt auch vor weiterer Oxidation, ist aber bei der elektrischen Kontaktierung und beim Schweißen hinderlich. Sie kann durch elektrische Oxidation (Eloxieren) oder auf chemischem Weg verstärkt werden.
Die Oxidschicht kann mittels Komplexbildungsreaktionen aufgelöst werden. Einen außerordentlich stabilen und wasserlöslichen Neutralkomplex geht Aluminium in neutraler chloridischer Lösung ein. Folgende Reaktionsgleichung veranschaulicht den Vorgang:
Dies geschieht vorzugsweise an Stellen, wo die Oxidschicht des Aluminiums bereits geschädigt ist. Es kommt dort durch Bildung von Löchern zur Lochfraßkorrosion. Kann die chloridische Lösung dann an die freie Metalloberfläche treten, so laufen andere Reaktionen ab. Aluminium-Atome können unter Komplexierung oxidiert werden:
Liegen in der Lösung Ionen edlerer Metalle vor, so werden sie reduziert und am Aluminium abgeschieden. Auf diesem Prinzip beruht die Reduktion von Silberionen, die auf der Oberfläche von angelaufenem Silber als Silbersulfid vorliegen, hin zu Silber.
Aluminium reagiert heftig mit Natriumhydroxid unter Bildung von Wasserstoff. Diese Reaktion wird in chemischen Rohrreinigungsmitteln ausgenutzt. Mit Brom reagiert Aluminium bei Zimmertemperatur unter Flammenerscheinung. Hierbei ist zu beachten, dass das entstehende Aluminiumbromid mit Wasser unter Bildung von Aluminiumhydroxid und Bromwasserstoffsäure reagiert.
Mit Quecksilber bildet Aluminium ein Amalgam. Wenn Quecksilber direkt mit Aluminium zusammenkommt (d. h. wenn die Aluminiumoxidschicht an dieser Stelle mechanisch zerstört wird), frisst das Quecksilber Löcher in das Aluminium; unter Wasser wächst dann darüber Aluminiumoxid in Gestalt eines kleinen Blumenkohls.
Aluminium ist ein relativ weiches und zähes Metall, die Zugfestigkeit von purem Aluminium liegt bei 49 MPa, die von seinen Legierungen bei 300–700 MPa. Seine Steifigkeit liegt je nach Legierung bei etwa 70.000 MPa. Es ist dehnbar und kann durch Auswalzen zu dünner Folie verarbeitet werden. Sogenannte Aluminium-Knetlegierungen lassen sich auch bei niedrigen Temperaturen gut verformen, biegen, pressen und schmieden. Durch Kaltverformen entstandene Spannungen können durch Weichglühen (bis 250 °C) beseitigt werden. Auch Duraluminium ist bei dieser Temperatur verformbar.
Legierungen mit 1–3 % Magnesium oder Silizium lassen sich gut gießen (Aluminium-Druckguss) und spanabhebend bearbeiten.
Bei einer Sprungtemperatur von 1,2 K wird reines Aluminium supraleitend.
Der Schmelzpunkt liegt bei 660,4 °C und der Siedepunkt bei 2467 °C. Die Dichte von 2,7 g/cm3 bei Aluminium zeigt den Typus als Leichtmetall deutlich.
Verwendung
In den letzten Jahren kam es zu einem deutlichen Preisanstieg von Aluminium am Weltmarkt (Stand Mai 2008: ca. 1.800 Euro/Tonne bei 99,7 % Reinheit)[5]
Konstruktionswerkstoff
Wegen seiner geringen Dichte wird Aluminium gern dort verwendet, wo es auf die Masse ankommt, die z. B. bei Transportmitteln zum Treibstoffverbrauch beiträgt, vor allem in der Luft- und Raumfahrt. Auch im Fahrzeugbau gewann es aus diesem Grund an Bedeutung; hier standen früher der hohe Materialpreis, die schlechtere Schweißbarkeit sowie die problematische Dauerbruchfestigkeit und die Verformungseigenschaften bei Unfällen (geringes Energieaufnahmevermögen in der sogenannten Knautschzone) im Wege. Mit dem Space Frame-Konzept hat Audi hierfür Lösungen gefunden und in den Modellen A8 sowie A2 realisiert.
In Legierungen mit Magnesium, Silicium und anderen Metallen werden Festigkeiten erreicht, die denen von Stahl nur wenig nachstehen. Daher ist die Verwendung von Aluminium zur Gewichtsreduzierung überall dort angebracht, wo Materialkosten eine untergeordnete Rolle spielen. Insbesondere im Flugzeugbau und in der Weltraumtechnik ist Aluminium und Duraluminium weit verbreitet. Der größte Teil der Struktur heutiger Verkehrsflugzeuge wird aus Aluminiumblechen verschiedener Stärken und Legierungen genietet. Jedoch wird Aluminium bei den neusten Modellen (Boeing 787, Airbus A350) größtenteils durch das noch leichtere CFK verdrängt.
Aluminium lässt sich durch Strangpressen in komplizierte Profile formen, hierin liegt ein großer Vorteil bei der Fertigung von Hohlprofilen (Automatisierungstechnik, Messebau), Kühlkörperprofilen oder in der Antennentechnik.
Mit Aluminium werden Heizelemente von Bügeleisen und Kaffeemaschinen umpresst.
Aluminium-Gussteile können durch Druckguss in komplizierten Formen gefertigt werden, die spanende Nachbearbeitung ist gut möglich.
Bevor es gelang, Zinkblech durch Titanzusatz als sog. Titanzink verarbeitbar zu machen, wurde Aluminiumblech für Fassaden- und Dachelemente sowie Dachrinnen eingesetzt.
Elektrotechnik
 Aluminium-Umguss am Käfigläufer-Blechpaket (zylindrisches Teil in der Mitte) eines Spaltpolmotors. Die Aluminium-Käfigstäbe verlaufen im Inneren. An den Stirnseiten sind zusätzlich Lüfterflügel mitgegossen. Obere Wicklung und Lagerschalen des Motors sind entfernt.
Aluminium-Umguss am Käfigläufer-Blechpaket (zylindrisches Teil in der Mitte) eines Spaltpolmotors. Die Aluminium-Käfigstäbe verlaufen im Inneren. An den Stirnseiten sind zusätzlich Lüfterflügel mitgegossen. Obere Wicklung und Lagerschalen des Motors sind entfernt.Aluminium ist ein guter elektrischer Leiter: Aluminium leitet Strom je Gramm Masse besser als Kupfer, ist aber voluminöser als dieses, so dass Kupfer je Quadratzentimeter Leitungsquerschnitt Strom besser leitet als Aluminium. Weil Kupfer reaktionsträger und die Verarbeitung weniger problematisch als bei Aluminium ist, wird meistens Kupfer verwendet und Aluminium nur, wenn es auf das Gewicht ankommt.
Aluminium wird insbesondere dann als Leitermaterial für elektrischen Strom im Stromnetz verwendet, wenn es sich um starre und dicke Leitungen handelt (Stromschienen, Erdkabel). Hier bietet es Kostenvorteile gegenüber Kupfer.
Beim Kontaktieren ist aber problematisch, dass Aluminium unter dem Druck der Kontaktierung zum Kriechen neigt und sich an Luft spontan mit einer Oxidschicht (Selbstpassivierung) überzieht, die vor der Kontaktierung beseitigt werden muss. Daher fand Aluminium nur vorübergehend ab den 1960er-Jahren Anwendung als Leitermaterial in Gebäudeinstallationen – aufgrund ungeeigneter Klemmen kam es zu Ausfällen und sogar Bränden aufgrund sich lösender Kontakte. Crimpverbindungen mit passenden Hülsen und Werkzeugen sind jedoch sicher. Als Zwischenlage zwischen Kupfer und Aluminium können Verbindungsstücke aus Cupal die Kontaktprobleme vermeiden.
Vorübergehend gab es für Hausinstallationen sogenannte „Alcu“-Kabel, bei diesen sollte eine Verkupferung der Aluminiumadern zu besserer Kontaktgabe führen – das Kriechen beim hohen Kontaktdruck einer Schraubklemme konnte jedoch auch dadurch nicht beseitigt werden.
Hervorzuheben ist das geringe Absinken der spezifischen elektrischen Leitfähigkeit von Aluminium bei Zusatz von Legierungsbestandteilen, wohingegen Kupfer bei Verunreinigungen eine stark absinkende Leitfähigkeit zeigt.
Aluminium wird daher nicht nur zu Stromschienen in Umspannwerken, sondern auch zu stromführenden Gussteilen verarbeitet.
Aluminium wird auch in Überlandleitungen (Freileitungen) als Leitungsmaterial verwendet – die geringe Dichte ist hier ausschlaggebend. Kupferleitungen mit der gleichen Leitfähigkeit hätten zwar einen geringeren Querschnitt, jedoch etwa die doppelte Masse. Aus dem gleichen Grund werden im Airbus A380 ebenfalls Aluminiumkabel verwendet.
Für Oberleitungen ist es dagegen aufgrund seiner schlechten Kontakt- und Gleiteigenschaften ungeeignet.
Aluminium wird zur Fertigung von Kurzschlussläufern von Asynchronmotoren verwendet, indem deren Blechpakete umgossen werden.
Elektronik
 Aluminium als Leitermaterial für Bonddrähte und Metallisierung in einem Bipolartransistor
Aluminium als Leitermaterial für Bonddrähte und Metallisierung in einem BipolartransistorDie Elektronikindustrie setzt Aluminium aufgrund der guten Verarbeitbarkeit und der guten elektrischen Leitfähigkeit und Wärmeleitfähigkeit ein.
Bonddrähte (Verbindungsdrähte zwischen Chip und Gehäuseanschluss) bestehen insbesondere bei Leistungshalbleitern aus Aluminium.
Die Leiterbahnen integrierter Schaltkreise und von Leistungshalbleitern bestehen oft ebenfalls aus Aluminium.
Wegen seiner hohen Wärmeleitfähigkeit wird Aluminium als Werkstoff für Wärmeübertrager (Kühler), stranggepresste Kühlprofile und wärmeableitende Grundplatten verwendet (bei höherwertigen Kühlern wird allerdings wegen der höheren Wärmeleitfähigkeit Kupfer eingesetzt).
Aluminium-Elektrolytkondensatoren verbauen Aluminium als Elektrodenmaterial und Gehäusewerkstoff.
Aluminium wird zur Herstellung von Antennen und Hohlleitern verwendet.
Verpackung und Behälter
In der Verpackungsindustrie wird Aluminium zu Getränke- und Konservendosen sowie zu Aluminiumfolie und weiteren Einwegartikeln verarbeitet. Durch Bedampfung lassen sich Folien mit einer 0,1–1 µm dünnen Schicht versehen, was eine hohe Barrierefunktion zur Folge hat. Außerdem werden Aluminiumfolien gerne in Verbundsystemen eingesetzt, beispielsweise in Tetrapacks. Aus Aluminium werden auch Kochtöpfe sowie Reise- und Militär-Geschirr hergestellt. Die Aufbewahrung und Zubereitung von säurehaltigen Lebensmitteln in Aluminiumbehältern bzw. -folie ist problematisch, da es dabei lösliche Aluminiumsalze bildet, die mit der Nahrung aufgenommen werden. Aluminiumschichten in Verpackungsmitteln werden daher häufig durch eine Kunststoffschicht geschützt.
Aluminium wird für eine Vielzahl von Behältern und Gehäusen verarbeitet, da es sich gut durch Umformen bearbeiten lässt. Gegenstände aus Aluminium werden häufig durch eine Eloxalschicht geschützt.
Optik und Lichttechnik
Aluminium wird aufgrund seines hohen Reflexionsgrades als Spiegelbeschichtung von Oberflächenspiegeln, u. a. in Scannern, Kraftfahrzeug-Scheinwerfern und Spiegelreflexkameras eingesetzt. Es reflektiert im Gegensatz zu Silber auch Ultraviolettstrahlung. Aluminium-Spiegelschichten werden meist durch eine Schutzschicht vor Korrosion und Kratzern geschützt.
Weitere Anwendungen
 3 Aluminium-Kursmünzen aus Vietnam, um 1970, Motiv: Reispflanze
3 Aluminium-Kursmünzen aus Vietnam, um 1970, Motiv: ReispflanzeAluminium ist Bestandteil einer Lebensmittelfarbe (E173) und findet bei Überzügen von Zuckerwaren und zur Dekoration von Kuchen und feinen Backwaren Verwendung.[6]
Farbig eloxiert ist es Bestandteil vieler Dekorationsmaterialien wie Flitter, Geschenkbänder und Lametta. In Pulverform (Partikelgröße < 500 µm) ist Aluminium vor allem dann, wenn es nicht phlegmatisiert ist, aufgrund seiner großen Oberfläche sehr reaktiv. Aluminium reagiert dann mit Wasser unter Abgabe von Wasserstoff zu Aluminiumoxid.
Aluminiumpulver und Aluminiumpasten werden auch zur Herstellung von Porenbeton eingesetzt.
Ebenso ist es für die stark exotherme (bis zu 2500 °C) Thermit-Reaktion beim aluminothermischen Schweissen, mit Hilfe von Eisen(III)-oxid, unerlässlich.
Nicht phlegmatisierter Aluminiumstaub ist sehr gefährlich und entzündet sich bei Luftkontakt explosionsartig von selbst. Mischungen aus Aluminiumstaub und Luft sind stark explosiv.
In der Raketentechnik besteht der Treibstoff von Feststoffraketen zu maximal 30 % aus Aluminiumpulver, das bei seiner Verbrennung viel Energie freisetzt.[7]
Zur Beschichtung von Oberflächen wird es beim Aluminieren verwendet.
Verarbeitungsverfahren
Aluminium wird meist legiert verwendet. Es gibt eine Vielzahl von Legierungen, die entweder gute Verformbarkeit oder gute Gießbarkeit und spanende Bearbeitbarkeit zeigen.
Aluminium wird durch Gießen bzw. Umformen in Aluminiumgießereien nach folgenden Gießverfahren verarbeitet:
- Sandguss
- Strangguss
- Druckguss bzw. Aluminiumdruckguss
- Feinguss
- Kokillenguss (ggf. mit Sandkern)
- Bandguss
- Sprühkompaktieren
Hierbei werden Verfahren unterschieden, die der Herstellung (fast) fertiger Bauteile dienen (z. B. Sandguss, Druckguss, Feinguss) und solchen, die Rohmaterial für die Weiterverarbeitung zu Halbzeug wie Blechen und Strangpressprofilen liefern (z. B. Strangguss). Sprühkompaktieren und Bandguss nehmen eine Sonderstellung ein.
Die Herstellung von Halbzeug oder Bauteilen geschieht aus Vormaterial wie z. B. Walzbarren, Blech oder Ronden durch Umformen:
- Strangpressen
- Walzen
- Schmieden
- Floatforming (Fließpressen)
- Tiefziehen
- Rollen
- Cobapress
Die spanende Bearbeitung birgt die Gefahr einer Aufbauschneide und erfordert spezielle Kühlschmiermittel. Aluminium kann daher auch nur mit speziellen Schleifscheiben geschliffen werden.
Insbesondere die Bearbeitung von eloxierten Werkstücken erfordert harte Werkzeuge, um Verschleiß durch die harte Eloxalschicht zu vermeiden.
Aluminium in Natur und Organismen
Aluminium ist eines der wenigen reichlich vorhandenen Elemente, die anscheinend von Lebewesen nicht genutzt werden. Der Grund könnte darin liegen, dass Aluminium ursprünglich, als sich das Leben im Meer entwickelte, im Meerwasser in gelöster Form fast überhaupt nicht vorhanden war und somit von dem sich entwickelnden Leben nicht genutzt werden konnte. Erst im Laufe der Jahrmilliarden wurde Aluminium allmählich durch Flüsse im Meer angereichert, obwohl auch heute noch die Konzentration im Meer sehr gering ist.
Aluminium in Form verschiedener Salze (Phosphate, Silikate) ist Bestandteil von vielen Pflanzen und Früchten, denn gelöste Al-Verbindungen werden durch Regen aus den Böden von den Pflanzen aufgenommen, bei Säurebelastung der Böden ist dies vermehrt der Fall.
Aluminium in Lebensmitteln
Die meisten Lebensmittel enthalten als Spurenelemente auch Aluminium.[8] Gemüse enthält gewöhnlich 100-400mg/kg Aluminium, so kommt es je nach Ernährungsgewohnheiten zu einer täglichen Aufnahme von 2-160mg. Beim Kochen oder Aufbewahren in Aluminiumgeschirr oder in Alufolie kann es (außer bei sauren Lebensmitteln) nur zu einer mittleren Zunahme von 5-30mg/kg kommen, was unbedenklich ist.
Aluminiumchlorid findet aufgrund seiner stark adstringierenden Wirkung Verwendung als Antitranspirant, wobei die dermale Aufnahme vernachlässigbar gering ist.
Aluminiumhydroxid ist Bestandteil einiger Antacida. Die Resorptionsquote aus diesen Präparaten liegt bei ca. 1%.
Aluminiumsilikat ist Bestandteil einer Lebensmittelfarbe (E173), findet in feinen Backwaren Verwendung und ist in Backpulver, Schmelzkäse, sowie sauer eingelegten Gemüsekonserven enthalten und gegen Verklumpen in Kaffeeweißern, Speisesalz und Gewürzen.
Aluminiumhaltige Effekt-Pigmente werden als Nagellack, bei Überzügen von Zuckerwaren und zur Dekoration von Kuchen verwendet.
Bei der Untersuchung von Laugengebäck (Brezeln, Stangen, Brötchen) aus Bäckereien wurde Aluminium nachgewiesen, das in das Lebensmittel gelangt, wenn bei der Herstellung von Laugengebäck Aluminiumbleche verwendet werden.[9]
Physiologie
Obwohl Aluminium das häufigste Metall der Erdkruste ist, gibt es in Säugetieren keine aluminiumabhängigen Reaktionen, es ist also nicht essentiell.
Gesunde Menschen scheiden Aluminium nach Einnahme relativ hoher Dosen (1-4g pro Tag) problemlos renal aus. Aufgrund dieser Toxikokinetik ist es verständlich, dass Aluminiumvergiftungen nur bei eingeschränkter Nierenfunktion auftreten. Die drei wichtigsten toxischen Wirkungen sind Anämie (weil es dieselben Speichereiweiße wie Eisen besetzt), Osteopathie (Arthritis) und Enzephalopathie (Gedächtnis- und Sprachstörungen, Antriebslosigkeit und Aggressivität).
Laut neuesten Untersuchungen des Bundesinstituts für Risikobewertung (BfR) besteht kein Zusammenhang zwischen der Aluminiumaufnahme aus Lebensmittelbedarfsgegenständen und der Alzheimer-Krankheit.[10]
Einige Prozent der Bevölkerung reagieren auf Aluminium allergisch – sie erleiden Ausschläge in jeder möglichen Form durch Verwenden von Antitranspirationsprodukten, Verdauungsstörungen und Unfähigkeit, Nährstoffe aus der Nahrung aufzunehmen, die in Aluminiumtöpfen gekocht wurde, oder Erbrechen und anderen Vergiftungserscheinungen durch Einnehmen aluminiumhaltiger Medikamente.
Aspekte des Umweltschutzes
Die Herstellung von Aluminium ist sehr energieaufwändig. Allein für die Elektrolyse, die zum Gewinn einer Tonne Aluminiums nötig ist, werden 14.000 kWh elektrische Energie benötigt. Anschaulich formuliert benötigt die Elektrolyse eines Kilogramms Roh-Aluminium für eine Autofelge soviel Strom wie der Betrieb eines 24-Zoll-LCD-Flachbildschirms (ca. 50 Watt) in einem Monat, wenn er täglich 8 Stunden leuchtet. Bei der Stromerzeugung für das eine Kilogramm Aluminium werden im deutschen Kraftwerkspark 8,4 kg CO2 freigesetzt. Diese Werte für Roh-Aluminium erhöhen sich noch durch Transport- und Verarbeitungsanteile für das Wiederaufschmelzen, Gießen, Schleifen, Bohren, Polieren etc. bis ein Konsumgut aus Aluminium entsteht. Durch den Abbau des Erzes Bauxit werden große Flächen in Anspruch genommen, die erst nach einer Rekultivierung wieder nutzbar werden. Bei der Herstellung des Aluminiumoxids nach dem Bayer-Verfahren entsteht pro Kilogramm Aluminium ca. 1,5 kg eisenreicher, alkalischer Rotschlamm.
Positiv ist hingegen die gute Wiederverwendbarkeit von Aluminium hervorzuheben, wobei die Reststoffe streng getrennt erfasst und gereinigt werden müssen (Aluminiumrecycling). Durch Leichtbau mit Aluminiumwerkstoffen (beispielsweise Aluminiumschaum, Strangpressprofile) wird Masse von beweglichen Teilen und Fahrzeugen gespart, was zur Einsparungen von Treibstoff führt.
Aluminium ist durch seine Selbstpassivierung korrosionsfester als Eisen und erfordert daher weniger Korrosionsschutzmaßnahmen.
Nachweis
Aluminiumsalze weist man durch Glühen mit verdünnter Kobaltnitratlösung auf der Magnesia-Rinne nach. Dabei entsteht das Pigment Thénards Blau (auch Kobaltblau oder Cobaltblau, Dumonts Blau, Coelestinblau, Leithners Blau, Cobaltaluminat). Es ist ein Cobaltaluminiumspinell mit der Formel CoAl2O4. Diese Nachweisreaktion wurde 1795 von Leithner durch Glühen von Aluminiumsulfat und Cobalt(II)-nitrat (Co(NO3)2) entdeckt.
Nachweis mittels Kryolithprobe
Die Probelösung wird alkalisch gemacht, um Aluminium als Aluminiumhydroxid Al(OH)3 zu fällen. Der Niederschlag wird abfiltriert und mit einigen Tropfen Phenolphthalein versetzt, dann gewaschen, bis keine Rotfärbung durch Phenolphthalein mehr vorhanden ist. Anschließend festes Natriumfluorid (NaF) auf den Niederschlag streuen: Es bildet sich eine Rotfärbung durch Phenolphthalein, verursacht von freigesetzten Hydroxidionen bei der Bildung von Kryolith Na3[AlF6].
Nachweis als fluoreszierender Morinfarblack
Die Probe wird mit Salzsäure (HCl) versetzt und eventuell vorhandenes Aluminium somit gelöst. Anschließend wird die Probelösung mit Kaliumhydroxid (KOH) stark alkalisch gemacht. Gibt man nun einige Tropfen der Probelösung zusammen mit der gleichen Menge Morin-Lösung auf eine Tüpfelplatte und säuert anschließend mit konzentrierter Essigsäure (Eisessig, CH3COOH) an, so ist unter UV-Strahlung (λ = 366 nm) eine grüne Fluoreszenz beobachtbar. Der Nachweis ist dann sicher, wenn diese Fluoreszenz bei Zugabe von Salzsäure wieder verschwindet.
Grund hierfür ist, dass Al(III) in neutralen sowie essigsauren Lösungen in Verbindung mit Morin eine fluoreszierende kolloidale Suspension bildet.
Aluminiumlegierungen
Hauptartikel: Aluminiumlegierung
Aluminium kann im schmelzflüssigen Zustand mit Kupfer, Magnesium, Mangan, Silizium, Eisen, Titan, Beryllium, Lithium, Chrom, Zink, Zirkon und Molybdän legiert werden, um bestimmte Eigenschaften zu fördern oder andere, ungewünschte Eigenschaften zu unterdrücken.
Bei den meisten Legierungen ist jedoch die Bildung der schützenden Oxidschicht (Passivierung) stark gestört, wodurch die daraus gefertigten Bauteile teils hochgradig korrosionsgefährdet sind. Nahezu alle hochfesten Aluminiumlegierungen sind von dem Problem betroffen.
Es gibt Aluminiumknetlegierungen (AW, engl. wrought), zum Beispiel AlMgMn, und Aluminiumgusslegierungen (AC, engl. cast). Aluminiumgusslegierungen werden z. B. für Leichtmetallfelgen verwendet.
Im Allgemeinen werden Aluminiumlegierungen nach dem System der AA (Aluminum Association) bezeichnet:
- Aluminiumgusslegierungen – Herstellung von Motoren- und Getriebegehäusen. Typische Aluminiumgusslegierungen sind: AlSi, AlSiCu, AlSiMg, AlCuTi, AlMg
- Aluminiumknetlegierungen – Platten und Bandproduktion durch Warm- und Kaltumformen (Walzen, Strangpressen, Schmieden).
- Typische „naturharte“ Aluminiumknetlegierungen sind: AlMg, AlMn, AlMgMn, AlSi
- „Aushärtbare“ Knetlegierungen – Festigkeitssteigerung durch Ausscheidung von Legierungselementen bei einer zusätzlichen Alterungsglühung bei 150 bis 190 °C. Typische „aushärtbare“ Aluminiumknetlegierungen sind: AlMgSi, AlCuMg, AlZnMg, AlZnMgCu. Die erste hochfeste, aushärtbare Aluminiumlegierung AlCuMg bekam 1907 den Markennamen Duraluminium.
Verbindungen
- Aluminiumoxid Al2O3 (engl. alumina), auch als Tonerde oder Korund bekannt, liegt als weißes Pulver oder in Form sehr harter Kristalle vor. Es ist das Endprodukt des Bayer-Verfahrens und dient in erster Linie als Ausgangsmaterial für die Aluminiumgewinnung (Schmelzflusselektrolyse). Es wird darüber hinaus als Schleif- oder Poliermittel und für Uhrensteine, Ziehsteine und Düsen verwendet. In keramischer Form dient es als Isolierstoff, Konstruktionskeramik, als Substratmaterial für Dickschichtschaltkreise, als Grundplatte von Leistungshalbleitern und in transparenter Form als Entladungsgefäß von Natriumdampf-Hochdrucklampen.
- Aluminiumhydroxid Al(OH)3 wird ebenfalls nach dem Bayer-Verfahren gewonnen und ist das wichtigste Ausgangsmaterial zur Erzeugung anderer Al-Verbindungen, vor allem für Aluminate. Als reines Produkt wird es als Füllstoff und zum Brandschutz in Kunststoffen und Beschichtungen eingesetzt.
- Aluminiumchlorid, Polyaluminiumchlorid und Aluminiumsulfat werden vor allem als Flockungsmittel in der Wasseraufbereitung, Abwasserreinigung und der Papierindustrie eingesetzt.
- Natriumaluminat NaAl(OH)4 wird ebenfalls als Flockungsmittel verwendet und ist weiterhin Rohstoff für die Zeolith-Produktion, Titandioxid-Beschichtung und Calciumaluminatsulfat-Herstellung.
- Alumosilikate (Zeolithe) als Ionenaustauscher, in Waschmitteln und in Lebensmitteln.
- Aluminiumkaliumsulfat-Dodecahydrat KAl(SO4)2 · 12 H2O, bekannt als „Alaun“ zum Blutstillen.
- Aluminiumdiacetat, bekannt als essigsaure Tonerde für entzündungshemmende Umschläge.
- Aluminiumorganische Verbindungen – Triethylaluminium u. v. m. – werden im großtechnischen Maßstab als Katalysatoren in der Polyethylen-Herstellung eingesetzt. Ein weiteres Anwendungsgebiet ist die Halbleitertechnik. Hier werden flüchtige Aluminiumalkyle (Trimethylaluminium, Triethylaluminium etc.) als Vorstufen zur CVD (chemical vapor deposition)- Abscheidung von Aluminiumoxid verwendet, das man als Isolator und Ersatz für das nicht ausreichend isolierende Siliciumdioxid einsetzt.
- Bei der Aluminothermie wird Aluminium zur Gewinnung anderer Metalle und Halbmetalle verwendet (siehe auch Thermitverfahren).
- Aluminiumoxynitrid ist ein transparenter keramischer Werkstoff.
- Aluminiumnitrid ist ein Konstruktions- und Isolationswerkstoff und zeichnet sich durch sehr hohe Wärmeleitfähigkeit bei Raumtemperatur aus. Außerdem könnte die hohe Bandlücke die Anwendung als wide-bandgap-Halbleiter ermöglichen.
Unter besonderen Bedingungen tritt Aluminium auch einwertig auf. Diese Verbindungen werden zur Gewinnung von hochreinem Aluminium genutzt (Subhalogeniddestillation).
Siehe auch
Einzelnachweise
- ↑ Eintrag zu CAS-Nr. 7429-90-5 im European chemical Substances Information System ESIS
- ↑ Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9
- ↑ Aluminium bei mindat.org (engl.)
- ↑ Eloxalwerk Ludwigsburg: [1]
- ↑ London Metal Exchange: Primary Aluminium
- ↑ Datenbank für Lebensmittelzusatzstoffe
- ↑ Chemische Raketentreibstoffe
- ↑ Aluminium in Lebensmitteln: lebensmittel.org
- ↑ Chemisches und Veterinäruntersuchungsamt Karlsruhe: Laugengebäck: Wie gelangt Aluminium in das Gebäck?. 2004
- ↑ Bundesinstituts für Risikobewertung: Keine Alzheimer-Gefahr durch Aluminium aus… (PDF-Datei)
Weblinks
- Newsseite des Gesamtverbands der Aluminiumindustrie e.V.
- aluMATTER, ein interaktives E-Learning-Tool über Aluminium Werkstoffkunde, Fertigung und Anwendungen, in 4 Sprachen umschaltbar – daher auch gut geeignet als Fachwortlexikon
- Preis-Entwicklung des Rohstoffs Aluminium seit 1992
- technischer Abriss Alu-Herstellung
- elektrochemische Experimente mit Aluminium
- die Enzyklopädie zum Thema Aluminium
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.

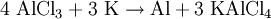


 + 2\ OH^-(aq)}](/pictures/dewiki/101/e3f31a86b9312757cd54b01f3098dd58.png)
 + 3\ e^- + 2\ H_3O^+(aq)}](/pictures/dewiki/50/244691c1d155df31706e2f64bb7df4ee.png)