- Entkarbonisierung
-
Als Entcarbonisierung (auch: Entkarbonisierung) werden Verfahren der Wasseraufbereitung bezeichnet, bei denen zur Verminderung der Wasserhärte die Carbonathärte (temporäre Härte), jedoch nicht die permanente Härte des Wassers vermindert oder beseitigt wird.
Wässer mit zu hoher Carbonathärte sind für die Verwendung als Kühl- und Prozesswasser ohne vorherige Aufbereitung schlecht geeignet. Erwärmung des Wassers führt zur Fällung von Calciumcarbonat (Kesselstein), was zu vielfältigen Schädigungen in Rohrsystemen und auf Oberflächen von Wärmeaustauschern führt. Trinkwässer mit Carbonathärte deutlich über 5–8 °dH sind für viele praktische Verwendungen nachteilig.
Inhaltsverzeichnis
Verfahren
Für die teilweise oder weitgehende Verminderung der Carbonathärte von Wässern wurden verschiedene Verfahren entwickelt. Mit einigen Verfahren kann nur die Carbonathärte entfernt und mit anderen auch die Gesamthärte. Die wichtigsten Verfahren für die Entcarbonisierung werden im folgenden erklärt.
Entcarbonisierung durch Zusatz von Säuren
Durch die Dosierung von Salz- oder Schwefelsäure wird die Carbonathärte in permanente Härte entsprechend der folgenden Reaktionsgleichung umgewandelt:
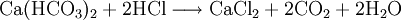
- Calciumanteil der Carbonathärte, also das gelöste Calciumhydrogencarbonat und Salzsäure reagieren zu gelöstem Calciumchlorid und gelöstem Kohlenstoffdioxid, der so genannten freien Kohlensäure.
Der Vorteil dieses Verfahrens ist der geringe apparative Aufwand. Durch die gebildete freie Kohlensäure sind diese Wässer für viele Werkstoffe aber korrosiv. Vor einer Verwendung als Brauchwasser muss die aggressive freie Kohlensäure deshalb möglichst weitgehend entfernt werden. Dies geschieht zum Beispiel, indem das Zusatzwasser vor dem Kühlturm in den Kühlkreislauf eingespeist wird.
Nachteilig bei diesem Verfahren ist, dass der Gesamtsalzgehalt praktisch unverändert bleibt, da die Carbonat- in Nichtcarbonathärte umgewandelt wird. Bei der Verwendung von Schwefelsäure ist die Bildung des relativ schwer löslichen Calciumsulfat-Dihydrates (Gips) zu beachten, das deshalb die Anwendung dieser Säure begrenzt.
Kalkentcarbonisierung
Bei der Kalkentcarbonisierung wird Kalkmilch (normalerweise eine Aufschlämmung von Calciumhydroxid (Kalkhydrat) in Wasser) dem Wasser zudosiert und dadurch Calciumcarbonat entsprechend der folgenden Gleichung ausgefällt:
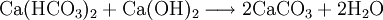
- Calciumanteil der Carbonathärte und Calciumhydroxid reagieren zu Calciumcarbonat und Wasser.
Man unterscheidet zwei unterschiedliche Verfahren und zwar die Langzeit-Entcarbonisierung und die Schnell-Entcarbonisierung.
Bei der Langzeit-Entcarbonisierung wird das gebildete Calciumcarbonat als Schlamm ausgefällt. Dies geschieht in drucklosen Reaktoren auch Klärbehälter/Klärer oder Flocker genannt. Häufig wird neben der Kalkmilch auch ein Flockungsmittel, zum Beispiel Eisen(III)-chlorid, und ein Flockungshilfsmittel zugesetzt. Hierdurch wird die Klärung, das heißt das Absetzverhalten der ungelösten Substanzen, erhöht und verbessert. Bei verschmutzten Oberflächenwässern werden neben dem gebildeten Calciumcarbonat auch die Feststoffe und kolloidale Verunreinigungen des Rohwassers im Schlamm mit abgeschieden.
Zu beachten bei der Kalkentcarbonisierung ist, dass überwiegend nur Calciumcarbonat ausgeschieden wird. Magnesium-Ionen werden wegen der deutlich größeren Löslichkeit des Magnesiumcarbonates nicht ausgefällt. Durch einen höheren Zusatz an Kalkmilch könnte zwar schwer lösliches Magnesiumdihydroxid gebildet werden. Dieses Hydroxid ist jedoch sehr feinflockig und neigt zudem zur zeitverzögerten Ausflockung. Auf die Fällung von Magnesium wird deshalb bei normalen Temperaturen verzichtet.
Der minimal erreichbare Gehalt an Restcarbonathärte nach der Entcarbonisierung beträgt ‹ 2 °dH. Dieser niedrige Restwert ist jedoch nur bei Rohwässern ohne nennenswerten Anteil an Magnesium-Carbonathärte erreichbar. Durch die Ausfällung des Calciumcarbonates wird der Salzgehalt vermindert und das Wasser damit teilentsalzt.
Bei der Langzeit-Entcarbonisierung nach Reaktor sind Feststoffgehalte von 3–6 mg/l erreichbar. Besonders bei Trinkwasser und einer weitergehenden Wasser-Aufbereitung erfolgt nach der Entcarbonisierung eine anschließende Filtration.
Bei der Schnell-Entcarbonisierung wird dem Rohwasser ebenfalls Kalkmilch zudosiert. Zusätzlich wird jedoch feiner Sand als Kristallisationskeime periodisch zugesetzt. Das Calciumcarbonat kristallisiert an der Oberfläche des Sandes aus und bildet feste kristallisationsaktive Carbonatkugeln, auch Hartkorn genannt. In dem von unten nach oben durchströmten Reaktoren bilden die Carbonatkugeln ein Schwebebett. Nach Erreichung von etwa 10–15 mm Durchmesser werden die Kugeln hydraulisch periodisch ausgeschleust.
Die Entcarbonisierung wird in etwa 8–20 m hohen, kegelförmigen oder zylindrischen Druckbehältern durchgeführt. Vorteilhaft bei diesem Verfahren im Vergleich zum Langzeitverfahren sind die deutlich geringeren Abmessungen bei gleicher Anlagenleistung und die Durchführung unter Druck. Die Bildung eines festen Abfallproduktes statt voluminösem Schlamm bei gleichem Rest-Carbonatgehalt ist ebenfalls ein Vorteil. Allerdings können nur relativ feststoffarme Rohwässer aufbereitet werden. Rohwässer mit höheren Gehalten an gelöstem Eisen und Mangan behindern wie höhere Feststoffgehalte die Anlagerung des Calciumcarbonates an die Oberfläche der Carbonatkugeln.
Der Feststoffgehalt nach Reaktor ist höher als bei der Langzeit-Entcarbonisierung. Eine anschließende Filtration ist deshalb fast immer vor einer Verwendung erforderlich. Bei dieser Filterung kommt es durch Nachreaktionen noch zu einer weiteren messbaren Reduzierung der Carbonathärte.
Sonstige Fällungs-Verfahren
Außer den vorstehenden aktuellen gibt es weitere ältere Verfahren, die durch neue Entwicklungen und aus wirtschaftlichen Gründen kaum oder nur noch selten angewendet werden. Zu diesen Verfahren gehören:
Heißentkieselung
Bei der Heißentkieselung, die normalerweise bei etwa 65 °C erfolgt, wird sowohl die Carbonathärte wie auch der Gehalt an Kieselsäuren in einem Wasser vermindert. Die Fällung wird mit einer Suspension von gelöschtem und gebrannten Magnohydrat durchgeführt. Die Gleichung für diese Reaktion lautet:
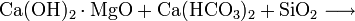
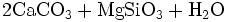
- Magnohydrat reagiert mit Carbonathärte + Kieselsäure zu ungelöstem Calciumcarbonat + Magnesiumsilikat + Wasser
Nach einer vorgeschalteten gründlichen Mischung des erwärmten Rohwassers mit der Magnohydrat-Suspension und rückgeführtem Schlamm, erfolgt die Fällung in zylindrischen Reaktoren. Nach Reaktor wird eine Filterung vorgenommen, die über eine kieselsäurefreie Masse, wie beispielsweise ungebranntes Dolomit, durchgeführt wird. An Restgehalte für die Carbonathärte und die Kieselsäure werden Werte von ‹ 2,0 °dH und ‹ 1 mg/l SiO2 erreicht.
Da Calciumcarbonat und Magnesiumsilikat ausfällt, wird auch bei der Heißentkieselung das Wasser teilentsalzt.
Kalk-Soda-Verfahren
Eines der ältesten Verfahren zur weitgehenden Entfernung der Carbonat- und Nichtcarbonathärte ist das Kalk-Soda-Verfahren. Weitere Angaben hierzu unter Wasserenthärtung.
Lauge-Fällung
Bei Verwendung von Natriumhydroxid-Lösung (Natronlauge) statt Kalkmilch sind vergleichbare Fällungen möglich. Sowohl die Langzeit- wie auch die Schnell-Entcarbonisierung können durchgeführt werden. Da Kalk aber preisgünstiger als Natronlauge ist, überwiegen bei Verwendung von Kalk die wirtschaftlichen Vorteile. Ein weitere Nachteil ist die teilweise Umsalzung statt der reinen Teilentsalzung, da ein Teil des CO2 aus der Carbonathärte in gelöstes Natriumcarbonat umgewandelt wird.
Wasserstoff-Entcarbonisierung
Wird auch H-Entcarbonisierung (H von Hydrogenium/Wasserstoff) genannt. Bei diesem Verfahren werden Kationenaustauschharze für die Reduzierung der Carbonathärte verwendet. Hierbei werden die Erdalkali-Ionen der Hydrogencarbonate (= Carbonathärte) von den Säuregruppen der Ionenaustauschharze gegen Abgabe des Wasserstoffes entsprechend der nachfolgenden Reaktionsformel ausgetauscht:
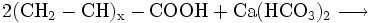
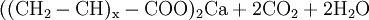
- Carbonsäuregruppe des schwach sauren Acrylatharzes reagiert mit Calciumanteil der Carbonathärte zum Calciumsalz des Harzes, Kohlendioxid und Wasser
Der Vorgang dieser Entcarbonisierung ist vergleichbar mit der Säuredosierung. Das entcarbonisierte Wasser enthält den stöchiometrischen Gehalt an freier aggressiver Kohlensäure. Da jedoch keine gelöste Erdalkaliverbindung gebildet wird, erfolgt keine Umsalzung. Entsprechend der Reduzierung der Carbonathärte wird das Wasser teilentsalzt. Im Gegensatz zur Kalk-Entcarbonisierung werden bei diesem Verfahren auch eventuelle Magnesiumanteile der Carbonathärte problemlos entfernt.
Technische Anwendungen
Die aufgeführten Verfahren werden sowohl für die Umsalzung und Teilentsalzung von Rohwässern vor der Verwendung, wie auch als Vorstufe für eine weitergehende Entsalzung eingesetzt. Besonders die Kalk-Entcarbonisierung wird, da Kalkhydrat relativ preisgünstig ist, aus wirtschaftlichen Gründen häufig als Vorstufe größeren Entsalzungsanlagen vorgeschaltet. Weiterhin wird eine stärkere Aufsalzung der anfallenden Abwässer vermieden, da festes Calciumcarbonat abgetrennt wird.
Die Zusatzwässer für größere Brauch- und Kühlwassersysteme in der Industrie und Großkraftwerken werden – falls erforderlich – überwiegend kalkentcarbonisiert.
Dies gilt auch für Anlagen zur Trinkwasseraufbereitung sofern eine Entcarbonisierung vorgenommen wird. Dies ist bei Wässern des Härtebereiches IV – (GH › 3,8mol/l) – sinnvoll. Allerdings wurde auch ein H-Entcarbonisierungs-Verfahren (Carix-Verfahren) entwickelt und in die Praxis eingeführt, bei dem die Ionenaustauschharze mit Kohlensäure regeneriert werden.
Die Heißentkieselung war bis zur Entwicklung der stark basischen Anionenaustauscher das wichtigste großtechnische Verfahren, mit dem der Gehalt an Kieselsäure in einem Wasser vermindert werden konnte. Dies war besonders für Kondensation-Kraftwerke erforderlich. Höhere Kieselsäuregehalte im Kesselwasser verursachen wegen der Dampfflüchtigkeit von SiO2 bei höheren Drücken eine Verkieselung der Turbinenschaufeln. Mit der Einführung der stark basischen Anionenaustauscher in den 1950er Jahren verlor dieses Verfahren aber stark an Bedeutung. Inzwischen wird es nur noch in Sonderfällen angewandt.
Literatur
- Babcock Handbuch Wasser, Kap. Enthärtung nach dem Fällungsverfahren
- VGB 1985 Heft Nr.6, ab Seite 600
- gwf-Wasser.Abwasser, 1989 Nr.11, ab Seite 569
- bbr, 1994 Heft Nr.8, ab Seite 28
Wikimedia Foundation.
