- Essigsäure
-
Synonyme:
Strukturformel 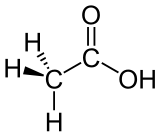
Allgemeines Name Essigsäure Andere Namen - Acetoxylsäure
- Acetylsäure (veraltet)
- acidum aceticum (lateinisch)
- AcOH
- Äthansäure
- Eisessig (Bez. für reine Säure)
- Ethansäure
- Ethoxylsäure
- Holzsäure (veraltet, ungebräuchlich)
- Methancarbonsäure
- Methylcarbonsäure
- E 260
Summenformel C2H4O2 CAS-Nummer 64-19-7 PubChem 176 ATC-Code Kurzbeschreibung stechend riechende Flüssigkeit mit charakteristischem Geruch [1]
Eigenschaften Molare Masse 60,05 g·mol−1 Aggregatzustand flüssig
Dichte 1,05 g·cm−3 [1]
Schmelzpunkt Siedepunkt 118 °C [1]
Dampfdruck pKs-Wert 4,76 [2]
Löslichkeit vollständig mischbar mit Wasser (20 °C) [1]
Brechungsindex 1,371 (20°C)[3]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [4] 

Gefahr
H- und P-Sätze H: 226-314 EUH: keine EUH-Sätze P: 280-301+330+331-307+310-305+351+338 [1] EU-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [4] 
Ätzend (C) R- und S-Sätze R: 10-35 S: (1/2)-23-26-45 MAK 10 ml·m−3; 25 mg·m−3 [1]
LD50 3310 mg·kg−1 (Ratte, oral) [5]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Essigsäure (systematisch Ethansäure, lat. Acidum aceticum) ist eine farblose, flüssige, ätzende und typisch riechende Carbonsäure der Zusammensetzung C2H4O2 (Halbstrukturformel CH3COOH). Als Lebensmittelzusatzstoff hat sie die Bezeichnung E 260. Wässrige Lösungen der Essigsäure werden trivial nur Essig und reine Essigsäure Eisessig genannt. Die Salze und Ester der Essigsäure heißen Acetate oder (systematisch) Ethanoate.
Inhaltsverzeichnis
Geschichte
Essig wurde historisch sowohl in Europa als auch in Asien als Würzmittel zur Säuerung und Konservierung von Lebensmitteln genutzt, in Europa geht die Verwendung bis in die Antike zurück. Dabei wurde Essig traditionell wie beispielsweise beim bekannten Aceto balsamico in der italienischen Region Modena vor allem aus Wein gewonnen, der offen stehengelassen und vergoren wurde. Das im Mittelalter in Frankreich entwickelte Orleans-Verfahren basierte ebenfalls auf diesem Prozess: Wein wurde in große und flache, offene Bottiche gefüllt und unsteril hingestellt. Wahrscheinlich über Taufliegen (auch bekannt als Frucht- oder Essigfliegen) wurden Essigsäurebakterien eingetragen, die eine Kahmhaut auf der Weinoberfläche bildeten, die so genannte Essigmutter.[6]
Eine Weiterentwicklung erfolgte im 19. Jahrhundert durch die ersten Oberflächenfermenter. Dabei wurde beim Fessel- oder Generatorverfahren die wein- bzw. alkoholhaltige Lösung durch große Holzgeneratoren gerieselt, die beispielsweise mit Buchenspänen gefüllt waren und als natürliche Träger für die Ansiedlung der Bakterien dienten. Der Sauerstoff wurde über eine Belüftung am Boden der Behälter gewährleistet und stieg, angezogen durch die Reaktionswärme, durch den Generator nach oben. Ähnliche Verfahren sind zur Herstellung von Essig bis in die heutige Zeit im Einsatz.[6]
1856 entdeckte der französische Wissenschaftler Louis Pasteur die Rolle der Bakterien bei der Essigherstellung. 1868 konnte er erstmalig selektive Wachstumsbedingungen für die Essigsäurebakterien ausarbeiten und einsetzen. Er legte damit den Grundstein für die kontrollierte Herstellung von Essig in Form von Weinessig mit einem Essigsäureanteil von etwa sechs Prozent.[7][6] Dieses Verfahren und die Ausbeute wurden erst 1949 durch die Einführung eines Submers-Verfahrens in Form des Frings-Acetators (benannt nach dem Unternehmen Heinrich Frings GmbH & Co KG in Bonn, das maßgeblich an der Entwicklung beteiligt war), verbessert und abgelöst. Heute stellt das Submers-Verfahren die häufigste Produktionsform für biogene Essigsäure dar.[6]
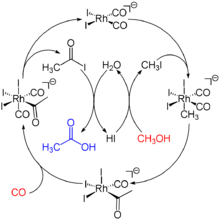
Die ersten Verfahren zur Herstellung von synthetischer Essigsäure stammen aus dem Jahr 1913 von dem deutschen Unternehmen BASF. 1941 zeigte der BASF-Chemiker Walter Reppe die Effizienz der Carbonyle der heute als Cobaltgruppe bezeichneten Metalle (früher Gruppe VIII) als Katalysatoren für die Herstellung von Carbonylverbindungen. Auf diesen Arbeiten basierend, wurde ein Prozess entwickelt, mit dem unter hohem Druck und bei hohen Temperaturen Methanol durch Cobaltdiiodid als Katalysator zu Essigsäure umgesetzt werden konnte. Das Methanol selbst stellte einen Rohstoff dar, der nicht primär auf Erdöl basiert sondern über Synthesegas aus verschiedenen Rohstoffquellen wie Erdgas und Kohle gewonnen werden konnte. 1960 wurde der BASF-Prozess erstmals großtechnisch in einer Anlage in Ludwigshafen umgesetzt, die Kapazität wurde von anfänglich 3.600 t/a kontinuierlich auf 45.000 t/a im Jahr 1981 gesteigert. 1966 baute die amerikanische Borden Chemical Co. eine weitere Anlage auf der Basis des BASF-Prozesses mit einer Kapazität von 45.000 t/a in Geismar in Louisiana, die bis 1981 auf 64.000 t/a aufgestockt wurde.[8]
In den späten 1960er Jahren entwickelte Monsanto einen Prozess auf der Basis von Rhodiumiodid als Katalysator, der die Herstellung von Essigsäure unter einem deutlich geringeren Druck und bei einer geringeren Temperatur (3 MPa = ca. 30 bar, 180 °C) bei einer höheren Ausbeute von bis zu 99 % bei Einsatz von Methanol und 90 % bei Einsatz von Kohlenstoffmonoxid ermöglicht (Monsanto-Prozess). 1970 baute Monsanto die erste Anlage in Texas City mit einer Startkapazität von 135.000 t/a, die bis 1975 auf 270.000 t/a erhöht wurde. Bereits kurze Zeit nach diesem Start wurde der BASF-Prozess im Vergleich unökonomischer und konnte nicht mehr konkurrieren. 1978 baute Celanese die Clear Lake Plant in Seabrook in Texas auf der Basis des Monsanto-Prozesses mit einer Startkapazität von 27.000 t/a, durch eine Verbesserung des Prozesses konnte die Kapazität auf 900.000 t/a gesteigert werden.[8]
1986 kaufte BP Chemicals die Rechte am Monsanto-Prozess, allerdings ohne die Modifikationen von Celanese und modifizierte ihn mit Iridiumiodid als Katalysator. Dieser als Cativa-Prozess bekannte Weg wurde in den frühen 1990er Jahren weiterentwickelt und soll den Rhodiumiodid-Prozess in der Monsanto-Fabrik in Texas-City ersetzen und verbessern.[8]
Vorkommen
Essigsäure ist ein Bestandteil von Pflanzensäften und ätherischen Ölen. Alkoholische Getränke, die für längere Zeit der Luft ausgesetzt sind, bilden durch Oxidation des Ethanols Essigsäure.
Essigsäure könnte auch im interstellaren Raum vorkommen, ein Prozess zu deren Entstehung wurde nachgewiesen.[9]
Gewinnung und Herstellung
Biotechnologische Herstellung
Die biotechnologische bzw. fermentative Herstellung von Essigsäure ist die Veratmung von Ethanol („Alkohol“) durch Bakterien der Gattungen Acetobacter oder Gluconobacter. Es handelt sich biochemisch betrachtet um eine unvollständige Atmung (nicht wie es irrtümlich oft beschrieben wird, um eine Gärungsform). Die Bakterien wandeln durch Gärungsprozesse entstandenes Ethanol durch eine sogenannte „subterminale Oxidation“ über Acetaldehyd (Ethanal) in Essigsäure um.[7]
Die Oxidation erfolgt durch membranständige Alkoholdehydrogenasen (ADH) und Aldehyddehydrogenasen (ALDH), die als prosthetische Gruppe Pyrrolochinolinchinon (PQQ) und bei den ADH zusätzlich Häm c enthalten. Die bei der Oxidation freiwerdenden Elektronen werden über Ubichinon auf eine ebenfalls membranständige Oxidase übertragen.[7]
Ausgangsprodukte für die Essigsäure-Bildung können z. B. Wein, Bier oder Malz sein. Dabei sind die Bakterien sehr stark von einer ausreichenden Sauerstoffversorgung abhängig und reagieren auf sauerstoffarme Lebensbedingen sehr empfindlich. Bereits bei einer Unterbrechung der Sauerstoffversorgung von wenigen Minuten kommt es zu einer signifikanten Abnahme der Ethanoloxidation. Steht Ethanol als Substrat nicht zur Verfügung kommt es zu einem Abbau der Essigsäure zu CO2, ebenfalls durch Oxidation.[7] Die Bakterien bauen Kohlenhydrate sowohl über die Glykolyse wie über den Entner-Doudoroff-Weg zu Pyruvat ab, das dann in den Citratzyklus geht.[7]
Großtechnische chemische Herstellung
Weltweit bestehen Produktionskapazitäten für Essigsäure in Höhe von etwa 7 Mio. Tonnen pro Jahr.[10] Zwischen 1998 und 2006 gab es weltweit ein durchschnittliches Wachstum der Produktion von drei bis vier Prozent pro Jahr, wobei etwa 70 % der Jahresproduktion in den USA (1996: 36 %; 2006: 32 %), West-Europa (1996: 24 %; 2006: 17 %) und Japan (1996: 16 %; 2006: 11 %) stattfinden, die ostasiatische Produktion stieg im Vergleich zu diesen Regionen von 1996 mit 14 % auf etwa 18 % im Jahr 2006.[11] Nur etwa 190.000 Tonnen werden jährlich weltweit fermentativ hergestellt, wobei etwa 70 % des Weltbedarfs an Speiseessig im Submersverfahren in etwa 700 Bioreaktoren produziert wird.[6]
Die aktuell bedeutendste industrielle Synthese für Essigsäure ist die katalytische Umsetzung von Methanol mit Kohlenmonoxid unter Druck (Monsanto-Prozess).
Daneben kann Essigsäure auch synthetisch durch Oxidation von Acetaldehyd mit Luft oder Sauerstoff unter Verwendung von Mn(OAc)2 als Katalysator oder durch partielle Oxidation anderer Kohlenwasserstoffe hergestellt werden.
Technisch werden auch noch die Luftoxidation von n-Butan bei etwa 180 °C und 85 bar, die katalytische Oxidation von Leichtbenzin sowie die Rektifikation von Holzessig genutzt.[12]
Eigenschaften
Physikalische Eigenschaften
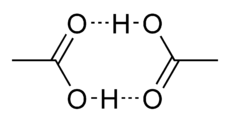
Essigsäure besitzt mit 118 °C eine relativ hohe Siedetemperatur gegenüber polaren Stoffen mit vergleichbarer molarer Masse (beispielsweise 1-Propanol: Siedepunkt 97 °C). Die Ursache dafür ist die Fähigkeit der Essigsäure-Moleküle, über ihre Carboxygruppen zwei „gegenseitige“ Wasserstoffbrückenbindungen auszubilden, so dass Dimere aus zwei Essigsäure-Molekülen entstehen, die sich wie ein Molekül doppelter molarer Masse verhalten. Daher wird für die Überleitung dieser Dimere in die Gasphase ein höherer Energiebetrag erforderlich, erkennbar an der „erhöhten“ Siedetemperatur.
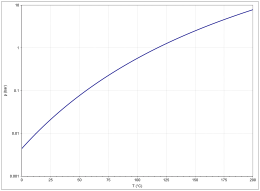
Die Dampfdruckfunktion ergibt sich nach der Antoine-Gleichung entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,68206, B = 1642,540 und C = −39,764 im Temperaturbereich von 290,26 bis 391,01 K.[13]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert und Einheit Bemerkungen Standardbildungsenthalpie ΔfH0liquid
ΔfH0gas−484,5 kJ·mol−1
−433 kJ·mol−1 [14]Standardentropie S0l, 1 bar
S0g158,0 J·mol−1·K−1[15]
282,84 J·mol−1·K−1[16]als Flüssigkeit
als GasVerbrennungsenthalpie ΔcH0liquid −875,16 kJ·mol−1[17] Wärmekapazität cp 123,1 J·mol−1·K−1 (25 °C)[15]
63,44 J·mol−1·K−1 (25 °C)[14]als Flüssigkeit
als GasKritische Temperatur Tc 318,8 °C[18] Kritischer Druck pc 57,86 bar[18] Azentrischer Faktor ωc 0,46652[18] Schmelzenthalpie ΔfH0 11,72 kJ·mol−1 [15] beim Schmelzpunkt Schmelzentropie ΔfS0 40,5 kJ·mol−1 [15] beim Schmelzpunkt Verdampfungsenthalpie ΔVH0 23,7 kJ·mol−1 [19] beim Normaldrucksiedepunkt Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=Aexp(−αTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 22,84 kJ/mol, α = 0,0184, β = −0,0454 und Tc = 592,7 K im Temperaturbereich zwischen 298 und 392 K beschreiben[19]. Reine Essigsäure hat als potentieller Elektrolyt eine, nur auf der Autoprotolyse beruhende, sehr geringe Leitfähigkeit für elektrischen Strom. Die Leitfähigkeit reiner Essigsäure beträgt bei 25 °C 6·10-7 S·m-1.[20] Erst durch Wasser tritt Dissoziation und die Erhöhung der Leitfähigkeit ein.
Chemische Eigenschaften
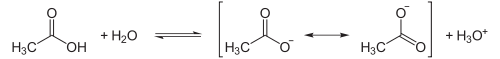
In wässriger Lösung reagiert Essigsäure als mittelstarke Säure. Der pKs-Wert der Essigsäure beträgt 4,75. In einer protolytischen Reaktion stellt sich ein Gleichgewicht zwischen der Essigsäure und dem Acetat-Ion ein, das stark auf Seiten der Säure liegt. Wie bei allen Carbonsäuren ist die Carboxylatgruppe des Acetat-Ions durch Mesomerie stabilisiert, was wesentlich zur sauren Reaktion der Carbonsäuren beiträgt:
Der Dissoziationsgrad der Säure liegt in verdünnten Lösungen nur im Bereich einiger Prozente. In einer einmolaren Lösung liegt er nur bei etwa 0,5 %. Das dabei entstehende Oxoniumion (H3O+) führt zu einer sauren Lösung (pH-Wert < 7).
Wird der pH-Wert einer Essigsäurelösung durch Zusatz einer starken Base oder durch Zusatz von Acetaten erhöht, wird eine Pufferlösung gebildet. Ist der pH-Wert der Lösung gleich dem pKs-Wert der Essigsäure, liegen Essigsäure und Acetat-Ion in gleichen Konzentrationen vor. Dies ist der optimale Pufferpunkt des Essigsäure-Acetat-Puffers und federt die Änderung des pH-Werts beim Zusatz von Säuren oder Basen ab. Dieses Puffersystem ist bedeutend für biochemische Systeme im sauren Bereich, da es einen günstigen pKs-Wert hat und die beteiligten Komponenten die meisten Organismen und Biomoleküle nicht negativ beeinflussen. Er ist ein stabiles Puffersystem, das heißt, das konjugierte Säure-Base-Paar verbleibt in Lösung und kann nicht wie z. B. beim Hydrogencarbonatpuffer aus dem System entweichen.
Essigsäure oxidiert an der Luft vollständig unter Hitzeentwicklung zu Wasser und Kohlenstoffdioxid. Dies geschieht bei Raumtemperatur jedoch nur extrem langsam. Unedle Metalle wie Magnesium, Calcium, Zink oder Eisen lösen sich in verdünnter Essigsäure unter Bildung wasserlöslicher Acetate und Freisetzung von Wasserstoff auf. Mit Kupfer reagiert die Essigsäure in Gegenwart von Sauerstoff (Luft) zu Kupferacetat, einem grünen, gesundheitsschädlichen Salz, das besser unter dem Namen „Grünspan“ bekannt ist. Essigsäure reagiert mit Ethanol säurekatalysiert zu Essigsäureethylester, einem viel verwendeten Lösemittel. Wird 1-Pentanol statt Ethanol verwendet, erhält man Essigsäureamylester, einen stark riechenden Ester. Salicylsäure lässt sich ebenfalls mit Essigsäure verestern. Dabei entsteht Acetylsalicylsäure, der Wirkstoff des Aspirins. Essigsäure reagiert bei 800 °C unter Dehydratisierung zu Essigsäureanhydrid. Essigsäure wird in verdünnter Form auch zum Kalklösen verwendet gemäß folgender Reaktionsgleichung:
Die Salze der Essigsäure werden als Acetate bezeichnet. Es sind zumeist farblose kristalline Salze, die in ihren Kristallgittern (Ionengittern) das Acetat-Anion (CH3COO−) enthalten.
Verwendung
Ernährung
Essigsäure hat eine große Bedeutung als Geschmacksstoff. Essigsäure (E 260) und ihre Salze Kaliumacetat (E 261), Natriumacetat (E 262) und Calciumacetat (E 263) werden als Säuerungsmittel für Obst und Gemüse in Dosen und Gläsern (0,5–3 % Essigsäure), bei Fisch in allen Variationen, Konserven, verschiedenste Marinaden, Feinkostsalaten, Mayonnaisen, Salatsoßen zusammen mit Sorbinsäure (E 200) oder Benzoesäure (E 210) und für das Einlegen und Abwaschen von frischem Fleisch verwendet. Der bakterizide Effekt der Essigsäure besteht darin, dass durch den veränderten pH-Wert physiologische Prozesse unterbunden werden und auch Eiweiße denaturieren. Haushaltsessig besteht aus biogenem Essig und enthält 5 % Essigsäure. Essigessenz ist eine 25%ige Essigsäurelösung in Wasser, riecht stark stechend und darf nur verdünnt in Speisen verwendet werden.
Stoffliche Nutzung
Für die stoffliche Nutzung wird fast ausschließlich großtechnisch hergestellte Essigsäure genutzt. Dabei werden mehr als 65% der Weltproduktion für Polymere auf der Basis von Vinylacetat (43 %) und Celluloseacetat (25 %) aufgewendet. Vinylacetat ist die Grundlage für Polyvinylacetat (PVAc), das unter anderem in Farben und Klebstoffen verwendet wird, in geringerem Umfang auch in Vinylacetat-Copolymeren (wie Ethylenvinylacetaten) und Polyvinylalkohol.[21] Celluloseacetat wird vor allem zur Produktion von Zigarettenfilter, Folien und Kunststoffprodukten verwendet.
Weitere Verwendungen umfassen verschiedene Ester wie Essigsäure-n-butylester und Essigsäureisopropylester (zusammen 11%), die als Lösungsmittel für Kosmetika und Parfums verwendet werden. Weitere 10 % werden für die Herstellung von Essigsäureanhydrid, Acetanilid, Essigsäurechlorid und Ammoniumacetat genutzt.[21]
Gefahrenhinweise
Reine Essigsäure gilt als entzündliche Flüssigkeit. Oberhalb des Flammpunktes können sich entzündliche Dampf-Luft-Gemische bilden. Die Verbindung hat einen Flammpunkt bei 40 °C.[1] Der Explosionsbereich liegt zwischen 4 Vol% (100 g/m3) als untere Explosionsgrenze (UEG) und 17 Vol% (430 g/m3) als obere Explosionsgrenze (OEG).[1] Die Zündtemperatur beträgt 485 °C.[22] Der Stoff fällt somit in die Temperaturklasse T1.
Die Einstufung und Kennzeichnung nach den Gefahrgutvorschriften hängt von der Konzentration ab. [1] Eisessig oder Lösungen mit mehr als 80 Masse-% Säure werden der Gefahrgutklasse 8 (Ätzende Stoffe) mit der Verpackungsgruppe II (mittlere Gefährlichkeit) zugeordnet. Als Nebengefahr muss die Gefahrgutklasse 3 (Entzündbare Flüssigkeiten) mit gekennzeichnet werden (Gefahrzettel 8/3). Lösungen mit mindestens 50 Masse-% und höchstens 80 Masse-% Säure werden nur noch der Klasse 8 (Ätzende Stoffe) mit der Verpackungsgruppe II (mittlere Gefährlichkeit) zugeordnet (Gefahrzettel 8). Für Lösungen mit mehr als 10 Masse-% und weniger als 50 Masse-% Säure gilt die Klasse 8 (Ätzende Stoffe) mit der Verpackungsgruppe III (geringe Gefährlichkeit) (Gefahrzettel: 8).
Einzelnachweise
- ↑ a b c d e f g h i j k Eintrag zu Essigsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Februar 2008 (JavaScript erforderlich)
- ↑ pKa Data Compiled by R. Williams
- ↑ Datenblatt Acetic acid bei Sigma-Aldrich, abgerufen am 23. Juni 2011.
- ↑ a b Eintrag zu CAS-Nr. 64-19-7 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Acetic acid bei ChemIDplus
- ↑ a b c d e Christoph Syldatk: Organische Säuren. Essigsäure (Acetat). In: Garabed Antranikian: Angewandte Mikrobiologie. Springer -Verlag Berlin und Heidelberg 2006; S. 344-347. ISBN 978-3-540-24083-9.
- ↑ a b c d e Rolf D. Schmid: Taschenatlas der Biotechnologie und Gentechnik. 2. Aufl. Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31310-5, S. 18–19.
- ↑ a b c Hosea Cheung, Robin S. Tanke, G. Paul Torrence: Acetic Acid. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2005, S. 4–10, doi:10.1002/14356007.a01_045 (Abschnitt „Carbonylation of Methanol“).
- ↑ Chris J. Bennett, Ralf I. Kaiser: The Formation of Acetic Acid (CH3COOH) in Interstellar Ice Analogs. In: The Astrophysical Journal. 660, Nr. 2, 2007, S. 1289–1295, doi:10.1086/513267.
- ↑ Hosea Cheung, Robin S. Tanke, G. Paul Torrence: Acetic Acid. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2005, S. 1, doi:10.1002/14356007.a01_045 (Abschnitt „Introduction“)
- ↑ Hosea Cheung, Robin S. Tanke, G. Paul Torrence: Acetic Acid. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2005, S. 24–25, doi:10.1002/14356007.a01_045 (Abschnitt „Economic Aspects“).
- ↑ Essigsäure als Nebenprodukt der technischen Herstellung von Holzkohle
- ↑ R. A. McDonald, S. A. Shrader, D. R. Stull: Vapor Pressures and Freezing Points of 30 Organics. In: J. Chem. Eng. Data. 4, 1959, S. 311–313.
- ↑ a b NIST Chemistry WebBook
- ↑ a b c d J. F. Martin, R. J. L. Andon: Thermodynamic properties of organic oxygen compounds. Part LII. Molar heat capacity of ethanoic, propanoic, and butanoic acids. In J. Chem. Thermodynam. 14, 1982, S. 679–688.
- ↑ W. Weltner Jr.: The vibrational spectrum, associative and thermodynamic properties of acetic acid vapor. In: J. Am. Chem. Soc. 77, (1955, S. 3941–3950.
- ↑ W. V. Steele, R. D. Chirico, A. B. Cowell, S. E. Knipmeyer, A. Nguyen: Thermodynamic properties and ideal-gas enthalpies of formation for 2-aminoisobutyric acid (2-methylalanine), acetic acid, (4-methyl-3-penten-2-one), 4-methylpent-1-ene, 2,2'-bis(phenylthio)propane, and glycidyl phenyl ether (1,2-epoxy- 3-phenoxypropane). In: J. Chem. Eng. Data. 42, 1997, S. 1052–1066.
- ↑ a b c Schmidt, J.: Auslegung von Sicherheitsventilen für Mehrzweckanlagen nach ISO 4126-10 in Chem. Ing. Techn. 83 (2011) 796–812, doi:10.1002/cite.201000202.
- ↑ a b V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford, 1985.
- ↑ Berufsgenossenschaftliche Regeln für Sicherheit und Gesundheit bei der Arbeit BGR 132 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Jedermann-Verlag Heidelberg 2004
- ↑ a b Hosea Cheung, Robin S. Tanke, G. Paul Torrence: Acetic Acid. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2005, S. 19–20, doi:10.1002/14356007.a01_045 (Abschnitt „Uses“)
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenndaten - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003
Literatur
- Hosea Cheung, Robin S. Tanke, G. Paul Torrence: Acetic Acid. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a01_045.
Weblinks
 Commons: Essigsäure – Album mit Bildern und/oder Videos und Audiodateien
Commons: Essigsäure – Album mit Bildern und/oder Videos und Audiodateien Wiktionary: Essigsäure – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wiktionary: Essigsäure – Bedeutungserklärungen, Wortherkunft, Synonyme, ÜbersetzungenAmeisensäure | Essigsäure | Propionsäure | Buttersäure | Valeriansäure | Capronsäure | Önanthsäure | Caprylsäure | Pelargonsäure | Caprinsäure | Undecansäure | Laurinsäure | Tridecansäure | Myristinsäure | Pentadecansäure | Palmitinsäure | Margarinsäure | Stearinsäure | Nonadecansäure | Arachinsäure | Heneicosansäure | Behensäure | Tricosansäure | Lignocerinsäure | Pentacosansäure | Cerotinsäure | Heptacosansäure | Montansäure | Nonacosansäure | Melissinsäure |
Höhere Alkansäuren (mehr als 30 C-Atome)
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Essigsäure [1] — Essigsäure (Aethansäure, Acetylsäure, Acidum aceticum), die zweite und wichtigste Säure in der Reihe der eigentlichen Fettsäuren, deren Anfangsglied die Ameisensäure bildet. Die Essigsäure besitzt die Zusammensetzung C2H4O2 gemäß ihrer… … Lexikon der gesamten Technik
Essigsäure — (Äthansäure, Acetylsäure) CH3.COOH oder C2H4O2 findet sich in der Natur teils frei, teils in Form von Salzen oder Estern im Pflanzenreich, im Schweiß und Muskelsaft, im Safte der Milz und andrer Drüsen, im Blut Leukämischer und nach reichlichem… … Meyers Großes Konversations-Lexikon
Essigsäure [2] — Essigsäure. Seit 1. Januar 1909 ist eine Verordnung, betreffend den Verkehr mit Essigsäure in Kraft getreten, nach welcher rohe und reine Essigsäure (auch Essigessenz), welche über 15% reine Säure aufweist, nur in Flaschen besonderer Art und nur… … Lexikon der gesamten Technik
Essigsäure — Essigsäure, organische, in manchen Tier und Pflanzensäften vorhandene Säure, entsteht durch Oxydation von Alkohol (s. Essig) und bei der trocknen Destillation des Holzes (s. Holzessig), rein gewonnen durch Destillation von wasserfreiem… … Kleines Konversations-Lexikon
Essigsäure — (Acidum aceticum), wird erhalten, indem essigsaure Salze, wie essigsaures Blei, essigsaures Natron etc. mittelst Schwefelsäure zersetzt werden, wobei die E. durch Destillation gewonnen wird. Farblose, sehr stark und stechend riechende saure… … Herders Conversations-Lexikon
Essigsäure — Essigsäure, Ethansäure, CH3 COOH, bei Gärungs , Fäulnis und Oxidationsvorgängen häufig als Endprodukt entstehende Carbonsäure; wird bei der Essigsäuregärung (⇒ Gärung) gebildet und ist als Acetyl CoA (aktivierte Essigsäure) wichtiges… … Deutsch wörterbuch der biologie
Essigsäure — (Chem., Acidum aceticum), C4H4O = C4H3O3 + HO, bildet sich bei der trocknen Destillation des Holzes u. ähnlicher Körper, durch Behandeln von Aldehyd, Weingeist od. Äther mit oxydirenden Agentien wie Chlorwasser, Chromsäure od. verdünnter… … Pierer's Universal-Lexikon
Essigsäure — ↑Acetylsäure … Das große Fremdwörterbuch
Essigsäure — Ethansäure * * * Ẹs|sig|säu|re 〈f. 19; unz.; Chem.〉 aliphat. Monokarbonsäure von stechendem Geruch, kommt in vielen pflanzl. u. tierischen Produkten vor u. ist hauptsächlicher Bestandteil des Speiseessigs; Sy Äthansäure * * * Ẹs|sig|säu|re;… … Universal-Lexikon
Essigsaure Salze — (Chem.), durch unmittelbare Verbindung der Essigsäure mit Basen gebildet, größtentheils leicht löslich u. krystallisirbar, mehrere auch schwer u. unlöslich, geben, mit Schwefelsäure gemischt, Essiggeruch von sich, mit concentrirten Lösungen von… … Pierer's Universal-Lexikon