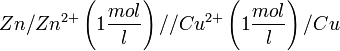- Galvanisches Element
-
Eine galvanische Zelle, galvanisches Element oder galvanische Kette (in der Biologie auch Redoxkette) ist eine Vorrichtung zur spontanen Umwandlung von chemischer in elektrische Energie. Sie wird in Batterien und Akkumulatoren verwendet. Jede Kombination von zwei verschiedenen Elektroden und einem Elektrolyten bezeichnet man als galvanisches Element. Sie dienen als Gleichspannungsquellen. Der charakteristische Wert ist die Teilspannung/eingeprägte Spannung. Unter der Kapazität eines galvanischen Elements versteht man das Produkt aus Entladungsstromstärke und -zeit.
Die Funktion der galvanischen Zelle beruht auf einer Redoxreaktion. Reduktion und Oxidation laufen räumlich getrennt in je einer Halbzelle (Halbelement) ab. Durch Verbinden der beiden Halbzellen mit einem Elektronenleiter und einem Ionenleiter wird der Stromkreis geschlossen. Die Spannung des elektrischen Stroms lässt sich durch die Nernst-Gleichung berechnen. Sie hängt von der Art des Metalls (Elektrochemische Spannungsreihe), der Konzentration in der Lösung der jeweiligen Halbzelle sowie der Temperatur ab. Im Gegensatz zur Elektrolyse, beispielsweise in der Galvanotechnik, kann in der galvanischen Zelle elektrische Energie gewonnen werden, während die Elektrolyse elektrische Energie verbraucht. Die Anode ist in einer galvanischen Zelle negativ geladen, die Kathode positiv, während bei der Elektrolyse die Kathode negativ und die Anode positiv geladen ist.
Der Name geht auf den italienischen Arzt Luigi Galvani zurück. Er entdeckte, dass ein mit Instrumenten aus verschiedenartigen Metallen berührter Froschschenkel-Nerv Muskelzuckungen auslöst, da das so gebildete Redox-System als galvanische Element Spannung aufbaut, so dass Strom fließt.
1936 wurden in der Nähe Bagdads Tongefäße aus dem 2. Jahrhundert v. Chr. gefunden, von denen vermutet wird, dass sie als galvanische Zelle für Vergoldungen verwendet worden sein könnten. Sie wurden unter dem Namen Bagdad-Batterie bekannt. Diese Interpretation als galvanische Zelle ist allerdings umstritten.
Inhaltsverzeichnis
Beispiele
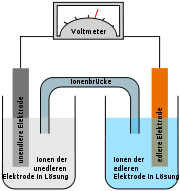
Immer wenn sich zwei unterschiedliche Metalle in einer Elektrolytlösung befinden, entsteht eine Spannung (galvanische Zelle). Dies ist auf die jeweilige Tendenz der Metalle, in Lösung zu gehen und dabei Ionen zu bilden, die so genannte Lösungstension, zurückzuführen. Neben dem Daniell-Element (Kupfer/Zink) kann so z. B. auch aus Kupfer- und Silberelektroden ein galvanisches Element erzeugt werden: Die Kupferelektrode taucht in eine Kupfersulfat-Lösung, die Silberelektrode in Silbernitratlösung, und verbunden werden diese durch einen Draht (Elektronenleiter) mit Voltmeter und einem Ionenleiter.
Sowohl die Kupferatome der Kupferelektrode als auch die Silberatome der Silberelektrode „streben“ danach, sich in der umgebenden Flüssigkeit zu lösen und damit zu (positiv geladenen) Ionen zu werden. Durch diese Ionenbildung entsteht an der Elektrode eine negative Ladung (da die Atome ihre Elektronen abgeben). Dies würde dazu führen, dass sich die Atome der Elektrode nicht weiter lösen könnten, da die negative Spannung verhindert, dass sich weitere Elektronen ansammeln.
Wenn jedoch beide Elektroden über einen elektrischen Leiter miteinander verbunden werden, sorgt die unterschiedliche Lösungstension der Elektroden dafür, dass die Reaktion weiterlaufen kann. Da das Redoxpotential von Kupfer niedriger ist als das von Silber, ist die negative Spannung in der Kupferelektrode höher als die in der Silberelektrode, es entsteht also eine Spannung, bei der die Elektronen zur Silberelektrode hin „gedrückt“ werden. Das führt dazu, dass die Lösung der Silberatome gestoppt wird, stattdessen reagieren die überschüssigen Elektronen mit den Ag+-Ionen der Silbernitratlösung und sorgen dafür, dass sich diese als normale Silberatome an der Silberelektrode festsetzen.
Für die Lösung der Kupferatome gilt also:
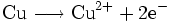
Hierbei handelt es sich um eine Oxidation, die Kupferelektrode wird also zur Anode (und zum Minuspol der galvanischen Zelle, da hier ein Elektronenüberschuss entsteht).
An der Silberelektrode, der Kathode, findet folgende Reduktion statt:
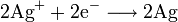
In der galvanischen Zelle läuft also eine Redoxreaktion ab, deren Reaktionsteile jedoch räumlich voneinander getrennt sind.
Werden die zwei Elektroden nun also elektrisch leitend verbunden, so entsteht zwar eine Spannung, aber es fließt noch kein Strom. Der Grund dafür ist, dass in der Kupfersulfatlösung ein Überschuss an Cu2+-Ionen entsteht und die Lösung sich stark positiv auflädt, was verhindert, dass sich weitere Kupferatome lösen können.
Ähnliches passiert mit der Silbernitratlösung, welche sich negativ auflädt, da vom neutralen Silbernitrat nur die negativ geladenen Nitrat-Ionen übrig bleiben (während sich die positiven Silberionen an die Silberelektrode anlagern, indem sie dort jeweils ein Elektron aufnehmen).
Silbernitratlösung: c[NO3−] >> c[Ag+]
Kupfersulfatlösung: c[SO42−] << c[Cu2+]
Deswegen sind die Elektrodenräume über eine Ionenbrücke (Salzbrücke) miteinander verbunden, welche notwendig ist, um den Stromkreis zu schließen. Die Ionenbrücke ist häufig ein U-Rohr, das mit einem Elektrolyten gefüllt ist und dessen Enden mit einer Membran oder einem Diaphragma versehen sind. Über die Salzbrücke erfolgt der Ionenaustausch, um so der Aufladung der einzelnen Zellen entgegen zu wirken. Eine andere Möglichkeit, die Elektrodenräume voneinander zu trennen, besteht in einer selektivpermeablen (ausgewählt durchlässigen) Membran, welche ebenfalls einen Ladungsausgleich ermöglicht. Über die Ionenbrücke wandern also die Salzionen (in diesem Fall Nitrationen) von der Kathode zur Anode, also von der Silberhalbzelle zur Kupferhalbzelle.
Es gibt auch galvanische Zellen mit zwei gleichen Halbzellen, die sich in ihrer Konzentration unterscheiden, diese nennt man Konzentrationselement.
Der Deflagrator ist ebenfalls eine Galvanische Zelle.
Verkürzte Schreibweise von galvanischen Elementen
Eine galvanische Zelle wird auch manchmal in verkürzter Schreibweise beschrieben. Das oben grafisch dargestellte Daniell-Element sähe in dieser Schreibweise folgendermaßen aus:
Beide Halbzellen werden in einer galvanischen Zelle durch ein Diaphragma, also eine dünne, halb durchlässige Membran (semipermeable Membran) getrennt. Durch diese Membran werden fast ausschließlich die negativ geladenen Anionen hindurchgelassen. Im Falle des Daniell-Elements sind das
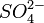 Ionen (Sulfationen), welche in den Salzlösungen beider Halbzellen vorhanden sind.
Ionen (Sulfationen), welche in den Salzlösungen beider Halbzellen vorhanden sind.Dieses Diaphragma wird in der verkürzten Schreibweise durch den doppelten Schrägstrich // dargestellt. Rechts und links von diesem doppelten Strich werden die beiden Halbzellen der galvanischen Zelle und die darin stattfindenden Reaktionen verkürzt dargestellt. Zudem wird die Konzentration der Metallsalzlösung, also die Konzentration der gelösten Metalle in beiden Halbzellen angegeben. Die Anodenhalbzelle steht üblicherweise links.[1]
Weblinks
- Interaktives Modul zu galvanischen Zellen
- Verständliche, einfache Erklärung der galvanischen Zelle mit anschaulicher Animation
- Galvanisches Element Informationen
- Flash-Animation auf Englisch
Einzelnachweise
- ↑ Elemente Chemie II - Gesamtband, ISBN 3-12-756700-6, S. 157.
Galvanische ZellenPrimärzellen: Alkali-Mangan-Batterie | Daniell-Element | Leclanché-Element | Lithium-Batterie | Lithium-Eisensulfid-Batterie | Nickel-Oxyhydroxid-Batterie | Quecksilberoxid-Zink-Batterie | Silberoxid-Zink-Batterie | Zink-Braunstein-Zelle | Zinkchlorid-Batterie | Zink-Luft-Batterie
Sekundärzellen: Bleiakkumulator | Natrium-Schwefel-Akkumulator | Nickel-Cadmium-Akkumulator | Nickel-Eisen-Akkumulator | Nickel-Metallhydrid-Akkumulator | Nickel-Wasserstoff-Akkumulator | Lithium-Eisen-Phosphat-Akkumulator | Lithium-Ionen-Akkumulator | Lithium-Mangan-Akkumulator | Lithium-Polymer-Akkumulator | Lithium-Titanat-Akkumulator | Vanadium-Redox-Akkumulator
Ausführungen: Akkumulator | Batterie | Brennstoffzelle | Konzentrationselement | Redox-Flow-Zelle | Bestandteile: Halbzelle (Donator- und Akzeptorhalbzelle)
Wikimedia Foundation.