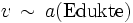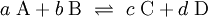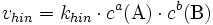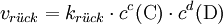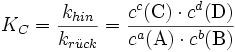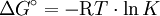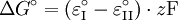- Gleichgewichtslage
-
Das Chemische Gleichgewicht gehört zur Gruppe der dynamischen Gleichgewichte. Grundsätzlich kann sich bei jeder reversiblen, d. h. umkehrbaren, chemischen Reaktion ein Gleichgewicht einstellen, da bei Reaktionen Hin- und Rückreaktion ablaufen können.
Inhaltsverzeichnis
Der Gleichgewichtszustand
Im Gleichgewichtszustand ist der Quotient aus dem Produkt der Konzentrationen der Produkte und dem Produkt der Konzentrationen der Edukte konstant. Damit sind auch die Konzentrationen konstant. Die Konzentration der Reaktionspartner im Gleichgewicht wird Gleichgewichtskonzentration genannt.
Der Wert dieser Gleichgewichtskonstanten ist temperaturabhängig und für jede Reaktion charakteristisch.
Obwohl Hin- und Rückreaktion beständig ablaufen, also Edukte in Produkte und diese wiederum in Edukte umgewandelt werden, verändern sich im Gleichgewicht die Konzentrationen der Edukte und Produkte nicht. Dies liegt daran, dass im Gleichgewicht die Geschwindigkeit von Hin- und Rückreaktion genau gleich groß ist, das heißt pro Zeiteinheit ebenso viel Edukt zu Produkt reagiert, wie Produkt von Edukt konsumiert wird.
Das Massenwirkungsgesetz
→ Hauptartikel: Massenwirkungsgesetz
Herleitung
Die Geschwindigkeit einer chemischen Reaktion ist direkt proportional zur Aktivität der Edukte:
Je höher die Aktivität der Edukte ist, desto schneller läuft die Reaktion ab.
Im Verlauf einer Gleichgewichtsreaktion nimmt die Aktivität der Edukte ständig ab. Dadurch verringert sich auch die Geschwindigkeit der Hinreaktion. Gleichzeitig nimmt die Aktivität der Produkte ständig zu. Dadurch vergrößert sich die Geschwindigkeit der Rückreaktion. Sind schließlich beide Reaktionsgeschwindigkeiten gleich, wird in gleichen Zeitspannen ebenso viel Produkt wie Edukt gebildet: Das Gleichgewicht ist erreicht.
In der Reaktionsgleichung wird der Gleichgewichtspfeil zur Beschreibung verwendet:
Die Geschwindigkeit der chemischen Hinreaktion vhin bzw. der chemischen Rückreaktion
 lautet dabei:
lautet dabei:Dabei ist khin die Geschwindigkeitskonstante der Hinreaktion und krück ist die Geschwindigkeitskonstante der Rückreaktion.
Im Gleichgewichtszustand sind die Geschwindigkeiten der Hin- und der Rückreaktion gleich groß:
Daraus folgt für die Gleichgewichts- oder Massenwirkungskonstante:
Gleichgewichtslage
Die Lage eines Gleichgewichts – und damit die Gleichgewichtskonstante – ist durch die Reaktionsbedingungen Temperatur, Druck und Stoffmengenkonzentration festgelegt:
- Ist die Gleichgewichtskonstante sehr groß (K >> 1), liegt das Gleichgewicht praktisch vollständig auf der Seite der Produkte.
- Ist die Gleichgewichtskonstante sehr klein (K << 1), liegt das Gleichgewicht praktisch vollständig auf der Seite der Edukte.
Die Gleichgewichtskonstante sagt etwas darüber aus, auf welcher Seite der chemischen Gleichung sich das Gleichgewicht befindet: Eine Zunahme der Gleichgewichtskonstante K bedeutet eine Verschiebung des Gleichgewichts auf die Seite der Produkte, eine Abnahme von K bedeutet eine Verschiebung des Gleichgewichts auf die Seite der Edukte.
Zur Erklärung: Haben fast alle Edukte zu Produkten reagiert, so sagt man "das Gleichgewicht liegt bei den Produkten".
Einfluss eines Katalysators
Ein Katalysator beschleunigt bzw. bremst Hin- und Rückreaktion auf die gleiche Weise. Er verändert damit nicht die Gleichgewichtskonzentrationen der Edukte und Produkte, bewirkt aber, dass sich der Gleichgewichtszustand schneller einstellt. Ein Katalysator setzt die Aktivierungsenergie herab. Die Funktion eines Katalysators beruht auf der Eröffnung eines neuen Reaktionsweges, der über andere Elementarreaktionen läuft als die unkatalysierte Reaktion. An diesen Elementarreaktionen ist der Katalysator zwar selbst beteiligt, jedoch verlässt er selbst den Vorgang (chemisch) unverändert.
Störung des Gleichgewichtes - Prinzip von Le Chatelier
Wird ein chemisches Gleichgewicht gestört, dann läuft diejenige Reaktion beschleunigt ab, die diese Störung wieder rückgängig macht. Dies nennt man deswegen auch das „Prinzip vom kleinsten Zwang“ (Prinzip von Le Chatelier): Der „Zwang“, der dem Gleichgewicht durch die Störung auferlegt wird, wird durch die beschleunigte Reaktion kompensiert.
Störungen sind:
- Konzentrationsänderungen bzw. Änderungen der Stoffmengen (durch Zugabe oder Entfernen eines der am Gleichgewicht beteiligten Stoffe)
- Zufuhr bzw. Entzug von Wärme bzw. Temperaturänderungen
- Änderung des Volumens bei Gasreaktionen
Konzentrationsänderungen
Durch Zufuhr bzw. Wegnahme eines Reaktionspartners wird das Gleichgewicht gestört, die Reaktion läuft folglich, bis das Gleichgewicht wieder erreicht ist, vermehrt in eine Richtung. Verändert man die Konzentration von einem der am Gleichgewicht beteiligten Stoffe, ändern sich dadurch auch die Konzentrationen aller anderen Partner. Soll eine Gleichgewichtsreaktion vollständig zugunsten eines Produkts ablaufen, genügt es, eines der Edukte aus dem Reaktionsgemisch zu vervielfachen oder eines der Produkte aus dem Reaktionsgemisch zu entfernen. Die Rückreaktion wird dadurch solange unterbunden, bis das ursprüngliche Gleichgewicht wieder hergestellt ist.
Da das Gleichgewicht nur von der Temperatur und gegebenenfalls vom Druck abhängt, erfolgt die Reaktion nach der Veränderung der Konzentration so, dass das ursprüngliche Gleichgewicht wieder hergestellt wird. Für eine Gleichgewichtsreaktion:
mit
lassen sich dabei folgende Fälle unterscheiden:
Änderung bewirkt Zugabe von A bzw. B Zunahme der Produkte Zugabe von C bzw. D Zunahme der Edukte Entzug von A bzw. B Abnahme der Produkte Entzug von C bzw. D Abnahme der Edukte Beispiele:
- Fällungsreaktionen
- Fehlingreaktion
- Eisenrhodanid-Reaktion
- Calcit-Sättigung (Früher: Kalk-Kohlensäure-Gleichgewicht)
Eine Änderung der Reaktionsbedingungen Temperatur und Druck führt zu einer Verschiebung des Gleichgewichts und somit zu einer Änderung der Gleichgewichtskonzentrationen.
Zufuhr bzw. Entzug von Wärme / Änderung der Temperatur
Wärmezufuhr bzw. Wärmeentzug bewirken eine Gleichgewichtsverschiebung, d. h. die Einstellung eines neuen Gleichgewichts mit veränderten Konzentrationen. Wärmeentzug begünstigt die Wärme liefernde (exotherme) Reaktion, Wärmezufuhr die Wärme verbrauchende (endotherme) Reaktion. Dadurch fällt die Temperaturänderung des Systems geringer aus als ohne Gleichgewichtsverschiebung.
Eine Temperaturänderung führt immer zu einer Änderung der Gleichgewichtskonzentrationen. Welche Konzentration dabei zunimmt bzw. abnimmt, hängt davon ab, ob die Bildung der Produkte exotherm oder endotherm ist:
Störung Art der Reaktion Zunahme der Temperaturerhöhung exotherm Edukte endotherm Produkte Temperaturerniedrigung exotherm Produkte endotherm Edukte Volumenänderung / Änderung des Drucks
Das chemische Gleichgewicht von Reaktionen, an denen keine Gase beteiligt sind, wird kaum durch eine von außen bewirkte Volumenänderung beeinflusst. Sind hingegen gasförmige Stoffe beteiligt, wird das Gleichgewicht nur dann beeinflusst, wenn sich die Teilchenzahl in der Gasphase durch die Gleichgewichtsverschiebung ändert.
Eine Druckänderung wirkt sich nur in einem geschlossenen System auf das Gleichgewicht aus. Je nach Reaktionsbedingung kann man eine Druckänderung oder eine Volumenänderung feststellen: Das System verringert den durch eine Volumenverkleinerung erzeugten Druck, indem es zugunsten der Seite abläuft, die die geringere Teilchenzahl aufweist und somit das kleinere Volumen benötigt. Dadurch fällt die Druckerhöhung weniger stark aus als wenn die Gase zu keiner Reaktion fähig wären. Entsprechend verschiebt eine Volumenvergrößerung das Gleichgewicht in Richtung größerer Teilchenzahlen.
Die Lage des Gleichgewichts kann durch eine Druckerhöhung von außen beeinflusst werden:
- bei konstantem Reaktionsvolumen durch weitere Zufuhr von Edukten
- bei veränderlichem Reaktionsvolumen durch Kompression.
Findet die Reaktion in einem offenen System statt, kann das bei der Reaktion entstehende Gas ständig entweichen. Dadurch wird ständig neues Gas produziert, das wiederum entweicht. Diese Störung des Gleichgewichts führt dazu, dass es sich nicht einstellen kann: die Reaktion verläuft vollständig zur Produktseite.
Freie Enthalpie
Je größer der Unterschied in der Freien Enthalpie (
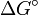 ) zwischen Edukten und Produkten ist, desto mehr liegt das Gleichgewicht auf der Seite mit der niedrigeren Freien Enthalpie. (Achtung!
) zwischen Edukten und Produkten ist, desto mehr liegt das Gleichgewicht auf der Seite mit der niedrigeren Freien Enthalpie. (Achtung! 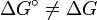 vgl. Standardzustand)
vgl. Standardzustand)R = Gaskonstante = 8,31441 J·K-1·mol-1
K = Gleichgewichtskonstante
T = Temperatur in Kelvins. a. Freie Enthalpie
für Redoxreaktionen gilt:
z = Zahl der ausgetauschten Elektronen
F = Faraday-Konstante = 96485 C·mol-1
ε0 = Normalpotential einer Redox-TeilreaktionBeispiele
- Calcit-Ausfällung
- Ammoniak-Synthese (Haber-Bosch-Verfahren)
- Chlor-Herstellung nach dem Deacon-Verfahren
Weblinks
Wikimedia Foundation.