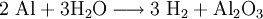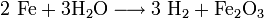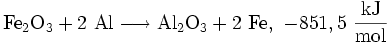- Aluminothermisches Schweißen
-
 Vorbereitung zum Verschweißen eines Schienenstoßes
Vorbereitung zum Verschweißen eines Schienenstoßes Aluminothermisch geschweißter Schienenstoß
Aluminothermisch geschweißter SchienenstoßThermit ist der Handelsname für ein Gemisch aus Eisen(III)-oxid- und Aluminium-Pulver, welches vorrangig zum aluminothermischen Schweißen und für andere Thermitverfahren oder die Aluminothermie eingesetzt wird.
Die beiden Stoffe sind normalerweise mit einem Bindemittel granuliert, um sie rieselfähig zu halten und Entmischung und Wasseraufnahme zu verhindern.
Die Thermit-Reaktion wurde von Hans Goldschmidt in den 1890er Jahren entdeckt und 1895 patentiert.
„Thermit“ ist eine geschützte Handelsmarke der Thermit-Gruppe, die sich 1999 von der Goldschmidt AG getrennt hat.
Inhaltsverzeichnis
Chemische Reaktion
Die Thermitreaktion ist eine Redoxreaktion, bei der Aluminium als Reduktionsmittel benutzt wird, um Eisen(III)-oxid zu Eisen zu reduzieren.
Die Reaktionsprodukte sind Aluminiumoxid und elementares Eisen. Die Reaktion läuft sehr stark exotherm ab, also unter starker Wärmeentwicklung.
Die Reaktion erfolgt beispielsweise in einem Tontiegel, als Zündkirsche wird Bariumperoxid mit Magnesium benutzt.
Es können nach dem gleichen Prinzip auch etwa Chrom und Mangan hergestellt werden.
Siehe dazu auch: Aluminothermie
Gefahren
Obwohl die Ursprungsprodukte bei Raumtemperatur stabil sind, können sie sich entzünden, falls sie einer genügend großen Aktivierungsenergie ausgesetzt werden. Der Brennvorgang ist eine stark exotherme Reaktion (bis zu 3000 °C), die Produkte werden somit aufgrund der erreichten Temperaturen flüssig.
Da brennendes Thermit keinen externen Sauerstoff benötigt, kann die Reaktion nicht erstickt werden und in jeder Umgebung – auch unter Sand oder Wasser – gezündet werden und weiterbrennen.
Löschversuche mit Wasser sowie Feuchtigkeit führen zu einer weiteren Redoxreaktion, in der das Wasser von den unedleren Metallen reduziert wird und so Metalloxid und Wasserstoff entsteht:
Die Anwesenheit von Wasser stellt daher eine große Gefahr bei der Thermitreaktion dar und führt zum explosionsartigen Ausschleudern glutflüssiger Stoffe sowie zu explosionsfähigen Wasserstoff-Sauerstoff-Mischungen (Knallgas).
Abgrenzung
Das Thermitverfahren hat nichts mit der Sauerstofflanze zu tun. Bei dieser erfolgt eine exotherme Eisen-Oxidation mit Hilfe von Sauerstoffgas.
Anwendungen
Die Anwendungen von Thermit-Reaktionen sind vielfältig. Die häufigste Anwendung ist die Reduktion von Eisen(III)-oxid, wobei eine Temperatur von bis zu 2200 °C überschritten wird:
Gleisbau
Thermit wird seit etwa 1920 zum aluminothermischen Schweißen und Fügen von Bahngleisen an den Schienenstößen angewendet.
Beim aluminothermischen Verschweißen von Schienenstößen wird eine bestimmte Menge Thermit in einem Schamotte-Trichter über dem mit Formsand eingeschlossenen Schienenstoß entzündet. Das nach einigen Sekunden in den Fügespalt einfließende flüssige Eisen ist ausreichend heiß, um die Schienenenden zur Verschweißung anzuschmelzen.
Zusatzstoffe wie Vanadium machen den Schweißstahl härter als den eigentlichen Schienenstahl.Das Thermitschweißen wird heute oft durch das effektivere Abbrennstumpfschweißverfahren ersetzt, welches jedoch einen höheren Geräteaufwand erfordert.
Waffen
Thermitgranaten und -bomben (siehe auch Elektron-Thermitstab) werden in Kämpfen als Brandmittel verwendet, da sie fähig sind, schwere Panzerung oder andere Feuerbarrieren durch Schmelzen zu durchdringen.
Herstellung anderer Metalle
Die Redoxreaktion mit Aluminium kann auch verwendet werden, um andere Metalloxide oder -erze, etwa Uranerz, Chrom(III)-oxid, Siliciumdioxid oder Manganoxid zu den jeweiligen Metallen zu reduzieren.
Weblinks
Wikimedia Foundation.