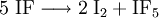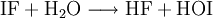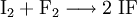- Iod(I)-fluorid
-
Strukturformel 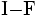
Allgemeines Name Iodfluorid Andere Namen - Iod(I)-fluorid
- Iodmonofluorid
- Fluoriod
Summenformel IF CAS-Nummer 13873-84-2 Kurzbeschreibung weißes Pulver (bei −78 °C) [1] Eigenschaften Molare Masse 145,9 g·mol−1 Aggregatzustand fest (unterhalb von −14 °C)
Schmelzpunkt Zersetzung oberhalb von −14 °C[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Iodfluorid ist eine bei Raumtemperatur instabile Interhalogenverbindung, die aus den Elementen Iod und Fluor besteht.
Inhaltsverzeichnis
Eigenschaften
Iodfluorid ist ein weißes Pulver und stabil bei Temperaturen unterhalb von −78 °C; oberhalb −14 °C disproportioniert die Verbindung in elementares Iod (I2) und Iodpentafluorid (IF5), eine farblose Flüssigkeit:
Mit Wasser reagiert Iodfluorid, analog zu allen anderen Interhalogenverbindungen, unter Bildung von Halogenwasserstoff, in diesem Fall Fluorwasserstoff (HF), und Hypohalogeniger Säure, in diesem Fall Hypoiodige Säure (HOI):
Iodfluorid ist, in Analogie zu stabileren Interhalogenverbindungen, als giftig einzustufen.
Es neigt von allen Interhalogenen am stärksten zum Zerfall, dies bereits bei sehr tiefen Temperaturen. Daher ist eine genaue Bestimmung der physikalischen Eigenschaften nicht möglich.
Darstellung
Iodfluorid kann bei tiefen Temperaturen aus den Elementen dargestellt werden:
Die direkte Umsetzung der Elemente führt jedoch unter weiterführender Fluorierung des Iodfluorids leicht zum Iodtrifluorid. Es kann praktisch nicht rein hergestellt werden und der Nachweis der Verbindung ist sehr schwierig. Deshalb sind auch die meisten Eigenschaften unbekannt. Womöglich ist es polymer.
Siehe auch
Einzelnachweise
- ↑ a b Holleman/Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, Berlin 2007. ISBN 978-3-11-017770-1
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
Literatur
- D. Naumann: Fluor und Fluorverbindungen, Steinkopff-Verlag, Darmstadt, 1980
- W. K. R. Musgrave: The Halogen Fluorides; their Preparation and Uses in Organic Chemistry, Adv. Fluorine Chem. 1 (1960)
- E. H. Wiebenga, E. E. Havinga, K. H. Boswijk: Structures of Interhalogen Compounds and Polyhalides, Adv. Inorg. Radiochem. 3 (1961)
Weblink
Wikimedia Foundation.