- Iodtrifluorid
-
Strukturformel 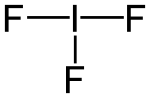
Allgemeines Name Iodtrifluorid Andere Namen Iod(III)-fluorid
Summenformel IF3 CAS-Nummer 22520-96-3 Kurzbeschreibung gelber Feststoff (−78 °C)[1]
Eigenschaften Molare Masse 183,9 g·mol−1 Schmelzpunkt Sicherheitshinweise EU-Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Iodtrifluorid ist eine chemische Verbindung von Iod und Fluor. Die Interhalogenverbindung ist wie andere dieser Stoffklasse sehr instabil und zersetzt sich leicht.
Inhaltsverzeichnis
Geschichte
Iodtrifluorid wurde erstmals 1960 von M. Schmeisser aus den Elementen Iod und Fluor dargestellt.[4]
Gewinnung und Darstellung
Iodtrifluorid ist auf mehreren Wegen darstellbar. Neben der Synthese aus den Elementen ist es möglich, die Verbindung durch Reaktion von Iod mit Xenon(II)-fluorid in Trichlorfluormethan zu gewinnen.[5]
Eigenschaften
Die Struktur des IF3-Moleküls lässt sich über das VSEPR-Modell erklären. Neben den beiden Fluor-Liganden besitzt das Iod-Atom noch zwei freie Elektronenpaare. Mit diesen bildet das Molekül eine trigonale Bipyramide, betrachtet man nur die Atome, erscheint es T-förmig. Die axialen Fluor-Iod-Bindungen besitzen eine Länge von 198 pm, die äquatoriale eine Länge von 187 pm. Die Winkel zwischen den Fluoratomen betragen 80,1 °.[2]
Iodtrifluorid ist nur bei Temperaturen von unter -28 °C stabil. Wird es über diese Temperatur erwärmt, zersetzt es sich zu Iod und Iodpentafluorid. Wie andere Interhalogenverbindungen ist Iodtrifluorid ein Fluorierungsmittel, jedoch schwächer als Brom- oder Chlortrifluorid.[2]
Verwendung
Iodfluorid lässt sich durch Reaktion von Iodtrifluorid mit Iod in Trichlorfluormethan bei tiefen Temperaturen darstellen.[4]
Einzelnachweise
- ↑ Iodtrifluorid bei Webelements.com.
- ↑ a b c Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, S. 459-460, ISBN 978-3-11-017770-1.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b M. Schmeisser, E. Scharf: Über Jodtrifluorid JF3 und Jodmonofluorid JF. In: Angewandte Chemie, 1960, 72, 9, S. 324, doi:10.1002/ange.19600720912.
- ↑ Thomas M. Klapötke, Inis C. Tornieporth-Oetting: Nichtmetallchemie. Wiley-VCH, Weinheim 1994, ISBN 3-527-29257-8.
Chlorfluoride: Chlorfluorid | Chlortrifluorid | Chlorpentafluorid
Bromfluoride: Bromfluorid | Bromtrifluorid | Brompentafluorid
Iodfluoride: Iodfluorid | Iodtrifluorid | Iodpentafluorid | Iodheptafluorid
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
IF3 — Strukturformel Allgemeines Name Iodtrifluorid Andere Namen Iod(III) fluorid … Deutsch Wikipedia
Iod(III)-fluorid — Strukturformel Allgemeines Name Iodtrifluorid Andere Namen Iod(III) fluorid … Deutsch Wikipedia
Iod(I)-fluorid — Strukturformel Allgemeines Name Iodfluorid Andere Namen Iod(I) fluorid Iodmonofluorid Fluoriod Summenform … Deutsch Wikipedia
Iodmonofluorid — Strukturformel Allgemeines Name Iodfluorid Andere Namen Iod(I) fluorid Iodmonofluorid Fluoriod Summenform … Deutsch Wikipedia
Brom(III)-fluorid — Strukturformel Allgemeines Name Bromtrifluorid Andere Namen Brom(III) fluorid … Deutsch Wikipedia
Bromtrifluorid — Strukturformel Allgemeines Name Bromtrifluorid Andere Namen … Deutsch Wikipedia
Chlor(III)-fluorid — Strukturformel Allgemeines Name Chlortrifluorid Andere Namen Chlor(III) fluorid … Deutsch Wikipedia
ClF3 — Strukturformel Allgemeines Name Chlortrifluorid Andere Namen Chlor(III) fluorid … Deutsch Wikipedia
IF5 — Strukturformel Allgemeines Name Iodpentafluorid Summenformel IF5 … Deutsch Wikipedia
IF7 — Strukturformel Allgemeines Name Iodheptafluorid Andere Namen Iod(VII) fluorid … Deutsch Wikipedia


