- Ammoniaklösung
-
Allgemeines Name Ammoniumhydroxid Andere Namen - Ammoniaklösung, -wasser, -lauge
- kaustischer Ammoniak
- ätzendes Ammoniak
- Salmiakgeist
- Hirschhorngeist
- Ätzammoniak
- Ammoniumhydrat
Summenformel NH4OH CAS-Nummer 1336-21-6 Kurzbeschreibung farblose stechend riechende Flüssigkeit Eigenschaften Molare Masse 35,1 g·mol−1 Aggregatzustand flüssig
Dichte Schmelzpunkt Siedepunkt Dampfdruck Löslichkeit vollständig mischbar mit Wasser [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Ätzend Umwelt-
gefährlich(C) (N) R- und S-Sätze R: 34-50 S: (1/2)-26-36/37/39-45-61 MAK 20 ml·m−3
14 mg·m−3 [1]Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ammoniumhydroxid, auch Salmiakgeist oder Ammoniakwasser, in der Laborsprache auch nur z. B. 25%iger Ammoniak genannt, ist primär eine physikalische Lösung von Ammoniak (NH3) in Wasser (H2O), bei der teilweise eine Protolyse vom Wasser zum Ammoniak stattfindet, und die deshalb basisch ist. Der Name Ammoniumhydroxid suggeriert, dass es sich dabei um eine isolierbare Substanz handelt, was aber nicht möglich ist. Daher ist diese Bezeichnung eigentlich nicht vollständig korrekt, wird aber dennoch verwendet, weil sie das Verhalten der Substanz charakterisiert. In höchster Konzentration hat Ammoniakwasser die Dichte 0,880 g/cm³ (= 32 % ≙ 620 l NH3 in 1 l H2O).
Die Lebensmittelzusatzstoff-Kennzeichnung ist E 527.
Inhaltsverzeichnis
Entstehung
Wenn Ammoniak (NH3) in Wasser (H2O) gelöst wird, fangen Ammoniakmoleküle (die in das polymere Wasserstoffbrückensystem Wasser eingebaut und damit physikalisch gelöst sind) einzelne, durch die Autoprotolyse des Wassers entstehende Protonen ab:
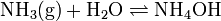 .
.
Die meisten neu entstandenen Moleküle reagieren wieder zurück, sodass der größte Teil des gelösten Ammoniaks weiterhin als NH3, und nicht als NH4+ vorliegt.
Eigenschaften
Ammoniumhydroxidlösungen enthalten grundsätzlich einen wesentlichen Anteil an Ammoniak, der, physikalisch gelöst, also mit dem Wasser gemischt, ebenso wie Wasser verdunstet, aufgrund des höheren Dampfdruckes dazu noch wesentlich schneller, weshalb die Ammoniak-Konzentration in offenen Gefäßen mit der Zeit abnimmt. Dabei tritt der typische, stechend-scharfe Ammoniakgeruch auf. Eindrucksvoll kann dies nachgewiesen werden, indem man diesen Ammoniak in der Luft mit Chlorwasserstoff, wie er z. B. analog aus konz. Salzsäure verdunstet, in Kontakt bringt, wobei sich ein dichter weißer Rauch von Ammoniumchlorid in einer nicht-wässerigen Säure-Base-Reaktion bildet.
Bei Tieftemperatur-Versuchen konnte eine Additionsverbindung (NH3 · H2O) isoliert werden, die bei −77 °C schmilzt. Dabei handelt sich aber nicht um das eigentliche Ammoniumhydroxid, sondern eher um Ammoniak-Kristalle mit angelagertem Wasser.
C ≥ 25 % C, N R: 34-50 10 % ≤ C < 25 % C R: 34 5 % ≤ C < 10 % Xi R: 36/37/38 Sicherheitshinweise
Die Kennzeichnungsdaten in der Tabelle beziehen sich auf die konzentrierte Lösung (= 32 %). Für andere Konzentrationsbereiche hat die EU[2] folgende Einstufungen festgelegt:
Geschichte
Salmiak soll bereits den alten Ägyptern bekannt gewesen sein und wurde das erste Mal von Arrhenius aufgrund seiner Erfolge bei der Beschreibung von Basen postuliert.
Verwendung
Ammoniakalische Netzmittelwäsche: Verzinkter Stahl kann nicht ohne weiteres mit Lacken beschichtet werden, da selbst spezielle Grundierungen auf der zinkoxid- und zinkcarbonathaltigen Oberfläche keinen ausreichenden Halt finden. Solche Flächen werden deshalb vor dem Grundieren mit stark verdünntem Ammoniakwasser gescheuert und abgewaschen (0,5 l 25%iges Ammoniakwasser werden mit 10 l Wasser und etwas Spülmittel vermischt), wobei die Lösung und der entstehende Schaum etwa 10 Minuten einwirken müssen.
Salmiakgeist wird als Hausmittel zur Reinigung von Oberflächen im Haushalt genutzt, gilt aber auch als Geheimtipp, um Wespen abzuwehren. Hierzu wird in geschlossenen Räumen ein wenig Salmiakgeist in eine kleine Schüssel gegeben, Wespen werden den Raum aufgrund des Geruchs von nun an meiden. Außerhalb eines Gebäudes nimmt man Papiertücher, die in Salmiakgeist eingelegt werden, und verteilt diese in der Nähe des Wespennestes.
Weiterhin wird empfohlen, ihn bei leichtem bis mittelstarkem Schimmelbefall an Wänden zur Reinigung und Bekämpfung des Pilzes einzusetzen.
Ein weiteres Anwendungsgebiet ist die Bekämpfung von Schädlingen wie Silberfischchen.
Gefahren
Ammoniumhydroxid-Lösungen ab einem Anteil von 10 % Ammoniak wirken ätzend.
Verschlucken von Ammoniakwasser ruft heftige Schmerzen, Magenkatarrh, blutiges Erbrechen, Lungen- und Stimmschädigungen hervor, die oft tödlichen Ausgang haben. Weiterhin greift es die Augen an.
Da als primäres Verdunstungsprodukt Ammoniak entsteht, gelten des Weiteren die Gefahren dieser Substanz auch für die Dämpfe von Salmiakgeist.
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu Ammoniaklösung in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. Mai 2008 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 1336-21-6 im European chemical Substances Information System ESIS
Weblinks
Wikimedia Foundation.
