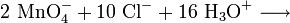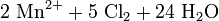- KMnO4
-
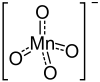
Strukturformel 
Allgemeines Name Kaliumpermanganat Andere Namen - Kaliumtetraoxomanganat(VII)
- Kaliummanganat(VII)
- Übermangansaures Kali(um)
Summenformel KMnO4 CAS-Nummer 7722-64-7 ATC-Code Kurzbeschreibung dunkelviolette Kristalle mit metallischem Glanz Eigenschaften Molare Masse 158,03 g·mol–1 Aggregatzustand fest[1]
Dichte 2,70 g·cm–3[1]
Schmelzpunkt Zersetzung oberhalb von 240 °C
Dampfdruck Löslichkeit mäßig in Wasser (64 g/L bei 20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 


Brand-
förderndGesundheits-
schädlichUmwelt-
gefährlich(O) (Xn) (N) R- und S-Sätze R: 8-22-50/53 S: (2)-60-61 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln MAK 0,5 mg·m–3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kaliumpermanganat (KMnO4) ist das Kaliumsalz der im freien Zustand unbekannten Permangansäure, HMnO4. Es ist ein tief rot-violetter, metallisch glänzender, kristalliner Feststoff und ein starkes Oxidationsmittel. Für die intensive Färbung des Salzes ist ausschließlich das Permanganat-Anion verantwortlich. Die Farbe ist auf Charge-Transfer-Übergänge zurückzuführen. In Permanganaten liegt das Mangan in seiner höchsten Oxidationsstufe VII vor.
Inhaltsverzeichnis
Eigenschaften
Kaliumpermanganat bildet dunkle rot-violett glänzende Kristalle, die mäßig in Wasser löslich sind und schon in geringer Konzentration eine intensiv violette Lösung ergeben. Beim Erhitzen schmelzen die Kristalle nicht, sondern zerfallen mit deutlichem Knistern unter Sauerstoffabgabe. Kristallines Kaliumpermanganat ist bei Raumtemperatur stabil, seine wässrigen Lösungen zersetzen sich aber mit der Zeit.
Da im Permanganat-Anion das Mangan in seiner höchsten Oxidationsstufe vorliegt, tritt es in Redoxreaktionen als ein sehr starkes Oxidationsmittel auf. So oxidiert Kaliumpermanganat z.B. Salzsäure zu Chlorgas (Labormethode zur Darstellung von Chlor):
Des Weiteren oxidiert es beispielsweise Sulfite zu Sulfaten, Fe(II)- zu Fe(III)-Ionen, Alkohole zu Carbonsäuren. Es kann auch die Zersetzung organischer Substanzen verursachen. Kaliumpermanganat ist brandfördernd.
Kaliumpermanganat zersetzt sich ab 240 °C zu Kaliummanganat (Kaliummanganat(VI), K2MnO4), Braunstein (MnO2), Kaliumoxid (K2O) und Sauerstoff (O2)[3]:
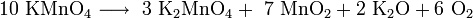
Bei noch höheren Temperaturen zerfällt auch das Kaliummanganat: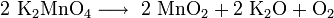
Schema der Redoxreaktion von Sulfit mit Permanganat: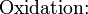
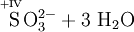

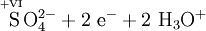
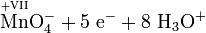

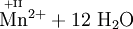
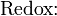
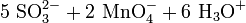

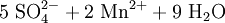
Als Komplex mit Kronenethern kann Kaliumpermanganat auch in unpolaren organischen Lösungsmitteln wie Benzen oder Toluol gelöst werden, was in der organischen Synthesechemie ausgenutzt wird.
Herstellung
Die technische Herstellung geht von Mangandioxid MnO2 aus, das mit Kaliumhydroxid und Luftsauerstoff zum grün gefärbten Kaliummanganat(VI) K2MnO4 reagiert. Dieses wird elektrochemisch zu Kaliumpermanganat weiterverarbeitet (anodische Oxidation) und kommt kristallin in den Handel.
Verwendung
Wegen der stark oxidierenden Wirkung wird Kaliumpermanganat unter anderem als Desinfektionsmittel, Desodorans und Algizid verwendet. In der quantitativen chemischen Analyse (Oxidimetrie, Manganometrie, eine Redoxtitration) wird es zur Bestimmung einer Vielzahl von Substanzen (beispielsweise Eisen, Nitrit, Oxalat, Glucose und indirekt auch Calcium) eingesetzt; hierbei wird der Endpunkt der Bestimmung durch das Verschwinden der violetten Farbe angezeigt. Im Labor wird alkalische Kaliumpermanganatlösung auch zur Reinigung von Glasgeräten verwendet. In der Fotografie dient es zum Nachweis von Fixiersalz (Natriumthiosulfat) und als Abschwächer von überbelichteten Bildern; dabei wird das Silber oxidiert. Außerdem wird es zum Bleichen von Naturschwämmen verwendet, um die typische weißgelbe Farbe zu bekommen.
Beim Auftropfen von Glycerin auf einen Überschuss des Salzes entzündet sich das Gemisch nach einigen Sekunden bis Minuten und verbrennt mit charakteristischer violetter Flamme. Diese zeitlich verzögert auftretende Reaktion wurde wegen der starken Hitze zum Start von Thermitreaktionen benutzt.
Medizin
In der Medizin wird Kaliumpermanganatlösung als Adstringens und Desinfektionsmittel zur äußerlichen Behandlung der Haut, u. a. bei Fußpilz oder Windeldermatitis, eingesetzt (ATC-Code D08AX06). In der Notfall-Toxikologie wird burgunderfarbene Kaliumpermanganat-Lösung (ca. 0,1%) für Magenspülungen bei Vergiftungen nach oraler Aufnahme oxidierbarer Gifte eingesetzt. [4] Ebenso findet es Verwendung bei der Therapie von parasitären Fischkrankheiten.
Mischungen mit Magnesium- oder Aluminiumpulver reagieren explosionsartig unter grellem Lichtblitz. Mit Glycerin, Ethylenglykol, Mannit, Acetaldehyd und zahlreichen anderen Stoffen erfolgt Selbstzündung. Kaliumpermanganat zerstört Geruchsstoffe und wirkt bakterientötend.
Historisches
Die Fotografen früherer Zeit verwendeten Kaliumpermanganat als Bestandteil von Blitzlichtpulvern. Kaliumpermanganat wurde zum Gurgeln bei Halsschmerzen verwendet und in der Küche, um altem Fleisch den Geruch zu nehmen und es wieder genießbar zu machen. Des weiteren färbt sich die Haut nach Kontakt mit Kaliumpermanganat-Lösung braun; deshalb wurden solche Lösungen auch gezielt als Bräunungsmittel eingesetzt.
Sicherheitshinweise
Kaliumpermanganat hat die Wassergefährdungsklasse 3 (stark wassergefährdend), was neben seiner Oxidationswirkung bei der Entsorgung von Permanganatresten zu beachten ist. Kaliumpermanganat ist von nur geringer akuter Toxizität (LD50(Ratte, oral) = 750 mg/kg), besitzt durch seine stark oxidierende Wirkung jedoch eine ausgeprägte Reizwirkung auf lebendes Gewebe, so dass es leicht zu Verätzungen kommt. Jeglicher Kontakt jenseits der medizinischen Anwendung oder gar orale Aufnahme ist also zu verhindern! Permanganatstäube verursachen am Auge eine Trübung der Hornhaut.
Die Verfärbung der Haut selbst, die bei Kontakt auftritt, hingegen ist harmlos und wird durch bei der Reduktion der Permanganats entstehenden Braunstein verursacht. Größere verfärbte Areale lassen sich durch Lösungen von Sulfiten wieder entfärben.
Infolge seiner stark oxidierenden Wirkung reagiert Kaliumpermanganat mit vielen reduzierend wirkenden bzw. brennbaren Stoffen teils sehr heftig; es kann Selbstentzündung eintreten. Mischungen mit solchen Stoffen, die nicht zu spontaner Reaktion führen, sind extrem feuergefährlich und reagieren dann unter Umständen explosionsartig.
Quellen
- ↑ a b c d e Eintrag zu Kaliumpermanganat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 15. Dezember 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7722-64-7 im European chemical Substances Information System ESIS
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006
- ↑ Roth, Daunderer, Kormann: Giftpflanzen - Pflanzengifte, ecomed Landsberg, 1988, ISBN 3-609-64810-4, S. 810ff
Weblinks
Wikimedia Foundation.