- Koronare Herzerkrankung
-
Klassifikation nach ICD-10 I20 – I25 Ischämische Herzkrankheiten ICD-10 online (WHO-Version 2006) 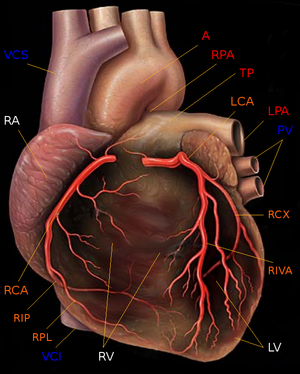 Grafische Darstellung des menschlichen Herzens mit Ansicht von vorne (ventral). Dargestellt sind:
Grafische Darstellung des menschlichen Herzens mit Ansicht von vorne (ventral). Dargestellt sind:
- Herzkammern und -vorhöfe (weiß): rechter Ventrikel (RV), rechter Vorhof (RA) und linker Ventrikel (LV).
Der linke Vorhof wird durch den linken Ventrikel verdeckt.
- Arterien (rot) und Venen (blau) des großen und kleinen Kreislaufs: Aortenbogen der Aorta (A), Truncus pulmonalis (TP) mit linker und rechter Pulmonalarterie (RAP und LAP) sowie Vena cava superior und inferior (VCS und VCI) sowie die linken Pulmonalvenen (PV).
Die rechten Pulmonalvenen sind durch den rechten Ventrikel verdeckt.
- Koronararterien (orange): Hauptstamm der linken Koronararterie (LCA) mit den Hauptästen Ramus circumflexus (RCX) und Ramus interventricularis anterior (RIVA) sowie der Hauptstamm der rechten Koronararterie mit den Hauptästen Ramus interventricularis posterior (RIP) und Ramus posterolateralis (RPL).
Die Koronarvenen sind nicht dargestellt.Die Koronare Herzkrankheit (KHK, gr. koronar (κορώνα) Krone, auch: ischämische Herzkrankheit (IHK)) ist eine Erkrankung der Herzkranzgefäße (Koronararterien).
Sie wird in den meisten Fällen durch Arteriosklerose (umgangssprachlich Arterienverkalkung) verursacht. Hierbei bedingen Ablagerungen in den Gefäßwänden eine Versteifung sowie eine zunehmende Verminderung des Gefäßquerschnitts. Die Folge ist eine Beeinträchtigung der Durchblutung und damit eine verminderte Sauerstoffversorgung der Herzmuskulatur. Es entsteht ein Missverhältnis zwischen Sauerstoffbedarf und Sauerstoffangebot, welches als Ischämie oder als Koronarinsuffizienz bezeichnet wird.
Das Leitsymptom der KHK ist die Angina pectoris (Brustenge). Mit zunehmendem Fortschreiten der Erkrankung erhöht sich die Wahrscheinlichkeit für das Auftreten von Begleiterscheinungen, wie Herzrhythmusstörungen und Herzinsuffizienz, sowie akuten, lebensbedrohlichen Komplikationen, wie Herzinfarkt und plötzlicher Herztod.
Die KHK ist in eine chronische Erkrankung, die im Verlauf von Jahren bis Jahrzehnten fortschreitet. Eine Heilung ist nicht möglich, jedoch kann die zunehmende Verschlechterung durch die Vermeidung oder die Behandlung von Risikofaktoren häufig eingedämmt werden. Des Weiteren kann die koronare Herzkrankheit medikamentös, durch therapeutische Eingriffe mittels Herzkatheter und operativ behandelt werden.
Die KHK ist mit ihren akuten Manifestationen die häufigste Todesursache in den Industrienationen.[1][2]
Inhaltsverzeichnis
Definition
Der Begriff der koronaren Herzkrankheit wird in der Literatur nicht von allen Autoren einheitlich definiert. Die koronare Herzkrankheit wird in vielen Lehrbüchern und in der nationalen Versorgungsleitlinie der Bundesärztekammer als die Manifestation der Arteriosklerose an den Herzkranzarterien definiert.[3] Darüber hinaus gibt es auch eine etwas weiter gefasste Definition. Hiernach entsteht die koronare Herzkrankheit durch eine Koronarinsuffizienz, bei der neben der Arteriosklerose noch zahlreiche andere Ursachen zugrunde liegen können.[2][4]
Epidemiologie
Herz-Kreislauferkrankungen, zu denen unter anderem die KHK gehört, sind mit Abstand die häufigste Todesursache in den Industrienationen. [5] [6] Dabei führen die KHK und ihre Manifestationen die Todesstatistik an. In Deutschland wurden im Jahr 2005 insgesamt mehr als 17 Prozent aller registrierten Todesfälle durch chronische KHK und Herzinfarkt verursacht.[7] Die Inzidenz der KHK beträgt etwa 0,6 % über alle Altersklassen hinweg mit Zunahme der Inzidenz in den höheren Altersklassen. Inzidenz bedeutet in diesem Zusammenhang, dass die Erkrankung sich klinisch manifestiert. In etwa 50 % der Fälle ist das Erstereignis ein Herzinfarkt, bei 10 % ein plötzlicher Herztod und beim Rest der Fälle definitionsgemäß eine instabile Angina pectoris. Etwa 2 % der Bevölkerung leidet unter einer asymptomatischen KHK, das heißt einer Durchblutungsstörung des Herzens ohne Krankheitserscheinungen wie Angina pectoris.
Ursachen und Krankheitsentstehung
Unabhängig davon, welche Definition zugrunde gelegt, ist die Arteriosklerose die Hauptursache der koronaren Herzkrankheit. Andere Ursachen treten sehr häufig in Kombination mit der Arteriosklerose auf. Für die Arteriosklerose gibt es zahlreiche Risikofaktoren, deren Vermeidung für die Vorbeugung (Prävention) dieser Erkrankung eine wichtige Rolle spielt
Ursachen und Entstehung der Arteriosklerose
- Hauptartikel Arteriosklerose
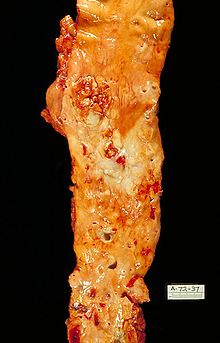 Die morphologischen Veränderungen bei Arteriosklerose am Beispiel einer eröffneten Aorta. Sektionspräparat von innen.
Die morphologischen Veränderungen bei Arteriosklerose am Beispiel einer eröffneten Aorta. Sektionspräparat von innen.
(Dr. Edwin P. Ewing, Jr.)Die Arteriosklerose (Arterienverkalkung) oder Atherosklerose ist die häufigste Systemerkrankung von Arterien. Im Volksmund wird sie auch als Arterienverkalkung bezeichnet. Nach der Definition der Weltgesundheitsorganisation (WHO) ist die Arteriosklerose eine variable Kombination von Veränderungen der Gefäßinnenwand (Intima) der Arterien, bestehend aus herdförmiger Ansammlung von Fettsubstanzen, komplexen Kohlenhydraten, Blut und Blutbestandteilen, Bindegewebe und Kalziumablagerungen, verbunden mit Veränderungen der Gefäßmuskelschicht (Media) [8] Diese Veränderungen führen zu Verhärtung der Gefäßwände, was mit einem Elastizitätsverlust einhergeht, sowie zu einer Verengung der Gefäßlichtung durch Wandverdickungen (arteriosklerotische Plaques) und sekundäre Thrombosen. Dadurch wird die Durchblutung des Herzmuskels eingeschränkt. In Abhängigkeit vom Ausmaß der Arteriosklerose kann der Herzmuskel bei körperlicher Belastung und psychischer Erregung oder bereits in Ruhe nicht mehr ausreichend durchblutet werden (Koronarinsuffizienz). Die Entstehung der Arteriosklerose ist ein in Stadien ablaufender, schleichender und fortschreitender Prozess, der über viele Jahre bis Jahrzehnte andauert. Zahlreiche Risikofaktoren begünstigen die Entstehung der Arteriosklerose.
Risikofaktoren der Arteriosklerose
Die Risikofaktoren für die Entstehung einer koronaren Arteriosklerose bei KHK und der entsprechenden Gefäßveränderungen bei anderen Erkrankungen, beispielsweise der peripheren arteriellen Verschlusskrankheit, unterscheiden sich nur unwesentlich. Allerdings gibt es einen spezifischen Bezug der Risikofaktoren zur KHK, der insbesondere hinsichtlich epidemiologischer Daten von Bedeutung ist.
Zu den Risikofaktoren gehören vom Patienten nicht beeinflussbare oder konstitutionelle Risikofaktoren, wie eine genetische Prädisposition, das Alter und das Geschlecht des Patienten. Zu den durch den Patienten mehr oder weniger beeinflussbaren Risikofaktoren gehören Fettstoffwechselstörungen im Allgemeinen und ein erhöhter Cholesterinspiegel (Hypercholesterinämie) im Speziellen, Übergewicht, Tabakrauchen, arterielle Hypertonie (arterieller Bluthochdruck), Diabetes mellitus, Bewegungsmangel und psychosoziale Faktoren. Die einzelnen Risikofaktoren wirken nicht nur synergistisch sondern erhöhen zusammen das kardiovaskuläre Risiko überproportional.[2]
Die Hypercholesterinämie gehört, zusammen mit Tabakrauchen, arteriellem Hypertonus und dem Diabetes mellitus, in Bezug auf Morbidität und Mortalität, zu den wichtigsten Risikofaktoren der KHK. In mehreren großen Studien konnte gezeigt werden, dass das kardiovaskuläre Risiko mit einer Erhöhung des Gesamtcholesterins und LDL-Cholesterin steigt.[9][10] Das HDL-Cholesterin wirkt dagegen kardioprotektiv. Raucher haben in Abhängigkeit von Anzahl der täglich gerauchten Zigaretten und der Anzahl der Jahre, in denen geraucht wurde (Zigarettenpackungsjahre, pack-years) ein 2–5-fach erhöhtes Risiko einen Herzinfarkt zu erleiden. Zwischen Blutdruck und dem Risiko an einer KHK zu erkranken besteht ab systolischen Werten über 125 mmHg und diastolischen Werten über 85 mmHg eine lineare Beziehung, das heißt dass über den genannten Blutdruckwerten das Risiko proportional mit der Erhöhung des Blutdrucks steigt.[2] Mehr als die Hälfte der an Diabetes mellitus erkrankten Patienten versterben an einer KHK. Diabetiker haben im Vergleich zu Nichtdiabetikern ein 2–3-fach erhöhtes Risiko an einer KHK zu erkranken.[11]
Ursachen der Koronarinsuffizienz
Alle im Folgenden genannten Ursachen steigern für sich alleine und vor allem in Kombination mit einer Arteriosklerose die Wahrscheinlichkeit eine koronare Herzkrankheit zu entwickeln. In Bezug auf die Pathophysiologie kann zwischen einer Verminderung des Sauerstoffangebots und einer Erhöhung des Sauerstoffbedarfs unterschieden werden.
Zu einer Verminderung des Sauerstoffangebots kann es unter anderem durch eine Verengung des Gefäßlumens kommen. Als Ursache spielen neben der Arteriosklerose vor allem Thrombosen und Embolien, infektiöse oder autoimmune Entzündungen der Gefäße (Vaskulitiden) und Koronarspasmen eine Rolle. Letztere können auch durch verschiedene Medikamente und durch Drogenmissbrauch (z. B. bei Kokain-Missbrauch) verursacht werden. Eine Kompression der Koronararterien von außen, beispielsweise bei Herzhypertrophie oder verschiedenen Tumoren, führt ebenfalls zu einer Verminderung des Sauerstoffangebots. Darüber hinaus ist die Hypoxämie (zum Beispiel bei Anämie, Ateminsuffizienz und Kohlenmonoxidvergiftung), bei welcher der Sauerstoffgehalt im Blut vermindert ist, eine mögliche Ursache der Koronarinsuffizienz. Auch eine Zunahme der Blutviskosität, wie sie bei Leukämien vorkommt, ist eine weitere seltene Ursache.
Eine Erhöhung des Sauerstoffbedarfs tritt unter anderem bei Herzmuskelhypertrophie, bestimmten Formen der Kardiomyopathie, Herzklappenerkrankungen, Hyperthyreose, Bluthochdruck, Infektionskrankheiten und Fieber auf. Auch körperliche Belastung und emotionaler Stress erhöhen den Sauerstoffbedarf. Diese Belastungen lösen aber nur eine Koronarinsuffizienz aus, wenn entsprechende Erkrankungen vorliegen. [2]
Klinische Erscheinungen
Das Leitsymptom der KHK ist die Angina pectoris. Synonyme sind die Kurzform AP-Symptomatik sowie pektanginöse Beschwerden. Für die chronische KHK sind weitere Symptome relativ unspezifisch. Neben der AP-Symptomatik treten häufig Atemnot (Dyspnoe), Blutdruckabfall (Hypotonie), eine Erhöhung der Herzfrequenz (Tachykardie), vermehrte Schweißproduktion, Gesichtsblässe und Todesangst auf. Eine KHK verläuft nicht selten asymptomatisch. Das bedeutet, dass bei diesen Patienten keine AP-Symptomatik oder andere Symptome auftreten. Diese Form der KHK wird als latente KHK oder stumme Myokardischämie bezeichnet. Diese Form tritt häufig bei älteren Patienten und bei Diabetikern auf. Bei Letzteren spielt die diabetische Polyneuropathie, die durch den gestörten Zuckerstoffwechsel verursacht wird, eine entscheidende Rolle. Die Diagnose einer asymptomatischen KHK ist schwierig. Dadurch, dass die Patienten keine Schmerzen bei Myokardischämien verspüren, werden Herzinfarkte und andere Manifestationen der KHK häufig gar nicht oder zu spät bemerkt.
Angina pectoris als Leitsymptom
- Hauptartikel Angina pectoris
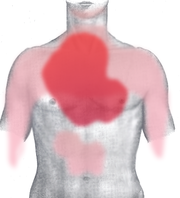
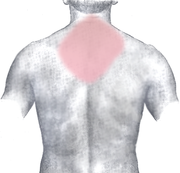
Bei der Angina pectoris handelt es sich typischerweise um dumpfe, drückende, einschnürende und häufig brennende Schmerzen, die hinter dem Brustbein (retrosternal) lokalisiert sind. Von den Betroffenen wird der Schmerz häufig als „Engegefühl in der Brust“ beschrieben. Typisch ist außerdem eine Ausstrahlung des Schmerzes in den linken oder seltener in beide Arme. Darüber hinaus können pektanginöse Beschwerden ein atypisches Bild zeigen (atypische Angina pectoris), das heißt sie können einen anderen Schmerzcharakter sowie eine andere Schmerzlokalisation haben und sie können in andere Körperregionen (Hals, Unterkiefer, Oberbauch, Rücken) oder überhaupt nicht ausstrahlen. Der Mechanismus, wie es zu einer Schmerzwahrnehmung (Nozizeption) bei Ischämie kommt, ist bisher noch nicht sicher geklärt.
Eine Reihe anderer Erkrankungen können sich ebenfalls durch Brustschmerz äußern.
Stabile Angina pectoris
Es gibt verschiedene Formen der Angina pectoris. Die stabile Angina pectoris, ist das führende Symptom der chronischen KHK. Dabei handelt es sich um wiederholende, kurzzeitige Schmerzanfälle mit der oben beschriebenen Symptomatik, die bei körperlicher Belastung auftreten. Dabei verbraucht der Herzmuskel mehr Sauerstoff. Die sklerotischen Koronararterien können jedoch der Herzmuskulatur nicht genügend Sauerstoff zuführen. Die stabile Angina pectoris tritt im Anfangsstadium vor allem bei Belastung auf und wird daher als „Belastungsangina“ bezeichnet. Nach Beendigung der Belastung sind die Patienten in der Regel nach wenigen Minuten wieder beschwerdefrei. Eine Ausnahme bildet eine Sonderform der stabilen Angina pectoris, die sogenannte „Walk-through-Angina“. Wenn die körperliche Belastung über längere Zeit beibehalten wird, bessern sich die Beschwerden bei dieser Form wieder. Neben der körperlichen Belastung gibt es noch andere Ursachen, die eine stabile Angina pectoris auslösen können. Dazu gehören psychische Erregung, Kälte und ausgiebige Mahlzeiten. Charakteristisch für die stabile Angina pectoris ist darüber hinaus, dass die Gabe von Nitropräparaten im Anfall zu einer raschen Besserung der Schmerzen führt. Nitropräparate führen zu einer Vasodilatation der Blutgefäße. Im Herzmuskel (und anderen Organen) wird dadurch die Durchblutung des Herzmuskels gesteigert und das Sauerstoffdefizit, dass die AP-Symptomatik ausgelöst hat, beseitigt. Die stabile Angina pectoris kann in verschiedene Schweregrade eingeteilt werden. Dies spielt vor allem für die Therapie der chronischen KHK eine Rolle.
Stadium Definition CCS 0 Keine Angina pectoris, auch nicht bei stärkster körperlicher Belastung CCS I Angina pectoris nur bei sehr starker körperlicher Belastung CCS II Angina pectoris bei mäßiger körperlicher Belastung, z. B. bei raschem Treppensteigen CCS III Angina pectoris bei normalen täglichen Aktivitäten (z. B. bei längerem Gehen) CCS IV Angina pectoris bei jeder körperlichen Belastung oder bereits in Ruhe Canadian Class Classification (CCS): Stadieneinteilung der stabilen Angina pectoris,
von Canadian Cardiovascular Society (modif. nach Renz-Polster, S.63)[2]Instabile Angina pectoris
Von der stabilen Angina pectoris müssen andere Formen abgegrenzt werden, insbesondere die instabile Angina pectoris, die im Rahmen eines akuten Koronarsyndroms auftreten kann. Jede erstmalig aufgetretene Angina pectoris bei zuvor asymptomatischen Patienten wird als instabile Angina pectoris gewertet. Als instabile Angina pectoris wird außerdem eine AP-Symptomatik bezeichnet, die in Ruhe auftritt („Ruheangina“), sowie eine AP-Symptomatik, die in Stärke, Dauer und/oder Frequenz zunimmt („Crescendo-Angina“). Die Unterscheidung zwischen stabiler und instabiler Angina pectoris hat eine große differentialdiagnostische Bedeutung.
Untersuchungsmethoden
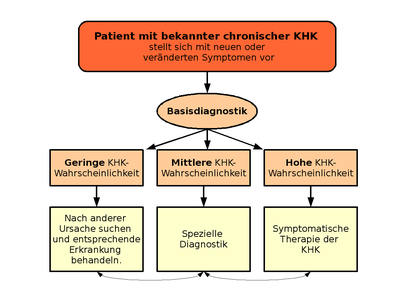
An erster Stelle steht die Basisdiagnostik. Die Diagnosemaßnahmen, die ein Arzt einleitet um eine chronische KHK zu diagnostizieren sind abhängig von der Manifestation der KHK und dem Schweregrad. Der typische, an chronischer KHK erkrankte Patient, leidet meist unter einer stabilen Angina pectoris. Bei diesen kann mit Hilfe einer ausführlichen Anamnese (Medizin) mit Risikostratifizierung, einer körperlichen Untersuchung, der Auswertung verschiedener Laborparameter sowie der Interpretation eines Ruhe- und Belastungs-Elektrokardiogramms eine relativ sichere Verdachtsdiagnose erhoben werden. Eine erweitere Diagnoseprozedur ist meist nicht erforderlich.
Dagegen ist die Diagnose einer asymptomatischen KHK schwierig. Die Erstmanifestation der KHK ist in diesen Fällen sehr häufig das akute Koronarsyndrom. Allerdings können regelmäßige Hausarztbesuche mit auf den Patienten zugeschnittenen Untersuchungen dazu beitragen, dass diese Form rechtzeitig erkannt wird, bevor es zu einer lebensbedrohlichen Komplikation kommt. Bei Patienten mit Verdacht auf ein akutes Koronarsyndrom unterscheidet sich die Diagnoseprozedur maßgeblich zur chronischen KHK.
Basisdiagnostik
Anamnese
Die Verdachtsdiagnose der KHK kann häufig schon durch eine ausführliche Anamnese gestellt werden. Wenn ein Patient unter den typischen pektanginösen Beschwerden leidet, ist dies hochverdächtig für das Vorliegen einer KHK. Um den Verdacht zu erhärten, sollte der Patient möglichst genau zum Schmerzcharakter, zu bestehenden Risikofaktoren sowie zu Begleitsymptomen und anderen bekannten Erkrankungen, wie der peripheren arteriellen Verschlusskrankheit (PAVK) und zurückliegenden Schlaganfällen befragt werden, deren Hauptursache ebenfalls die Arteriosklerose ist. Patienten mit einer PAVK oder zurückliegenden Schlaganfällen haben ebenfalls ein erhöhtes Risiko an einer KHK zu erkranken. Zusätzlich sollte eine ausführliche Familienanamnese erhoben werden, um zu klären, ob Herzkreislauferkrankungen naher Verwandter bekannt sind, da eine genetische Prädisposition vorliegen könnte, die das Risiko für eine chronische KHK erhöhen würde.[2] Durch eine genaue Anamnese können die meisten Differentialdiagnosen mit hoher Wahrscheinlichkeit ausgeschlossen werden.
Körperliche Untersuchung
Für die KHK charakteristische Untersuchungsbefunde lassen sich sehr selten erheben.[2] Die körperliche Untersuchung dient vor allem einer Erhärtung der Verdachtsdiagnose sowie dem Aufdecken eventuell vorhandener Begleiterkrankungen und Risikofaktoren. Die im folgenden genannten Beispiele stellen nur eine kleine Auswahl von möglichen Untersuchungsbefunden dar. So können eventuell Zeichen einer Hypercholesterinämie, wie Xanthelasmen und Xanthome als Risikofaktoren aufgedeckt werden. Kalte Beine und fehlende periphere Pulse können auf eine periphere arterielle Verschlusskrankheit (PAVK) hinweisen. Gefäßgeräusche, beispielsweise bei Auskultation der Arteria carotis externa, sind ebenfalls häufig bei Arteriosklerose zu finden. Durch Auskultation des Herzens können andere Herzerkrankungen, wie beispielsweise eine Aortenklappenstenose, als Ursache für die Brustschmerzen aufgedeckt werden. Rasselgeräusche bei Auskultation der Lunge, eine sichtbare Stauung der Halsvenen, Unterschenkelödeme sowie eine tastbare Leber können auf eine manifeste Herzinsuffizienz hinweisen. Die Palpation der Leber und bestimmte Veränderungen des Auges und Geschwüre der Unterschenkel (Ulcus cruris) sind häufig Zeichen einer manifesten Zuckerkrankheit (Diabetes mellitus). Mit einer Augenhintergrundspiegelung kann ein über längere Zeit bestehender Bluthochdruck aufdeckt werden.[4] Zur körperlichen Untersuchung gehört im weitesten Sinne auch die routinemäßige Blutdruckmessung, mit der ein eventuell vorhandener Bluthochdruck, ein wichtiger Risikofaktor der KHK, diagnostiziert werden kann.
Labor
Zum Nachweis von Risikofaktoren (Diabetes mellitus und Fettstoffwechselstörungen) werden Blutzucker, HbA1c, LDL-, HDL-, Gesamtcholesterin und Triglyceride bestimmt. Als Weiteres üblicherweise zusätzlich kleinen Blutbildes, Entzündungsparameter und TSH. Außerhalb der klinischen Praxis kann eine Protein-Muster-Diagnostik zur Bestimmung des Artherioskleroserisikos durchgeführt werden.
Bei instabiler Angina pectoris und Verdacht auf Herzinfarkt ist die Bestimmung von Herzenzymen notwendig. Das herzspezifische Troponin[12] ist hier der erste Marker für eine akute Ischämie. Im weiteren Verlauf steigen die Creatininkinase (CK) und dessen herzspezifischer Anteil (CK-MB) an sowie Glutamat-Oxalacetat-Transaminase (GOT) und Lactatdehydrogenase (LDH).
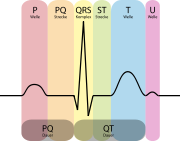
Elektrokardiogramm
Das EKG ist eine nicht-invasive Untersuchungsmethode bei der die elektrische Aktivität der Herzmuskulatur mit Elektroden abgeleitet wird. Es gibt im Wesentlichen drei verschiedene Formen, die bei der Diagnose einer chronischen KHK von Bedeutung sind. Das Ruhe-EKG ist Bestandteil der Basisdiagnostik. Belastungs-EKG und Langzeit-EKG werden in Abhängigkeit vom Risikoprofil des Patienten und der Vortestwahrscheinlichkeit durchgeführt
Ruhe-EKG
Das Ruhe-EKG gehört zur grundlegenden internistischen Diagnostik, nicht nur bei Verdacht auf eine koronare Herzkrankheit. Für einen sicheren Nachweis einer chronischen KHK ohne bisher abgelaufenen Herzinfarkt ist das Ruhe-EKG allerdings eher ungeeignet. Es kommen Zeichen zur Darstellung, die für einen abgelaufenen Infarkt oder auch eine Verdickung des Herzmuskels im Rahmen einer Bluthochdruckerkrankung sprechen. Im weiteren können Herzrhythmusstörungen wie Vorhofflimmern oder häufige Extraschläge (ventrikuläre Extrasystolie) gesehen werden, die ebenfalls ein indirektes Zeichen für das Vorliegen einer KHK sein können.[3].
Belastungs-EKG
Das Belastungs-EKG wird meist mit einem Fahrradergometer aufgezeichnet, abhängig vom Zustand des Patienten entweder im Liegen oder Sitzen. Es stellt den nächsten Schritt in der Diagnostik bei Verdacht auf eine koronare Herzerkrankung dar. Die Sensitivität (50–70 %) und Spezifität (60–90 %) sind bedeutend höher als beim Ruhe-EKG. Wie hoch, ist u. a. abhängig vom Schweregrad der Erkrankung, vom Geschlecht und vom Ausmaß der Belastung (Erreichen der Ausbelastungs-Herzfrequenz). Der Verdacht auf eine bestehende chronische KHK wird durch Erregungsrückbildungsstörungen unter Belastung, das vermehrte auftreten von Extraschlägen oder plötzlichen Blutdruckabfall unter Belastung erhärtet.
Manche Herzmedikamente (Digitalisglykoside) erschweren die Beurteilbarkeit von Erregungsrückbildungsstörungen, auch kann die Einnahmen von Herzfrequenzsenkenden Medikamenten die Beurteilbarkeit einschränken, da die Zielfrequenz nicht erreicht wird, und der Patient so nicht voll ausbelastet ist. Der Verdacht auf einen akuten Herzinfarkt ist eine absolute Kontraindikation und auch bei schon vor der Untersuchung deutlich überhöhtem Blutdruck oder Herzfrequenz sollte sie nicht durchgeführt werden.
Langzeit-EKG
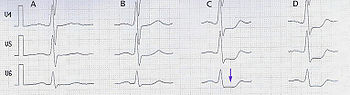
Ist der Befund des Belastungs-EKGs negativ, es besteht jedoch weiterhin die Verdachtsdiagnose chronische KHK, kann ein Langzeit-EKG sinnvoll sein. Insbesondere für das Aufdecken stummer Ischämien kann es hilfreich sein. Ein positives Testergebnis liegt mit hoher Wahrscheinlichkeit vor, wenn wiederholt ST-Streckensenkungen auftreten, die länger als 1 Minute andauern.[1] In der Praxis wird das Langzeit-EKG für diese Indikation eher selten verwandt.
Echokardiographie
Im Rahmen der Ultraschall-Untersuchung des Herzens können Wandbewegungsstörungen gesehen werden, die nach abgelaufenen Herzinfarkt im Sinne einer Narbe bestehen bleiben. Aber auch diverse andere Erkrankungen des Herzens (Klappen, Herzmuskel) können erkannt werden.
Dopplersonographie der Gefäße
Unter dem Gesichtspunkt, dass alle Gefäße im Körper etwa gleich stark von Atherosklerose betroffen sind, kann eine Dopplersonographie der Gefäße, meist der Halsschlagadern durchgeführt werden. Sind hier Veränderungen zu sehen, ist die Wahrscheinlichkeit hoch, dass an anderen Stellen, wie z.B.- den Herzkranzgefäßen, ebenfalls Veränderungen vorliegen.
Risikostratifizierung
In der Zusammenschau der erhobenen Befunde wird im Rahmen einer Risikostratifizierung das weitere diagnostische Vorgehen geplant. Es muss die Entscheidung gefällt werden, ob die Beschwerden
- mit höchster Wahrscheinlichkeit nicht vom Herzen kommen, dann muss nach anderen Ursachen geforscht werden,
- sie eher nicht vom Herzen kommen und man weitere nicht-invasive Diagnostik macht, oder
- die Wahrscheinlichkeit für das Vorliegen einer relevanten KHK als eher hoch bis sicher eingeschätzt wird.
Eine wertvolle Hilfe stellt das Punktesystem des Euro Heart Survey dar, bei dem Punkte für Risikofaktoren, Schweregrad der stabilen Angina pectoris und Komorbiditäten vergeben werden. [13]
Risikofaktor Punkte Eine oder mehrere Komorbiditäten 86 Diabetes mellitus 57 Schweregrad der Angina pectoris - CCS I
0 - CCS II
54 - CCS III
91 Symptome > 6 Monate CCS III 80 Beeinträchtige linksventrikuläre Funktion 114 ST-Streckensenkung oder T-Negativierung im EKG 34 Risikostratifizierung bei bekannter KHK und Angina pectoris mit Hilfe des Punktesystems des Euro Heart Survey (modif.)[13] Erweiterte Diagnostik
Die weiterführende Diagnostik bei bestehendem Verdacht auf eine koronare Herzkrankheit verfolgt zwei Ziele. Zum Einen Nachweis von belastungsabhängigen Wandbewegungsstörungen der Herzkammern. Liegen dies vor besteht die hohe Wahrscheinlichkeit, das das Gefäß, das den Wandabschnitt mit Blut versorgt verengt ist und der Blutfluss unter der Belastung nicht ausreichend ist. Hierfür werden die Stress-Echokardiographie, die Myokardszintigrafie und seit kurzem auch die Magnetresonanztomographie des Herzens (Cardio-MR) verwendet. Das zweite Ziel ist die Darstellung der Herzkranzgefäße als Nachweis der vermuteten Gefäßenge, klassisch mit Hilfe der Koronarangiographie und seit neuerem auch nicht-invasiv mit einer Computertomographie des Herzens.
Stressechokardiographie
Bei der Stressechokardiographie wird der Herzmuskel unter Belastung mittels Ultraschallbildgebung dargestellt. Die Belastung wird hierbei, ähnlich dem Belastungs-EKG durch Fahrradfahren im Liegen erzeugt, oder auch mittels Medikamenten. Durch die Belastung soll bei klinisch relevanter Stenose eine Wandbewegungsstörung ausgelöst werden.[14]
Myokardszintigrafie
Bei der Myokardszintigrafie handelt es sich um eine nuklearmedizinische Untersuchungsmethode, deren Hauptindikation die Erfassung einer KHK bei mittlerer Wahrscheinlichkeit ist. Als Radionuklid wird 201Thallium oder 99mTechnetium verwendet, die jeweils intravenös injiziert werden. Mit der Myokardszintigrafie lassen sich Ausmaß, Schweregrad und Lokalisation der Ischämie feststellen sowie Aussagen über die Prognose des Patienten treffen. Die Myokardszintigrafie ist bezüglich Sensitivität und Spezifität dem Belastungs-EKG überlegen, insbesondere bei Vorliegen einer 1-Gefäßerkrankung.[1].
Zur Diagnose der KHK wird die Myokardszintigrafie zunächst, wenn keine Kontraindikationen bestehen, bei Belastung auf einem Fahrradergometer durchgeführt. Alternativ, wenn eine körperliche Belastung nicht möglich ist, kann diese pharmakologisch induziert werden, beispielsweise mit den Vasodilatatoren Adenosin und Dipyridamol oder dem Katecholaminanalogon Dobutamin.[3][15] Beim Gesunden kann die Durchblutung bei Belastung erheblich gesteigert werden, beim KHK-Patienten gibt es in Abhängigkeit von den betroffenen Koronararterien in bestimmten Arealen Durchblutungsdefizite. Nach mehrstündiger Pause wird erneut ein Szintigramm angefertigt, allerdings ohne Belastung des Patienten. In dieser Zeit hat sich die Durchblutung wieder normalisiert, so dass sich der Tracer gleichmäßig im Herzmuskel verteilt. Finden sich die gleichen Areale mit verminderter Anreicherung, handelt es sich mit hoher Wahrscheinlichkeit um eine irreversible Myokardischämie, das heißt um eine Infarktnarbe, die durch einen zurückliegenden Herzinfarkt verursacht wurde.
Die Untersuchung mit 201Thallium kann neben Aussagen zur Durchblutung zusätzlich Informationen zur Vitalität des Herzmuskels geben.
Die Myokardszintigrafie mit 99mTechnetium kann wegen der besseren Ausbeute als Herzphasen-getriggerte Aufnahme durchgeführt werden, soweit keine ausgeprägten Herzrhythmusstörungen vorliegen. Dadurch lassen sich die Funktion der linken Herzkammer unter Belastung und in Ruhe beurteilen und indirekt endsystolisches und enddiastolisches Volumen sowie die Auswurffraktion bestimmen. Während der Belastung treten bei KHK-Patienten Wandbewegungsstörungen des Herzens auf und die Auswurffraktion verringert sich.[1]
Magnetresonanztomographie des Herzens
Das Cardio-MR ist eine noch relativ neue, zeitaufwendige, wenig verbreitete Untersuchungsmethode, die in absehbarer Zeit möglicherweise die Myokardszinitigraphie verdrängen wird. Hierbei wird unter medikamentöser Belastung ebenfalls nach Wandbewegungsstörungen gesucht, zusätzlich können Aussagen über die Pumpleistung und abgelaufene Entzündungen des Herzmuskels gemacht werden. Wird keine Wandbewegungsstörung gesehen, ist eine koronare Herzerkrankung mit annähernd 100 %-iger Sicherheit ausgeschlossen.
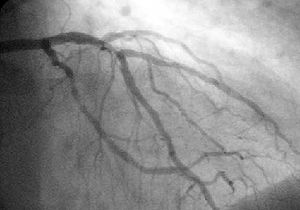
Koronarangiografie und Ventrikulographie
Mit Hilfe der diagnostischen Koronarangiographie können Koronararterien dargestellt und deren Anatomie sowie das Ausmaß und die Lokalisation eventueller Stenosen beurteilt werden. Sie ist die Untersuchung mit der besten Aussagekraft. Bei dieser Untersuchung wird ein Herzkatheter über die Arteria femoralis (Oberschenkelarterie) oder seltener über die Arteria brachialis (Oberarmarterie) bis zu den Abgängen der Koronararterien aus der Aorta vorgeschoben und Kontrastmittel in die Abgänge injiziert. Mit Hilfe von Röntgenstrahlung können die Koronararterien sichtbar gemacht und beurteilt werden[16]. Der Katheter kann, unter Überbrückung der Aortenklappe, weiter in die linke Herzkammer vorgeschoben werden. Diese Untersuchung wird als Ventrikulografie bezeichnet. Sie ermöglicht zusätzlich regionale Kontraktionsstörungen sichtbar zu machen, die zum Beispiel Hinweise auf zurückliegende Herzinfarkte bieten können, sowie eine Beurteilung der linksventrikulären Pumpfunktion über Berechnung der Auswurffraktion und die Bestimmung Dehnbarkeit der Herzmuskulatur (Compliance) durch Bestimmung des enddiastolischen Volumens [1].
Da es sich bei der Koronarangiografie und der Ventrikuloangiografie um invasive Untersuchungsmethoden handelt, kann es neben relativ ungefährlichen Komplikationen (beispielsweise Hämatome an der Einstichstelle) in sehr seltenen Fällen zu schwerwiegenden lebensbedrohlichen Komplikationen kommen. Dazu gehören vor allem Herzinfarkte, Schlaganfall, Spaltungen (Dissektionen) der Gefäßwände, Herzrupturen, Luftembolien und Arrhythmien.[3] Die Letalität der Untersuchung liegt unter 1:1000.[1]
Aufgrund der nicht völlig ausschließbaren Risiken für das Auftreten von Komplikationen, der Strahlenbelastung sowie der Belastung der Nieren durch das Röntgenkontrastmittel, sollte die Indikation der Koronarangiografie zur Diagnose einer chronischen KHK relativ streng gestellt und im Sinne einer Nutzen-Risikoanalyse abgewägt werden. Nach den Empfehlungen der nationalen Versorgungsleitlinie (NVL) sollte diese Untersuchung nur dann erfolgen, wenn entweder alle nicht-invasiven Untersuchungsmethoden ohne Ergebnis ausgeschöpft wurden und trotzdem die Verdachtsdiagnose chronische KHK wahrscheinlich ist oder wenn der Patient von Revaskularisationamaßnahmen profitieren könnte[3]. Bei der Abwägung spielen des weiteren bestehende kardiovaskuläre Risikofaktoren, zurückliegende Herzinfarkte und andere bestehende Herz-Kreislauferkrankungen, die Einschätzung der Lebensqualität durch den Patienten sowie der Schweregrad der stabilen Angina pectoris nach CSS-Klassifikation eine wichtige Rolle. Für Letztere gilt, dass bei einem CSS-Stadium < III sowie bei erfolgreicher konservativer Pharmakotherapie, normalerweise keine Indikation für eine erneute Koronarangiografie besteht.[3]
Computertomographie des Herzens
Das Cardio-CT ist, wie auch das Cardio-MR, ein neues, noch nicht etabliertes Untersuchungsverfahren. Hierbei wird eine Röntgenschichtaufnahme des Herzens gemacht bei der zunächst der Kalk-Score bestimmt wird, d.h. die Menge an Kalk im erfassten Bereich. Überschreitet dieser einen bestimmten Grenzwert wird die Untersuchung abgebrochen, da die Aussagekraft bzgl. Engstellen in den Herzkranzgefäßen zu gering ist. Kann die Untersuchung fortgeführt werden ist die Aussagekraft über das Ausmaß einer KHK recht gut. Da bei Diagnose einer KHK im Cardio-CT eine Herzkatheteruntersuchung meist angeschlossen werden muss, sollte die Indikation, alleine aus Gründen der Strahlenhygiene eng gestellt werden. In Frage kommen hier Patienten bei denen nur wenig für das Vorliegen einer KHK spricht, man aber doch nicht mit letzter Sicherheit diese nicht-invasiv ausschließen kann.
Vorbeugung
Unter Prävention oder Prophylaxe versteht man in der Medizin Maßnahmen, die eine Schädigung eines gesunden Organismus verhindern können (Primärprävention), die symptomlose Krankheitsfrühstadien aufdecken, so dass diese frühzeitig behandelt werden können (Sekundärprävention) sowie Maßnahmen, die Rückfälle der Erkrankung verhindern oder eine Progredienz der Erkrankung verlangsamen können (Tertiärprävention). Im Falle KHK sind die Übergänge zwischen den verschiedenen Präventionsformen fließend, so dass eine strenge Unterscheidung in diesem Artikel verzichtet wird.
Bei der Prävention der KHK spielt für die Prävention vor allem das Risikofaktoren-Management eine Rolle. Darunter versteht man Maßnahmen, die Risikofaktoren reduzieren oder besser vermeiden können. Zur Reduktion von Risikofaktoren sind insbesondere Lebensstilveränderungen des Patienten sowie eventuell eine Prävention mit Arzneimitteln notwendig. Zur Prävention gehört damit indirekt die medikamentöse Therapie von Begleiterkrankungen wie Bluthochdruck, Diabetes mellitus und Fettstoffwechselsstörungen, da es sich hier ebenfalls um Risikofaktoren handelt.
Änderung des Lebensstils
KHK-Patienten können durch Änderungen ihres Lebensstils einen wichtigen Beitrag dazu leisten den Verlauf ihrer Erkrankung positiv zu beeinflussen. Zu den erfolgsversprechenden Lebensstiländerungen gehören die Beendigung des Rauchens, eine zielgerichtete Ernährungsumstellung und eine Gewichtsreduktion bei bestehendem Übergewicht.
Das Rauchen ist einer der wichtigsten kardiovaskulären Risikofaktoren. Durch Rauchentwöhnung kann das Risiko von kardiovaskulären Ereignissen um bis zu 50 % verringert werden.[17]. Die Wirkung einer zielgerichteten Ernährungsumstellung geht über die reine Senkung des Cholesterinspiegels hinaus. Maßstab sollte die sog. mediterrane Kost sein, die sich durch kaloriengerechte, ballaststoffreiche und fettarme Nahrung auszeichnet und außerdem reich an ungesättigten und Omega-3-Fettsäuren ist. Durch Messung des Body-Mass-Index (BMI) sowie des Bauchumfangs kann der Schweregrad des Übergewichts dokumentiert werden. Der Schweregrad korreliert mit der Häufigkeit und der Prognose der koronaren Herzkrankheit und anderen Erkrankungen, vor allem Diabetes mellitus Typ 2, arterieller Hypertonie, Herzinsuffizienz, Fettstoffwechselstörungen und Störungen der Blutgerinnung. [12]
Das Deutsche Ärzteblatt zieht in einem Übersichtsartikel zur Sekundärprävention bei KHK folgendes Fazit: „Die Wirksamkeit der angeführten Lebensstilveränderungen in der Summe dürfte die Effektivität einer kombinierten medikamentösen Therapie um das Mehrfache überschreiten.“[18]
Lebensstilveränderung Ref. ARR % Studiendauer (Jahre) Anzahl Studienteilnehmer NNT/1 Jahr Rauchen aufgeben [19] 7.7 4.8 5878 62 fettarme Kost [20] 16 3 100 19 fettarme Kost [20] 38 12 100 32 „mediterrane“ Kost [21] 12 4 605 33 Ausgleichssport [22] 2.2 3 4554 136 Stressmanagement [23] 20.9 5 107 24 Fettreduzierte Kost: < 20 % Fettanteil. Studien mit < 30 % erbrachten keinen Nutzen.
„Mediterrane“ Kost: Brot, Gemüse, Obst, Fisch, ungesättigte Fettsäuren, Olivenöl; wenig Fleisch.
Ausgleichssport: mindestens 3x/Woche, 30 min.
ARR = absolute Risikoreduktion für Tod sowie nichttödlichen Herzinfarkt; NNT = number needed to treat.Medikamentöse Prävention
Thrombozytenaggregationshemmer
Thrombozyten (Blutplättchen) sind kernlose Zellen, die eine wichtige Rolle bei der Blutgerinnung (Hämostase) spielen. Durch Hemmung der Thrombozytenaggregation wird die Wahrscheinlichkeit einer Thrombosebildung in den Koronararterien verringert. Die Gefahr, an einem akuten Koronarsyndrom zu erkranken oder an einem Herzinfarkt zu versterben, wird gesenkt.
Zu den gängigsten Thrombozytenaggregationshemmern gehören Acetylsalicylsäure (ASS) und Clopidogrel. Mittel der Wahl ist ASS, da der Nutzen für den Patienten, sowohl ohne als auch mit zurückliegendem Herzinfarkt, bezüglich Mortalität und Morbidität, verglichen mit anderen Thrombozytenaggregationshemmern mindestens gleichwertig ist. Die Dosierung ist abhängig vom kardiovaskulären Risikoprofil des Patienten.[3] Bei Patienten mit hohem kardiovaskulären Risiko oder mit stabiler Angina pectoris sinkt unter ASS-Medikation die Letalität. Eine Indikation für Clopidogrel besteht bei Kontraindikationen oder ASS-Unverträglichkeit. [12]
Cholesterinsenkende Arzneimittel
Medikamente aus der Gruppe der Statine hemmen die HMG-CoA-Reduktase, ein Enzym im Cholesterinstoffwechsel, und damit die körpereigene Cholesterinproduktion. Man unterstellt ihnen auch eine gewisse Stabilisierung von atheromatösen Plaques.
Vitamin D
In der Health Professionals Follow-up Study war das Risiko für einen Myokardinfarkt bei Männern mit Vitamin-D-Mangel (Plasma-25-OH-Vitamin D von höchstens 15 ng / mL) um den Faktor 2,4 höher als bei Gleichaltrigen mit ausreichender Vitamin-D-Versorgung (Plasma-25(OH) D von mindestens 30 ng / mL). Selbst unter Berücksichtigung von KHK-Risikofaktoren wie positive Familienanamnese, Hypertonie, ungünstiges Lipidprofil und Übergewicht war das Myokardinfarkt-Risiko bei niedrigen Vitamin-D-Werten immer noch verdoppelt [24]. Erhoben wurden diese Studiendaten bei 18 225 Männern im Alter zwischen 40 und 75 Jahren, deren Blut untersucht worden war. Zu Studienbeginn hatte noch keiner der Männer eine KHK. Innerhalb der nächsten zehn Jahre hatten 454 Studienteilnehmer einen nichttödlichen Herzinfarkt oder ein tödliches KHK-Ereignis erlitten. In einer anderen Studie mit mehr als 3000 Männern und Frauen waren bei denen mit niedrigen Vitamin-D-Werten (median 7,7 und 13,3 ng / mL) innerhalb von 7,7 Jahren die kardiovaskuläre sowie auch die Gesamtsterberate verdoppelt [25]. Als Vergleich dienten Teilnehmer mit guter Vitamin-D-Versorgung (median 28,4 ng / mL).[26]
Behandlung
Bei einer Erkrankung der kleinen Gefäße ist bisher außer der medikamentösen Therapie keine invasive Behandlungsmethode erfolgsversprechend. Bei Erkrankung der großen Gefäße besteht die Möglichkeit der Aufdehnung mittels eines Ballonkatheters oder die Durchführung einer Bypassoperation. Für eine einheitliche Qualität bei der Therapie bieten die gesetzlichen Krankenkassen seit Mitte 2004 Disease-Management-Programme (DMP) an.
Medikamentöse Therapie
Nitrate
Nitrate führen durch Verminderung des Gefäßwiderstands zu einer Senkung der Vorlast und der Nachlast des Herzens. Dadurch sinkt der Sauerstoffverbrauch des Herzmuskels. Es gibt sowohl kurzwirksame als auch langwirksame Nitratpräparate. Kurzwirksame Nitrate werden zur symptomatischen Behandlung einer akuten Angina pectoris eingesetzt. Die Wirkung tritt bei sublingualer oder kutaner Applikation innerhalb weniger Minuten ein, so dass sie sich zur Behandlung insbesondere im akuten AP-Anfall eignen. Kurz- und langwirksame Nitrate haben keinen Einfluss auf die Prognose der chronischen KHK[3]. Für eine Dauertherapie werden langwirksame Präparate eingesetzt, die allerdings aufgrund einer schnellen Toleranzentwicklung nur eingeschränkt geeignet sind. Durch spezifische Therapieschemata und mehrstündige Therapiepausen ist bei guter Compliance des Patienten eine Dauertherapie mit Nitraten möglich.[27]
Betablocker
Betablocker senken die Herzfrequenz sowohl in Ruhe als auch bei körperlicher Belastung (negative Chronotropie). Darüber hinaus wirken sie negativ inotrop durch Senkung der Kontraktilität (Kontraktionskraft) des Herzens. Beide Mechanismen führen dazu, dass der Sauerstoffbedarf der Herzmuskulatur und der arterielle Blutdruck sinkt. Betablocker können damit, wie Nitrate und Kalziumkanalblocker, gegen pektanginöse Beschwerden eingesetzt werden. Im Gegensatz zu den beiden anderen Medikamenten senken sie zusätzlich das Risiko für das Auftreten kardiovaskulärer Ereignisse. Betablocker sind das Arzneimittel der ersten Wahl bei stabiler Angina pectoris. Wie bei allen Medikamenten müssen die Kontraindikationen beachtet werden. Hier sind dies insbesondere Asthma bronchiale sowie verschiedene Herzrhythmusstörungen, wie beispielsweise AV-Blockierungen.[12]
Calciumkanalblocker
Die Calciumantagonisten blockieren den Calciumeinstrom in die Zelle und hemmen die elektromechanische Kopplung. Dies führt zur Abnahme der Kontraktilität und des Sauerstoffverbrauchs des Herzens.
Revaskularisationstherapie
Perkutane transluminale Koronarangioplastie und Stentimplantation
Als diagnostische und therapeutische Maßnahme gilt die Darstellung der Herzkranzgefäße mittels Koronarangiographie als Goldstandard in der Diagnostik. In gleicher Sitzung ist es möglich, signifikante Engstellen durch eine Ballondilatation (Perkutane transluminale coronare Angioplastie, PTCA), ggfs. kombiniert mit der Implantation eines Stents aufzudehnen.
Bypassoperation
Bei einer Bypassoperation werden mittels Gefäßtransplantation von vorher an den Extremitäten entnommenen Venen oder Arterien die Engstellen überbrückt, zusätzlich wird häufig eine innerhalb des Brustkorbs verlaufende Arterie, die linke (selten auch die rechte) A. thoracica interna (LIMA) mit einem Ast der Koronararterien jenseits der Engstelle verbunden. Im Regelfall wird die Operation im Herzstillstand mit Herz-Lungen-Maschine durchgeführt; unter bestimmten Voraussetzungen sind aber eine Operation am schlagenden Herzen (sog. off-pump-bypass) oder minimal-invasive Techniken möglich.
Indikationen
Nach den Empfehlungen der nationalen Versorgungsleitlinie besteht in folgenden Fällen die Indikation zur Durchführung einer Revaskularisationstherapie:[3]
- Bei einer KHK, deren Symptome mit alleiniger medikamentöser Therapie nicht in den Griff zu bekommen sind, kann die Revaskularisationstherapie eine deutliche Linderung der AP-Symptomatik herbeiführen. Aufgrund der geringeren Invasivität ist die perkutane transluminale Koronarangioplastie die Therapie der ersten Wahl.
- Bei mittelgradigen Stenosen (> 50 Prozent) des Hauptstamms der linken Koronararterie ist die Bypassoperation die Therapie der ersten Wahl, da sie hinsichtlich Verbesserung der Lebensqualität und der Prognose sowie des Eintretens akuter KHK-Manifestationen der perkutanen transluminalen Koronarangioplastie überlegen ist. Bei Inoperabilität oder bei Ablehnung des Patienten wird dagegen die Durchführung einer perkutanen transluminalen Koronarangioplastie empfohlen. Inoperabilität kann aufgrund schwerer Begleiterkrankungen oder einer diffusen Arteriosklerose bestehen.
- Hochgradige proximale Stenosen (> 70 Prozent) des Ramus interventricularis anterior (RIVA-Stenose) sollten unabhängig von der Symptomatik einer Resvakularisationstherpie zugeführt werden, wobei die perkutane transluminale Koronarangioplastie und die Bypassoperation hinsichtlich Verbesserung der Prognose als gleichwertig angesehen werden. Besteht darüber hinaus eine deutliche Reduzierung der Auswurfleistung des linken Herzens bestehen nach gegenwärtiger Studienlage Vorteile für die Bypasschirurgie.
- Bei einer Mehrgefäßerkrankung kann die AP-Symptomatik durch Revaskularisationstherapie unabhängig von der Methode deutlich reduziert werden. Eine Prognoseverbesserung im Vergleich zur alleinigen medikamentösen Therapie ist nicht belegt.
- Bei Dreigefäßerkrankung mit hochgradigen proximalen Stenosen wird die Bypasschirurgie als Therapie der ersten Wahl empfohlen. Beide Revaskularisationsmethoden verbessern die Lebensqualität (Reduktion der Symptome) und führen wahrscheinlich auch zu einer Verbesserung der Prognose.
Geschichte
An Arteriosklerose beziehungsweise der koronaren Herzkrankheit litten bereits die Menschen im alten Ägypten, wie man durch Untersuchungen an Mumien im 20. und 21. Jahrhundert feststellen konnte. 1749 wurde erstmalig die Arterienverkalkung von Jean-Baptiste Sénac beschrieben. [28] Die erste und sehr genaue Beschreibung der AP-Symptomatik geht auf den englischen Mediziner William Heberden im Jahre 1768 zurück. Dass ein Zusammenhang zwischen der Angina pectoris und der Arteriosklerose von Koronararterien besteht, erkannte Heberden nicht. Dieser Zusammenhang wurde ebenfalls im Jahr 1768 von Edward Jenner und 1799 von Caleb Hillier Parry beschrieben. Zu den heutigen Kenntnissen makroskopischer und mikroskopischer Gefäßveränderungen durch Arteriosklerose haben Antonio Scarpa (1804) und Jean-Frédéric Lobstein (1833) mit ihren Arbeiten einen großen Beitrag geleistet. Welche EKG-Veränderungen im Rahmen einer chronischen KHK entstehen können, wurde 1923 von Wean sowie 1957 von Himbert und Jean Lenègre erkannt.[29]
KHK bei Tieren
Bei Tieren haben arteriosklerotische Veränderungen der Koronargefäße beziehungsweise eine chronische KHK nur eine sehr geringe klinische Bedeutung; insbesondere für Großtiere fehlen außerdem entsprechende Dokumentationen. Bei Kleintieren gibt es einige Studien zur Arteriosklerose und deren Manifestation Myokardinfarkt. Im Zeitraum von 1970 bis 1983 wurde bei 21 Hunden im Rahmen einer Autopsie eine systemische Arteriosklerose diagnostiziert. Darüber hinaus konnten bei histologischen Untersuchungen Infarktareale in der Herzmuskulatur festgestellt werden.[30] Bei anderen Studien mit Hunden konnten ähnliche Veränderungen festgestellt werden, die unter anderem auch an den Koronararterien zu finden waren.[31][32] Darüber hinaus kommen systemische Veränderungen der Gefäße bei Katzen vor, deren Bedeutung für die Koronargefäße derzeit aber noch unklar ist.[33]
Das Herz des Hausschweins ähnelt in seinem anatomischen Aufbau und seiner Physiologie dem des Menschen. Komplexe Krankheitsbilder einer Arteriosklerose treten hier schon im Alter von etwa vier bis acht Jahren auf, was infolge der Haltung als Nutztier allerdings meist weit über der normalen Lebensspanne der Tiere liegt. Im Erkrankungsfall kommt es zu mit dem Menschen vergleichbaren ischämischen Veränderungen und Schäden bereits in relativ kurzen Zeiträumen. Die Herzkranzgefäße neigen außerdem in noch geringerem Umfang als die des Menschen zur Ausbildung von Kollateralgefäßen, was eine klinische Lokalisation von Infarktgebieten erleichtert. Durch diese Eigenschaften werden Schweineherzen als Modelle zur Untersuchung der menschlichen chronischen myokardialen Ischämie verwendet. Ferner kommen hierfür Ratten-, Kaninchen-, Hunde- und Primatenherzen zum Einsatz.[34]
Literatur und Quellen
- Hauptquellen
- Nationale Versorgungsleitlinie der Bundesärztekammer, Chronische KHK, Version 1.4, November 2006. Online als PDF
- Einzelnachweise
- ↑ a b c d e f Classen, Diehl, Kochsiek: Innere Medizin. 5. Auflage. Urban & Fischer-Verlag München 2006. ISBN 3-437-44405-0
- ↑ a b c d e f g h H. Renz-Polster u.a.: Basislehrbuch Innere Medizin. 3. Auflage. Urban und Fischer-Verlag München 2004, ISBN 3-437-41052-0
- ↑ a b c d e f g h i Nationale Versorgungsleitlinie der Bundesärztekammer, Chronische KHK, Version 1.4, November 2006. Online als PDF
- ↑ a b Manfred Dietel et al. (Hrsg.): Harrisons Innere Medizin. Dt. Ausgabe der 15. Auflage. ABW Wissenschaftsverlag Berlin 2003, ISBN 3-936072-10-8
- ↑ Bethesda: NHLBI morbidity and mortality chartbook. National Heart, Lung, and Blood Institute, May 2002. Online-Version
- ↑ Europa in Zahlen — Eurostat-Jahrbuch 2006-07. Online als PDF-Version, S102; 12,1 MB
- ↑ Statistisches Bundesamt - Todesursachen in Deutschland. Online abrufbar
- ↑ Ross R (1999) Atherosclerosis – an inflammatory disease. N Engl J Med. 340:115-126
- ↑ J. Stamler et al. (1986): Is relationship between serum cholesterol and risk of premature death from coronary heart disease continuous and graded? Findings in 356,222 primary screenees of the multiple risk factor intervention trial. (MRFIT). JAMA 256:2823–2828
- ↑ W. Verschuren et al. (1995): Serum total cholesterol and long-term coronary heart disease mortality in different cultures. Twenty-five-year follow-up of the seven countries study. JAMA 274:131–136.
- ↑ A. Rieder: Epidemiologie der Herz-Kreislauf-Erkrankungen, Journal für Kardiologie 2004; 11 (Supplementum D), 3-4 Online als PDF-Datei
- ↑ a b c d R. Dietz et al.: Leitlinie zur Diagnose und Behandlung der chronischen koronaren Herzerkrankung der deutschen Gesellschaft für Kardiologie (DGK). Zeitschrift für Kardiologie 92:501-521 (2003) Online als PDF-Datei
- ↑ a b c Daly CA et al.: Predicting prognosis in stable angina-results from the Euro heart survey of stable angina: prospective observational study. BMJ 2006;332(7536):262-7. Online-Version
- ↑ Eur J Echocardiogr. 2008 Jul;9(4):415-37
- ↑ Büll, Schicha, Biersack, Knapp, Reiners, Schober: Nuklearmedizin, Stuttgart 2001 ISBN 3-13-128123-5, S. 213f
- ↑ Kauffmannet al.: Radiologie, 3. Aufl. Urban & Fischer München/Jena 2006. ISBN 3-437-44415-8
- ↑ B. Hermanson et al. (1988): Beneficial six-year outcome of smoking cessation in older men and women with coronary artery disease. Results from the CASS registry. N Engl J Med 319:1365–1369
- ↑ Kolenda KD: Sekundärprävention der koronaren Herzkrankheit: Effizienz nachweisbar. Deutsches Ärzteblatt 102/2005, A1889)
- ↑ Wilson K, Gibson N, Willan N, Cook D: Effect of smoking cessation on mortality after myocardial infarction. Arch Int Med 2000; 160: 939–944.
- ↑ a b Morrison LM: Diet in coronary atherosclerosis. JAMA 1960; 173: 884–888.
- ↑ De Longeril M, Salen P, Martin JL, Monjaud J, Delaye J, Mamelle N: Mediterranean diet, traditional risk factors, and the rate of cardiovascular complications after myocardial infarction. Final report of the Lyon Diet Heart Study. Circulation 1999; 99: 779–785. PMID 9989963
- ↑ O'Connor GT, Buring I, Yusuf S et al.: An overview of randomised trials of rehabilitation with exercise after myocardial infarction. Circulation 1989; 80: 234–244.
- ↑ Blumenthal JA, Jiang W, Babyatz MA et al.: Stress management and exercise training in cardiac patients with myocardial ischemia. Arch Intern Med 1997; 157: 2213–2223.
- ↑ Arch Intern Med 168, 2008, 1174)
- ↑ Arch Inter Med 168, 2008, 1340
- ↑ Zitiert nach Ärzte-Zeitung, 9. Juli 2008, S. 1
- ↑ Wolff, Weihrauch. Internistische Therapie 2004-2005. 15. Auflage. Urban und Fischer-Verlag München 2004. ISBN 3-437-21802-6
- ↑ J. Schmitt und M. Beeres: Geschichte der Medizintechnologie, Teil 3, MTDialog Dez. 2004 Online als PDF-Datei
- ↑ Rullière, R. : Geschichte der Kardiologie im 19. und 20. Jahrhundert. In: Toellner, R.: Illustrierte Geschichte der Medizin. Andreas Verlag Salzburg 1992, Band 3 ISBN 3-86070-204-1
- ↑ Liu S et al.: Clinical and pathologic findings in dogs with atherosclerosis: 21 cases (1970-1983) J Am Vet Med Assoc. 1986 Jul 15;189(2):227-32. PMID 3744984
- ↑ Kelly D: Arteriosclerosis of coronary arteries in Labradors with congestive heart failure. J Small Anim Pract 33:437, 1992
- ↑ Detweiler D: Spontaneous and induced arterial disease in the dog: pathology and pathogenesis. Toxicol Pathol. 1989;17(1 Pt 2):94-108. PMID 2665038
- ↑ Lucke V: Renal disease in the domestic cat. J Pathol Bacteriol. 1968 Jan;95(1):67-91. PMID 5689371
- ↑ Nimz C: Pathologisch-anatomische und immunhistologische Untersuchungen des ischämischen Schweinemyokards. Vet.-med. Diss., München 2004:1-10 Online-Version
Weblinks
- Kapitel „KHK und Herzinfarkt“ aus dem Buch: Herold - Innere Medizin (PDF; 190 kB)
- Broschüre „Herz in Gefahr? - Ursachen, Prävention, Therapie – Ergebnisse der Herzkreislaufforschung“ des Bundesministeriums für Bildung und Forschung, 2006 (PDF; 3.8 MB)
- Rechner für Herzinfarktrisiko der International Task Force for Prevention of Coronary Heart Disease
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.