- Leitfähigkeitstitration
-
Konduktometrie oder Leitfähigkeitstitration ist eine physikalische Analysemethode, die die elektrische Leitfähigkeit einer flüssigen Probe zur Bestimmung ihrer Inhaltsstoffe und deren Konzentration ausnutzt. Es können ähnliche Titrationen wie bei der Potentiometrie, aber auch Fällungstitrationen durchgeführt werden. Die Konduktumetrie ist bei Titrationen sehr beliebt, denn es werden keine chemischen Indikatoren benötigt. Große Vorteile der Konduktometrie sind die Einfachheit des Verfahrens sowie die Möglichkeit von exakten konduktometrischen Titrationen auch mit sehr verdünnten Lösungen (10-4 molar).
Bei der konduktometrischen Titration werden Ionen mit einem sehr hohen Leitvermögen (z. B. Protonen, Hydroxidionen – siehe Grenzleitfähigkeit) durch Zugabe von Ionen mit entgegengesetzter Ladung neutralisiert. Säureprotonen werden beispielsweise von Hydroxidionen einer Natronlauge zu Wasser und Salz umgewandelt. Wasser und Salz haben ein geringeres Leitvermögen als eine reine Säure. Dies macht sich in einer Abnahme der Leitfähigkeit bemerkbar. Sobald sich bei einer Titration alle Protonen zu Wasser umgewandelt haben, steigt bei weiter Laugezugabe die Leitfähigkeit wieder kräftig an, da nun wieder Ionen mit hoher Leitfähigkeit (Hydroxidionen) vorliegen. Wenn man die Titration mit standardisierten Normallösungen ausführt, erkennt man am Leitfähigkeitsanstieg den Titrationsendpunkt und die Ionenmenge (z. B. Säuregehalt) einer Probe.
Die Konduktometrie wurde von I. M. Kolthoff, G. Jander und O. Pfundt eingeführt.
Inhaltsverzeichnis
Prinzip
Konduktometrie oder Leitfähigkeitstitration ist eine Methode, bei der nach jedem Reagenzzusatz der Ohmsche Widerstand der Analysenlösung bzw. dessen Kehrwert, der Elektrische Leitwert (in Siemens S = Ω-1) mittels Wechselstrom gemessen wird. Dabei tauchen zwei gleichgroße inerte Elektroden in die zu messende Lösung. Die Widerstandsbestimmung erfolgt mittels einer Wheatstoneschen Brückenschaltung bzw. einer in modernen Geräten enthaltenen komplexen elektronischen Schaltung. Der Widerstand bei der Leitfähigkeitsmessung einer Lösung wird geringer, wenn die Elektrodenfläche des Messgerätes zunimmt oder der Abstand zwischen den Elektroden verringert wird. Geeichte Geräte sind bereits auf Standardflächen und Abstände eingestellt. Mit diesen Geräten kann man direkt die spezifische Leitfähigkeit (μS/cm) einer Lösung ablesen. Die spezifische Leitfähigkeit ist eine geräteunabhängige Größe und wird nur von der Lösung, d.h. von der Art und Zahl der Ionen in wässrigen Lösungen beeinflusst. Aus der Multiplikation der spezifischen Leitfähigkeit mit 1 cm erhält man den Leitwert der Lösung.
Im Handel gibt es bereits sehr preiswerte Konduktometer, deren Preis um ca. 35 € liegt. Diese Geräte zeigen die spezifische Leitfähigkeit der Lösung in μS/cm (2000 – 9999 μS/cm) an. Diese Geräte sind somit nur für einen Bereich bis maximal 0,1 mol Kochsalz geeignet. Für konzentrierte Salzlösungen eignen sich diese Messgeräte jedoch nicht. Entweder muss die wässrige Lösung mit destilliertem Wasser (1/10 oder 1/100) verdünnt werden oder es müssen Spezialgeräte (Preis ab 130 €, bis 100 mS/cm) verwendet werden. Mit der Messung der Leitfähigkeit einer bekannten Eichlösung (z. B. Kaliumchlorid Lösung) bei genau eingestellter Temperatur kann die Genauigkeit des Gerätes überprüft und - bei leichten Abweichungen - manchmal auch kalibriert werden.
Während der Messung darf die Temperatur der Elektrolytlösung nicht schwanken. Eine Temperaturänderung von 1°C bedeutet eine Leitfähigkeitsänderung von ca. 2%.
Weil Protonen und Hydroxidionen eine sehr hohe Leitfähigkeit (genauer Grenzleitfähigkeit) besitzen, sind Säure-, Basetitrationen bei konduktometrischen Titrationen besonders beliebt. Titrationen können auch in nichtwässrigen Lösungen vorgenommen werden (z. B. Amine, Amide, Anilinderivate in wasserfreier Essigsäure mit eingestellter Perchlorsäure). Auch bei Ausfällungs- (z. B. Halogenide mittels einer Silbernitratlösung oder Sulfate mittels einer Bariumchlorid- oder Bariumacetatlösung oder Mercaptide oder Thiole mittels einer HgCl2-Lösung) und Komplexbildungstitrationen kann die konduktometrische Titration angewendet werden.
Die Messwerte werden grafisch aufgetragen (Leitfähigkeit: Ordinate gegen Reagenszusatz in ml.) Die Messpunkte in unmittelbarer Nähe des Äquivalenzpunktes liegen oft nicht auf der Geraden, der Titrationspunkt wird daher durch Extrapolation ermittelt. Es ist sogar möglich, eine schwächere und eine stärkere Säure gemeinsam zu titrieren, da sich die jeweilige Stoffmenge aus den Knickpunkten der zwei unterschiedlichen Geradensteigungen ergibt.
Die Leitfähigkeit einer Elektrolytlösung ist abhängig von der- Konzentration (linear)
- Ionenladung
- Grenzleitfähigkeit der Ionen
Hilfreich für die konduktometrische Konzentrationsbestimmung von ionisch einheitlichen Substanzen (z. B. die Essigsäurekonzentration von Haushaltsessig) durch konduktometrische Messung sind das Kohlrausche Quadratwurzelgesetz, das Ostwaldsche Verdünnungsgesetz, die Debye-Hückel-Theorie, die molare Leitfähigkeit.
Verfahren
Im Wesentlichen wird zwischen zwei verschiedenen Verfahren unterschieden.
- Beim Bestimmungsverfahren wird die Leitfähigkeit gemessen und die Konzentration anhand von Kalibrationskurven bestimmt.
- Beim Indikationsverfahren wird die Leitfähigkeitsänderung während einer Titration gemessen
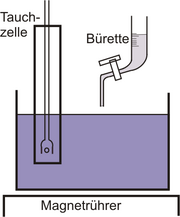
Versuchsaufbau
Meist werden zur Messung spezielle Messgeräte verwendet. Typischerweise sind diese mit einem Thermometer versehen und die Messfrequenz ist einstellbar oder zumindest umschaltbar. Die Messgrößen werden in S/cm (Siemens pro cm) angegeben (Beispiel: hoch reines Wasser 0,05µS/cm bis 0,1µS/cm, Leitungswasser 300µS/cm bis 1mS/cm, Meerwasser bis zu 5S/cm...). Der Innenaufbau der Messgeräte gleicht dem der wheatstonschen Messbrücke, es handelt sich also um eine sehr präzise Widerstandsmessung.
Anwendung der Konduktometrie
Typische Anwendungsbereiche sind:
- Kontrolle der Reinheit von Lösungen (Beispiel: demineralisiertes Wasser)
- Gehaltsbestimmung durch konduktometrische Titration (z. B. Säure/Base, Fällung)
- Bestimmung der Konzentration ( Säurebad, Salzlösung ) mit Eichkurven, Tabellen
- Bestimmung der Gesamtheit aller Elektrolyte ( Wasseranalyse, Medizin )
- Analyse einer Substanz anhand von typischen Stoffeigenschaften ( Vergleich mit Tabellen )
Literatur
Ullmanns Encyklopädie der technischen Chemie, 3. + 4. Auflage, Stichwort: Elektrochemische Analysenverfahren
Udo R. Kunze: Grundlagen der quantitativen Analyse, Georg Thieme Verlag, Stuttgart 1980, S. 179 - 181, ISBN 3-13-585801-4
Links
Wikimedia Foundation.