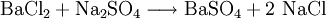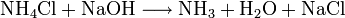- Anorganisch
-
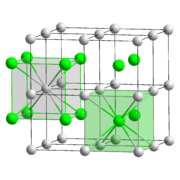 Caesiumchlorid ist Vorbild für andere Kristallstrukturen
Caesiumchlorid ist Vorbild für andere KristallstrukturenDie anorganische Chemie oder Anorganik ist die Chemie aller kohlenstofffreien Verbindungen, der Kohlensäure und der Blausäure sowie der Salze dieser. Ein Grenzgebiet zur organischen Chemie sind die Organometallverbindungen. Während die Organische Chemie diese nur als Hilfsmittel oder Reagenz benutzt, betrachtet die Anorganische Chemie die Koordinationschemie der Metalle.
Inhaltsverzeichnis
Historische Definition
Die anorganische Chemie befasst sich mit den chemischen Elementen und Reaktionen der Stoffe, die nicht von organischem Leben (mithilfe der Lebenskraft) erzeugt werden.
Seit der Harnstoffsynthese 1828 von Friedrich Wöhler, bei der die organische Substanz Harnstoff aus der anorganischen Verbindung Ammoniumcyanat hergestellt wurde, verwischen sich die Grenzen zwischen Stoffen aus der unbelebten (den „anorganischen“ Stoffen) und der belebten Natur (den „organischen“ Stoffen). So stellen Lebewesen auch eine Vielzahl anorganischer Stoffe her, während im Labor inzwischen fast alle organischen Stoffe hergestellt werden können. Gleichwohl ist die moderne Unterscheidung nach wie vor sinnvoll, da sich die Reaktionsmechanismen und Stoffstrukturen in der Anorganik und Organik vielfach unterscheiden.
Anorganische Stoffe
Zu den anorganischen Stoffen werden traditionell die Elemente und alle Verbindungen gezählt, die keinen Kohlenstoff enthalten. Dazu kommen aber einige Kohlenstoffverbindungen, die genau wie typische anorganische Stoffe aufgebaut sind (z. B. Carbonate).
Die anorganischen Stoffe kann man in mehrere große Stoffgruppen aufteilen. Dies sind:
Metalle und Halbmetalle: Zu den Metallen zählt ein Großteil der Elemente des Periodensystems (ca. 80 %). Gemeinsame Metalleigenschaften sind die Leitfähigkeit für Wärme und Strom. Beispiele für Metalle sind Eisen und Natrium. Halbmetalle haben sowohl metallische als auch nichtmetallische Eigenschaften. Sie stehen im Periodensystem zwischen Metallen und Nichtmetallen. Beispiele sind Silicium und Germanium.
Intermetallische Verbindungen, die so genannten Legierungen sind Verbindungen der Metalle untereinander. Sie werden wegen spezieller Eigenschaften (beispielsweise besondere Härte oder Zähigkeit) hergestellt. Bekannte Legierungen sind Bronze (aus Kupfer und Zinn), Messing (aus Kupfer und Zink) und Stahl (Eisenlegierungen mit unterschiedlichen Beimischungen).
Salze: Salze sind ionisch aufgebaut und bestehen aus positiv geladenen Kationen und negativ geladenen Anionen. Kationen sind meist Metallionen, Anionen meist Nichtmetallionen. Bekannte Salze sind Natriumchlorid Na+Cl− und die Oxide, bei denen Sauerstoff (O2−) das Anion ist.
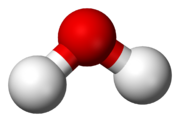
Nichtmetallverbindungen, die keinen Kohlenstoff enthalten: Dies sind kovalent aufgebaute Verbindungen, die von Nichtmetallen (z. B. Sauerstoff oder Stickstoff) untereinander gebildet werden. Die bekannteste dieser Verbindungen ist Wasser (H2O). Von den kovalenten Kohlenstoffverbindungen zählen nur sehr wenige, die keinen Wasserstoff enthalten zur anorganischen Chemie (wie Kohlenstoffmonoxid und Kohlendioxid), alle anderen zur organischen Chemie.
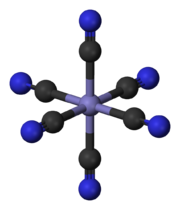 komplexes Hexacyanidoanion in Blutlaugensalzen
komplexes Hexacyanidoanion in BlutlaugensalzenKomplexe: Komplexe sind Verbindungen, die aus einem Metallzentrum und mehreren es umgebende Liganden besteht, die über Koordinative Bindungen miteinander verknüpft sind. Komplexe werden häufig von Übergangsmetallen, wie Nickel oder Cobalt gebildet und sind häufig farbig.
Cluster: Verbindungen von Metallen oder auch Nichtmetallen, die in ihrer Größe zwischen den kleinen Nichtmetallverbindungen oder Komplexen und den großen metallischen Festkörpern liegen.
Anorganische Verbindungen sind meist periodisch oder aus einer geringen Anzahl Atomen aufgebaut. Metalle, Legierungen und Salze sind periodisch aufgebaut und bilden Kristalle; statt einer Summenformel kann man nur eine Verhältnisformel angeben. Anorganische kovalente Verbindungen sind – im Gegensatz zu den meisten organischen Verbindungen – meist klein und nur aus wenigen Atomen aufgebaut. Höhermolekulare Verbindungen gibt es selten, beispielsweise in der Silicium-Chemie (Silane).
Anorganische Reaktionen
In der anorganischen Chemie spielt eine Vielzahl von Reaktionen eine Rolle. Die wichtigsten darunter sind die Redox-Reaktionen und die Säure-Base-Reaktionen. Diese Reaktionen sind immer Gleichgewichtsreaktionen, allerdings liegt das Gleichgewicht bei diesen Reaktionen häufig sehr stark auf einer Seite und es gibt eine hohe Reaktionsenthalpie. Dadurch sind viele Reaktionen in der Anorganik schnell und erreichen eine hohe Ausbeute. Im Gegensatz dazu sind in der organischen Chemie viele Reaktionen langsame Gleichgewichtsreaktionen, die nicht immer hohe Ausbeuten erreichen.
Bei Redox-Reaktionen werden Elektronen von einem Reaktionspartner auf den anderen übertragen. Typische Redoxreaktionen sind Reaktionen von Elementen zu Verbindungen. Die bekanntesten Redoxreaktionen sind die Knallgasreaktion von Wasserstoff und Sauerstoff zu Wasser und die Korrosion, bei der unedle Metalle (beispielsweise Eisen) mit Sauerstoff zu Oxiden reagiert.
Säure-Base-Reaktionen sind Reaktionen, bei denen Protonen übertragen werden. Die Säure gibt dabei an die Base (auch: Lauge) ein Proton ab. Bei Säure-Base-Reaktionen bildet sich meist Wasser und ein Salz (das bekannteste Beispiel ist die Reaktion von Salzsäure mit Natronlauge zu Natriumchlorid und Wasser). Da diese Reaktionen sehr schnell ablaufen und mit Indikatoren genau überprüft werden können, spielen sie eine große Rolle in der Analytischen Chemie.
In der anorganischen Chemie ist die Bildung unlöslicher Salze oder gasförmiger Verbindungen eine wichtige Triebkraft für Reaktionen, weil dabei Reaktionsprodukte das Gleichgewicht verlassen und somit die Reaktion vollständig in nur eine Richtung geht. So wird beim Zusammengießen einer Bariumchloridlösung und reichlich Natriumsulfatlösung in einer Fällungsreaktion sehr schwerlösliches Bariumsulfat ausgefällt, und zwar so vollständig, dass nach Abfiltrieren des Bariumsulfates keine Bariumionen mehr in der verbleibenden Natriumchloridlösung nachgewiesen werden können:
Als Beispiel für eine gerichtete Gleichgewichtsreaktion aufgrund entweichender Gase ist die Umsetzung von Ammoniumchlorid mit Natronlauge zu flüchtigem Ammoniak:
Solche Reaktionen spielen in der analytischen Chemie ebenfalls eine wichtige Rolle.
Verschiedene anorganische Verbindungen können bei höheren Temperaturen zerfallen, indem Gase entweichen. Ein Beispiel ist das Kalkbrennen, bei dem aus Calciumcarbonat Kohlendioxid entweicht und Calciumoxid zurückbleibt.
Teilgebiete der Anorganischen Chemie
- Chemie der Metalle
- Chemie der Nichtmetalle
- Komplexchemie, einschließlich der Bioanorganischen Chemie
- Festkörperchemie
- Kristallographie
- Strukturchemie
- Metallorganische Chemie (steht zwischen Anorganischer und Organischer Chemie)
- Kolloidchemie
- Atmosphärenchemie
- Mineralsäuren
Technische Anwendungen
Die anorganische Chemie ist Basis vielfältiger technischer Anwendungen, beispielsweise
- Halbleiterchemie
- Mineralogie
- Metallurgie
- Herstellung von Zement, Abbinden von Mörtel und Beton
- Herstellung von Keramiken
Literatur
- A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Aufl., de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1
- D. F. Shriver, P. W. Atkins, C. H. Langford: Anorganische Chemie, 2. Auflage. Wiley-VCH, Weinheim 1997, ISBN 978-3-527-29250-9
Übungsbücher
- Ehrhard Uhlemann, Gerhard Röbisch: Fragen und Aufgaben zur Chemie. VEB Deutscher Verlag der Wissenschaften, ISBN 3-326-00275-0
Weblinks
Teilbereiche der ChemieAnorganische Chemie · Biochemie · Organische Chemie · Physikalische Chemie · Technische Chemie
Agrochemie · Analytische Chemie · Bioanorganische Chemie · Bioorganische Chemie · Biophysikalische Chemie · Chemoinformatik · Chemometrik · Elektrochemie · Geochemie · Kernchemie · Klinische Chemie · Kohlechemie · Kolloidchemie · Kombinatorische Chemie · Kosmochemie · Lebensmittelchemie · Magnetochemie · Medizinische Chemie · Meereschemie · Naturstoffchemie · Oberflächenchemie · Organometallchemie · Petrochemie · Pharmazeutische Chemie · Photochemie · Physikalische Organische Chemie · Polymerchemie · Radiochemie · Supramolekulare Chemie · Stereochemie · Theoretische Chemie · Thermochemie · Umweltchemie
Wikimedia Foundation.