- Meningitis
-
Klassifikation nach ICD-10 G00 Bakterielle Meningitis G01 Meningitis bei anderenorts klassifizierten bakteriellen Krankheiten G02 Meningitis bei sonstigen anderenorts klassifizierten infektiösen und parasitären Krankheiten G03 Meningitis durch sonstige und nicht näher bezeichnete Ursachen ICD-10 online (WHO-Version 2011) Eine Meningitis (deutsch: Hirnhautentzündung; Plural: Meningitiden) ist eine Entzündung der Hirn- und Rückenmarkshäute, der Hüllen des zentralen Nervensystems (ZNS). Sie kann durch Viren, Bakterien oder andere Mikroorganismen verursacht sein, aber auch aufgrund nichtinfektiöser Reize auftreten.[1] Da eine bakterielle Meningitis aufgrund der unmittelbaren Nähe der Entzündung zu Gehirn und Rückenmark grundsätzlich lebensbedrohlich ist, stellt eine Meningitis bis zum sicheren Ausschluss einer bakteriellen Ursache immer einen medizinischen Notfall dar.[2][3]
Die häufigsten Symptome einer Meningitis sind Kopfschmerzen und Nackensteifigkeit, verbunden mit Fieber, Verwirrtheit oder Bewusstseinsminderung, Übelkeit und einer Überempfindlichkeit gegen Licht und laute Geräusche. Vor allem Kinder können, insbesondere in der Anfangsphase, auch unspezifische Symptome wie Reizbarkeit und Benommenheit zeigen. Ein charakteristischer Hautausschlag gilt als Hinweis auf das Vorliegen einer durch Meningokokken hervorgerufenen Meningitis.[2][4]
Üblicherweise wird das Vorliegen der Krankheit durch die Analyse von Hirn-Rückenmarksflüssigkeit, welche durch eine Lumbalpunktion entnommen wird, bestätigt oder ausgeschlossen. Eine Meningitis wird durch die rechtzeitige Gabe von Antibiotika und falls nötig mit antiviralen Substanzen behandelt. Corticosteroide können zur Verhütung von Komplikationen hilfreich sein. Eine Meningitis kann, vor allem wenn sie nicht rechtzeitig erkannt und behandelt wird, tödlich enden oder zu schwerwiegenden Folgeschäden wie Taubheit, Epilepsie, einem Hydrozephalus oder kognitiven Beeinträchtigungen führen. Zum Schutz vor bestimmten Erregern der Meningitis existieren Impfungen.[2][3][4] Meningitiden mit bestimmten Erregern wie Haemophilus influenzae Typ B oder die Meningokokkenmeningitis sind meldepflichtige Erkrankungen.[5]
Inhaltsverzeichnis
Ursachen
Eine Meningitis ist gewöhnlich erregerbedingt, also eine Infektionskrankheit. In den meisten Fällen können Infektionen mit Viren,[6] Bakterien, Pilzen oder Parasiten festgestellt werden.[1] Eine Meningitis kann auch durch verschiedene nicht-infektiöse Mechanismen verursacht werden.[1] Alle Formen, bei denen kein bakterieller Erreger nachgewiesen werden kann, werden allgemein als aseptische Meningitis bezeichnet. Das ist der Fall bei nicht-infektiöser oder viraler Ursache, aber auch bei anbehandelten bakteriellen Meningitiden, bei denen sich keine Bakterien mehr in der Hirnhaut finden, oder aber auch bei hirnhautnahen Infektionen (beispielsweise einer Sinusitis). Eine Endokarditis (Infektion der Herzklappe mit Aussaat von Bakterien in den Blutstrom) kann ebenfalls die Ursache einer aseptischen Meningitis sein. Die aseptische Meningitis wird zudem von Erregern aus der Familie der Spirochäten, zu denen auch die von Syphilis (Treponema pallidum) und Morbus Lyme (Borrelia burgdorferi) gehören, ausgelöst. Auch Malariaerreger, Pilze (beispielsweise Cryptococcus neoformans bei Immundefizitsyndromen wie AIDS) und Amoeben (beispielsweise Naegleria fowleri aus damit verseuchtem Trinkwasser) sind als Auslöser bekannt.[1]
Bakterien
Generell gilt, dass es vom Alter der Patienten abhängt, welche bakteriellen Erreger bevorzugt eine Meningitis verursachen. Bei Frühgeborenen und Säuglingen bis zu einem Alter von 3 Monaten werden häufig Streptokokken gefunden. Vor allem der Subtyp III der Serogruppe B (Gruppe-B-Streptokokken, GBS) ist es, der besonders innerhalb der ersten Lebenswochen als Meningitisverursacher im Rahmen einer Neugeborenensepsis in Frage kommt. Diese Erreger haben ihr natürliches Reservoir im Magen-Darm-Trakt. Allerdings kann auch die Scheide (der Mutter) intermittierend, chronisch oder vorübergehend mit GBS besiedelt sein.[7] Außerdem findet man in dieser Altersgruppe Kolibakterien, die ebenfalls den Magen-Darm-Trakt besiedeln. Neugeborene können auch durch Listeria monocytogenes (vor allem Serotyp IVb), einen Erreger, der auch epidemisch auftritt, erkranken. Ältere Kinder erkranken eher an Neisseria meningitidis (Meningokokken), Pneumokokken (Serotypen 6, 9, 14, 18 und 23) und Kinder unter fünf Jahren an Haemophilus influenzae Typ B.[2][3] Bei Erwachsenen verursachen N. meningitidis und S. pneumoniae zusammen etwa 80 % aller Fälle einer Meningitis. Mit steigendem Alter (nach dem 50. Lebensjahr) finden sich vermehrt L. monocytogenes.[3][4]
Nach kürzlich erlittenem Schädel-Hirn-Trauma können Bakterien aus der Nasenhöhle in den meningealen Raum übertreten. Ein ähnlich erhöhtes Infektionsrisiko haben Patienten mit einem Cerebralshunt. In diesen Fällen finden sich gehäuft Infektionen mit Staphylokokken, Pseudomonaden und gram-negativen Erregern.[3] Diese Keime findet man auch bei Patienten mit einem Immundefekt.[2] Manchmal können das Einsetzen eines Cochleaimplantats oder Infektionen im Bereich von Kopf und Hals wie eine akute Mittelohrentzündung oder Mastoiditis zu einer Meningitis führen.[3] Bei Cochleaimplantat ist das Risiko für eine Pneumokokken-Meningitis deutlich erhöht.[8]
Eine rezidivierende bakterielle Meningitis kann auch durch anatomischen Defekte (kongenital oder erworben) oder auch durch Störungen des Immunsystems verursacht werden. Anatomische Defekte können eine Verbindung zwischen der äußeren Umgebung und dem Nervensystem herstellen. Daher ist die häufigste Ursache einer rezidivierenden Meningitis eine Schädelfraktur, insbesondere Frakturen der Schädelbasis und solche, die die Nasennebenhöhlen oder das Felsenbein mit einbeziehen. Eine Literaturübersicht von 363 Fällen von rezidivierenden Meningitiden ergab, dass 59 % der Fälle durch anatomische Anomalien verursacht sind, 36 % im Rahmen einer Immunschwäche auftreten (z. B. Gerinnungsstörungen, die vor allem zu rezidivierenden Meningokokken-Meningitiden führen) und 5 % auf das Konto persistierender Infekte in den den Hirnhäuten benachbarter Gebiete gehen.[9]
Die sogenannte tuberkulöse Meningitis, also eine Meningitis aufgrund einer Infektion mit dem Erreger Mycobacterium tuberculosis, tritt gehäuft in Ländern auf, in denen die Tuberkulose verbreitet ist, wird aber auch bei Menschen mit einer Immunschwächekrankheit, zum Beispiel AIDS beobachtet.[10]
Bakterien wie beispielsweise Meningokokken oder Haemophilus influenzae führen bevorzugt zu einer eitrigen Meningitis. Abhängig von der Hauptlokalisation der Ausbreitung unterscheidet man dabei die Hauben- oder Konvexitätsmeningitis von der basalen Meningitis. Bei Ersterer findet sich das eitrige Infiltrat über den Großhirnhemisphären (insbesondere frontoparietal), bei Letzterer bevorzugt im Bereich der Hirnbasis.[11]
Viren
Obwohl neurotrope Viren überwiegend eine Enzephalitis hervorrufen, können manche Virusspezies auch Ursache einer Meningoenzephalitis, Enzephalomyelitis und Meningitis sein. Als Abgrenzung zur klassischen bakteriellen Meningitis werden die viralen Meningitiden auch als lymphozytäre Meningitis bezeichnet. Nur wenige Viren verursachen ausschließlich eine Meningitis wie das durch Nagetiere übertragene Virus der Lymphozytären Choriomeningitis (LCMV). Eine Meningitis als Mischform oder als fortgeschrittener Infektionsverlauf wird bei immunkompetenten Erwachsenen am häufigsten durch Enteroviren wie dem Coxsackie-Virus und den ECHO-Viren verursacht. Als Meningitis können sich auch Infektionen oder Reaktivierungen verschiedener Herpesviren manifestieren, so das Herpes-simplex-Virus 1, seltener das Herpes-simplex-Virus 2, Humane Herpesvirus 6 und Humane Herpesvirus 7. Die Herpes-simplex-Viren vermögen als einzige virale Erreger auch eine chronisch verlaufende Meningitis hervorzurufen. Bei schwerer zellulärer Immundefizienz (beispielsweise nach Knochenmarktransplantation oder bei AIDS im Stadium C3) vermögen auch das Cytomegalievirus und das Epstein-Barr-Virus eine Meningoenzephalitis oder Meningitis auszulösen. Als typische Komplikationen treten diese auch bei Infektionen mit dem Masernvirus, dem Mumpsvirus und dem Rötelnvirus auf. Bei Hantaviren und dem Parvovirus B19[12] ist eine meningitische Mitbeteiligung beschrieben. Im Rahmen einer frischen Infektion kann das Humane Immundefizienz-Virus neben einer Enzephalitis auch eine Meningitis hervorrufen (Akutes retrovirales Syndrom). Verschiedene durch Gliederfüßer, Stechmücken und Zecken übertragene Viren (Arboviren) können neben einer Enzephalitis auch eine Meningitis verursachen. Zu ihnen gehören das FSME-Virus, Japanische-Enzephalitis-Virus (→ Japanische Enzephalitis), West-Nil-Virus, Rifttal-Fieber-Virus (→ Rifttalfieber), Dengue-Virus und verschiedene Subtypen des Sandmückenfiebervirus (→ Phlebotomusfieber) wie das Toskana-Virus.[13]
Parasitäre Ursachen
Eine parasitäre Ursache wird oft angenommen, wenn sich eine Eosinophilie im Liquor cerebrospinalis findet. Am häufigsten finden sich dabei der Ratten-Lungenwurm (Angiostrongylus cantonensis) und andere Fadenwürmer wie Gnathostoma spinigerum; eine dabei durchgeführte Behandlung mit Albendazol ist von fraglicher Wirksamkeit.[14] Als seltene Ausschlussdiagnosen gelten Tuberkulose, Syphilis, Kryptokokkose und die Kokzidioidomykose.[15][16][17]
Nichtinfektiöse Formen der Meningitis
Eine nichtinfektiöse Meningitis kann als das Ergebnis von verschiedenen Prozessen auftreten: durch die Ausbreitung von Krebszellen auf die Hirnhäute im Sinne einer „Meningeosis neoplastica“[18] und als Nebenwirkung bestimmter Medikamente, vor allem durch nicht-steroidale Antirheumatika, Antibiotika und intravenös gegebene Immunglobuline.[19] Eine nichtinfektiöse Meningitis kann auch durch entzündliche Erkrankungen wie die Sarkoidose (Neurosarkoidose) verursacht werden, oder durch Bindegewebserkrankungen wie den systemischem Lupus erythematodes oder infolge bestimmter Formen von entzündlichen Erkrankungen der Gefäßwand wie dem Morbus Behçet auftreten.[1] Eine Epidermoidzyste oder eine Dermoidzyste kann eine Meningitis dadurch verursachen, dass sie entzündungsfördernde Stoffe in den Subarachnoidalraum entlässt.[1][9] Eine Mollaret-Meningitis ist ein Syndrom von wiederkehrenden Episoden aseptischer Meningitiden. Es wird möglicherweise durch Herpes-simplex-Viren vom Typ 2 verursacht. In seltenen Fällen kann eine Migräne eine Meningitis verursachen, diese Diagnose ist allerdings nur zulässig, wenn alle anderen möglichen Ursachen im Vorfeld ausgeschlossen wurden.[1]
Krankheitsentstehung
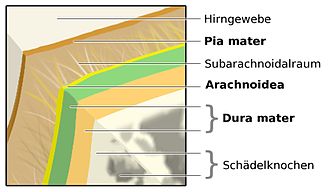
Die Meningitis betrifft alle drei Schichten der Hirnhaut, die zusammen mit Gehirn- und Rückenmarksflüssigkeit (Liquor cerebrospinalis) Gehirn und Rückenmark umschließen und schützen. Die innerste Schicht der Hirnhaut, die Pia mater, ist eine zarte, undurchlässige Schicht, die fest mit der Oberfläche von Gehirn und Rückenmark verbunden ist und auch bis in alle Furchen hinein umschließt. Die mittlere Schicht, die Arachnoidea oder Spinnenwebshaut, sitzt der Pia mater locker auf und „überspringt“ dabei die Furchen des Gehirns. Der Spalt zwischen den beiden Schichten wird als Subarachnoidalraum bezeichnet. Er ist mit Liquor cerebrospinalis gefüllt und heißt, weil er außerhalb des ZNS liegt, auch äußerer Liquorraum. Die äußerste Schicht der Hirnhaut liegt sowohl der Arachnoidea, als auch dem Schädelknochen eng an. Sie wird als Dura mater bezeichnet.
Bei der bakteriellen Meningitis können die Erreger über das Blut (hämotogen) zu den Hirnhäuten gelangen oder direkt von den Schleimhäuten des Nasenraumes oder der Haut aus dorthin wandern. Meist geht dem eine virale Infektion voraus, die die normalerweise vorhandene Schutzfunktion der Schleimhäute schädigt. Sind die Bakterien einmal im Blut, können sie über Bereiche, in denen die Blut-Hirn- bzw. die Blut-Liquor-Schranke schwächer ausgeprägt ist (wie den Plexus choroideus) in den Subarachnoidalraum gelangen. Meningitiden bei Neugeborenen sind in 25 % der Fälle durch hämatogene Streuung von Streptokokken der Gruppe B bedingt. Bei Erwachsenen kommt dies seltener vor.[2] Ursache für eine unmittelbare Verschleppung von Keimen in den Liquor können eingebrachte medizinische Geräte sein, aber auch ein Schädelbruch oder eine Infektion des Nasenrachenraums (Nasopharynx) oder der Nasennebenhöhlen, die eine Fistel mit dem Subarachnoidalraum gebildet haben. Gelegentlich kann auch ein angeborener Defekt der Dura mater verantwortlich sein.[2]
Mit dem Begriff aseptische Meningitis wird ein Syndrom bezeichnet, dass durch ein akutes Auftreten meningealer Reizzustände, Fieber und eine Liquorpleozytose gekennzeichnet ist.[20] Typischerweise findet man dabei kein Wachstum eines Erregers in einer Bakterienkultur.[21] Bei den meisten aseptischen Meningitiden wird die Entzündung der Hirnhäute durch Enteroviren und Herpes Simplex Typ 2 Viren verursacht.[22] Untersucht man die viral verursachten Meningitiden, findet man in bis über 90% der Fälle Enteroviren als die Verursacher.[23] Bei Kindern machen Enteroviren etwa die Hälfte der identifizierten Erreger aus.[24] Daher wird eine virale Meningitis vielfach kurzerhand als aseptische Meningitis bezeichnet.[25], andere Autoren erklären vereinfachend, dass eine aseptische Meningitis immer dann vorliegt, wenn die Entzündung der Meningen nicht durch einen eiterverursachenden Erreger bedingt ist.[26] Üblicherweise wird der Begriff für eine Form der Meningitis verwendet, bei der man eine gutartigen Verlauf, ohne Übergreifen der Entzündung auf das Hirnparenchym beobachtet.[27] Allerdings wird unter dem Begriff auch die sog. "drug-induced aseptic Meningitis" (DIAM) subsumiert. Medikamente, die das Bild einer Meningitis erzeugen können sind vor allem nichtstereoidale Antirheumatika, Antibiotika[28] und intravenös gegebene Antikörper.[29] Kürzlich wurden im Rahmen einer Mumps-Epidemie in den USA und Canada aspetische Meningitiden als Folge der Impfung beobachtet.[30] Eine zunehmend häufiger auftretende Ursache aseptischer Meningitiden sind Tumoren. In diesem Zusammenhang spricht man im angelsächsischen Sprachraum von einer "Neoplastic Meningitis". Entscheidend für die Benennung der Erkrankung als Meningitis ist die Beobachtung, dass die in den Subarachnoidalraum einwandernden Tumorzellen zu einer Irritation der Meningen führt, die das klinische Bild einer mild verlaufenden Meningitis erzeugt.[31] In seltenen Fällen kann eine Rheumatoide Arthritis[32] oder eine Neuroborreliose mit einer aseptischen Meningitis einhergehen.[33] Gelegentlich gibt es Epidemien aseptischer Meningitiden. Kurzlich wurde in Lettland eine solche Epidemie beobachtet. Sie war verursacht durch Coxsackieviren.[34]
Die generalisierte Entzündung, die bei einer Meningitis im Subarachnoidalraum auftritt, ist keineswegs die direkte Folge der Keimvermehrung, sondern vielmehr das Resultat der komplexen Immunantwort infolge der Keimbesiedelung. Diese Immunantwort besteht vor allem in der Produktion von Cytokinen durch Astrozyten und Mikroglia. Daraus folgt eine Stimulation weiterer Komponenten des Immunsystems. In der Folge tritt eine Störung der Blut-Hirn-Schranke auf, die von einer Hirnschwellung (vasogenes Hirnödem) begleitet werden kann. Die veränderte Durchlässigkeit der Hirngefäße verursacht nicht nur einen Flüssigkeitsübertritt ins Hirngewebe, sondern auch ein Eindringen von Leukozyten in den Liquorraum. Diese tragen wesentlich zum Entzündungsgeschehen und einem interstitiellen Hirnödem bei, indem sie weitere Zytokine und Überreste abgetöteter Bakterien freisetzen. So kommt es auch zu einer Entzündung der Hirngefäßwände (zerebrale Vaskulitis) die zu einem zytotoxischen Hirnödem und einer Störung der Hirndurchblutung beiträgt. Die so bei einer Meniningitis auftretenden drei Hirnödemformen führen nun zu einem erhöhten Hirndruck und zu einer Minderdurchblutung des Gehirns mit der Folge eines programmierten Zelltodes von Nervenzellen.[2] Die Zusammenschau dieser Prozesse erklärt die Beobachtung, dass sich der klinische Zustand von Patienten mit einer Meningitis initial verschlechtern kann, wenn die Patienten mit einem Antibiotikum behandelt werden. Verantwortlich dafür ist die dann auftretende, vermehrte Freisetzung von bakteriellen Endotoxinen in den Liquorraum. Die Gabe von Corticosteroiden kann diese Vorgänge abmildern.[2][4]
Klinische Zeichen und klinische Symptome
Bei Erwachsenen ist ein intensiver Kopfschmerz das häufigste Symptom der Erkrankung und tritt in über 90 % aller Fälle einer bakteriellen Meningitis auf. Er wird meist von einer Nackensteifigkeit (Meningismus) begleitet, die sich bei 70 % der erwachsenen Patienten mit einer bakteriellen Meningitis findet. Andere klinische Zeichen, die häufig bei einer Meningitis vorkommen, sind eine Lichtscheu und eine Geräuschempfindlichkeit. Die klassische Symptom-Trias einer Meningitis besteht aus Nackensteifigkeit, hohem Fieber und Bewusstseinsminderung. Man findet diese Trias jedoch nur in ca. 45 % der Fälle einer bakteriellen Meningitis. Wenn keines der drei klinischen Zeichen vorliegt, ist eine Meningitis sehr unwahrscheinlich.[35][6]
Weitere Hinweise für einen Meningismus sind positive Kernig-, Brudzinski- und Lasègue-Zeichen: dabei findet man die Patienten häufig im Bett mit angezogenen Beinen liegend, wobei sie die Knie nicht strecken können (Kernig-Zeichen). Wenn es beim Vorbeugen des Kopfes zu einem unwillkürlichen Anziehen der Beine kommt, spricht man vom Brudzinski-Zeichen. Bei passivem Beugen des gestreckten Beines im Hüftgelenk bis zu einem Winkel von 45° kann es zu scharfen, vom Rücken in das Bein einschießenden Schmerzen kommen (Lasègue-Zeichen). Die Sensitivität dieser im klinischen Alltag häufig angewendeten Tests ist nicht sehr hoch.[36] Kernig- und Brudzinski-Zeichen haben allerdings eine hohe Spezifität, das heißt, sie kommen selten bei anderen Erkrankungen vor. Ein anderer Test, das „jolt accentuation maneuver“ kann ebenfalls hilfreich sein: wenn die Patienten den Kopf horizontal schnell hin- und herschütteln (wie beim „Neinsagen“) und dies den Kopfschmerz nicht verschlimmert, ist eine Meningitis unwahrscheinlich.[6]
Kleine Kinder zeigen häufig keine charakteristischen Symptome, sie sind manchmal nur reizbar und kränklich.[2] Kleinkinder bis zu einem Alter von sechs Monaten weisen manchmal eine Vorwölbung der Fontanelle, Schmerzen in den Beinen, kalte Extremitäten und Blässe auf.[37]
Wenn die Meningitis durch das Bakterium Neisseria meningitidis verursacht wird (Meningokokkenmeningitis), dann kann diese im Falle einer Bakterienstreuung über das Blut durch das Auftreten einer Purpura charakterisiert sein.[37] Diese Hauterscheinung besteht aus zahlreichen kleinen irregulären roten oder lilafarbenen Flecken (flächenhafte Blutungen unter die Haut) am Körperstamm, den unteren Extremitäten, Schleimhäuten, Konjunktiven und gelegentlich den Handinnenflächen oder Fußsohlen. Obwohl der Ausschlag bei einer Meningokokkenmeningitis nicht immer vorkommt, ist er doch recht spezifisch für die Erkrankung, kommt jedoch auch bei anderen Erregern vor.[2] Charakteristische Hautausschläge gibt es auch bei Meningitisformen durch die Erreger der Hand-Fuß-Mund-Krankheit und bei Herpes simplex-Meningoenzephalititden.[38]
Komplikationen im Frühverlauf
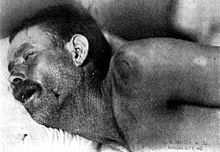
 Das Foto zeigt ein Kind mit einem sehr schweren Verlauf einer Meningokokkenmeningitis. Die Petechien entwickelten sich schnell zu Gangränen und erforderten die Amputation aller Extremitäten. Die Patientin überlebte die Erkrankung und wurde als „Baby Charlotte“ im Rahmen einer Meningitis-Impfkampagne in Neuseeland bekannt.
Das Foto zeigt ein Kind mit einem sehr schweren Verlauf einer Meningokokkenmeningitis. Die Petechien entwickelten sich schnell zu Gangränen und erforderten die Amputation aller Extremitäten. Die Patientin überlebte die Erkrankung und wurde als „Baby Charlotte“ im Rahmen einer Meningitis-Impfkampagne in Neuseeland bekannt.
Patienten mit einer Meningitis können im Frühverlauf der Erkrankung besondere Komplikationen erleiden. Diese Komplikationen erfordern eine besondere Behandlung und zeigen manchmal eine ungünstige Prognose an. Die Infektion kann eine Sepsis mit einem systemischen inflammatorischen Response-Syndrom mit Blutdruckabfall, Tachykardie, Entgleisung der Körpertemperatur und Tachypnoe auslösen. Der Blutdruckabfall kann früh im Verlauf der Erkrankung auftreten, vor allem bei einer Meningokokkenmeningitis und zu einer Durchblutungsstörung verschiedener Organe führen.[39] Eine Verbrauchsgerinnungsstörung ist das Resultat einer überschießenden Gerinnungsaktivierung und kann einerseits die Blutversorgung ganzer Organe stören und andererseits das Blutungsrisiko erheblich vergrößern. Bei einer Meningokokkenmeningitis können Gangräne der Extremitäten entstehen.[2] Infektionen mit Meningokokken und Pneumokokken können Einblutungen der Nebenniere mit der Folge eines Waterhouse-Friderichsen-Syndrom verursachen, das nicht selten tödlich verläuft.[40] Ein weiteres Problem ist die Entwicklung eines Hirnödems, mit ansteigendem Hirndruck und dem Risiko einer Einklemmung durch die Hirnschwellung. Dies kann von einer Bewusstseinsminderung mit Aufhebung der Pupillenreflexe, Atemstörung und einer abnormen Körperhaltung begleitet sein.[41] Eine Infektion des Gehirngewebes kann auch zu einer Liquorabflussbehinderung mit der Folge eines Hydrocephalus führen.[41] Epileptische Anfälle können aus unterschiedlichen Gründen auftreten; sie sind bei Kindern eine häufige Komplikation im Frühverlauf (30 % der Fälle) und geben keinen Hinweis auf die zugrundeliegend Störung.[42] Krampfanfälle nehmen manchmal ihren Ausgang von Hirnarealen, die komprimiert oder entzündet sind.[41] Partielle Anfälle (das sind Anfallsformen, die zu motorischen Entäußerungen in einer Extremität oder in Teilen des Körpers führen), ein Anfallsstatus, spät eintretende Anfälle und solche, die medikamentös nicht oder nur schwer beherrschbar sind, gelten als Hinweis für eine ungünstige Langzeitprognose.[39] Eine Meningitis kann auch zu Beeinträchtigungen der Hirnnerven und somit zu Störungen der Kontrolle der Augen-, Gesichts- und Kopfbewegungen, des Schluckens und des Gehörs führen.[39][6] Sehstörungen und Hörminderung können nach einer Meningitis anhaltend sein.[2] Problematisch ist eine im Anschluss an die Erkrankung auftretende Verkalkung der Hörschnecke (Cochlea), daher sollten während und nach einer Meningitis engmaschige Hörteste erfolgen, um in entsprechenden Fällen frühzeitig bei Ertaubung eine Cochlea-Implantation zu ermöglichen, die nach der Verknöcherung nicht immer gelingt.[43][44] Eine Entzündung des Gehirngewebes (Enzephalitis) oder der Hirngefäße (zerebrale Vaskulitis), können ebenso wie die Entstehung einer Sinus- oder Hirnvenenthrombose, zu einem fokalen neurologischen Defizit mit Lähmung, Sensibilitätsstörungen und Bewegungsstörungen in den von den betroffenen Hirnregionen versorgten Körperarealen führen.[39][41]
Diagnostik
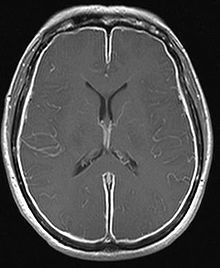
Ringsum verdickte Hirnhäute in der Kernspintomographie
Liquor- Befunde bei unterschiedlichen Formen von Meningitis[45] Unterformen Glucose Proteingehalt Zellzahl Akut bakteriell erniedrigt erhöht granulozytär,
häufig > 300/mm³Akut viral normal normal oder erhöht lymphozytär,
< 300/mm³Tuberkulös erniedrigt erhöht mononukleär und
PMNs, < 300/mm³Pilz erniedrigt erhöht < 300/mm³ Malignom erniedrigt erhöht typischerweise
mononukleärBlutuntersuchungen und bildgebende Verfahren
Bei Verdacht auf Meningitis wird das Blut auf entzündungstypische Veränderungen (beispielsweise C-reaktives Protein, Blutbild und Blutkultur) hin untersucht.[3][46] Die wichtigste Untersuchung, um einen Verdacht auf Meningitis zu bestätigen oder zu verwerfen, ist die Untersuchung des mittels Lumbalpunktion gewonnenen Liquors.[47] Die Lumbalpunktion ist kontraindiziert bei Raumforderungen im Gehirn (beispielsweise Tumoren oder Abszesse), oder aber auch bei einer Erhöhung des intrakraniellen Druckes, weil es dabei zu Einklemmungen des Gehirns kommen kann. Um dieses Risiko vermeiden zu können, sind daher im Vorfeld bei entsprechender Anamnese ein Computertomographie oder eine Kernspintomographie des Schädels angezeigt, was in bis zu 45 % der Fälle notwendig ist.[3][46][48] Bei Säuglingen und Kleinkindern kann auch eine Ultraschalluntersuchung des Kopfes zur Diagnosestellung beitragen.[49] Falls vor einer Lumbalpunktion eine bildgebende Untersuchung notwendig ist, wird eine vorbeugende antibiotische Behandlung empfohlen, um eine Verzögerung des Behandlungsbeginns zu vermeiden.[3][46][48] Häufig werden bildgebende Verfahren eingesetzt, um während der Behandlung die Entwicklung von Komplikationen besser einschätzen zu können.[2] Bei schweren Verläufen sollte stets ein Monitoring der Blutelektrolyte erfolgen, da in diesen Fällen eine Hyponatriämie unter anderem als Folge eines Schwartz-Bartter-Syndrom oder als Nebenwirkung einer Infusionstherapie auftreten kann.[4][50]
Lumbalpunktion
Mittels Lumbalpunktion wird Hirn-Rückenmarksflüssigkeit (Liquor cerebrospinalis) gewonnen. Anschließend kann der Druck im Subarachnoidalraum gemessen werden, der normalerweise zwischen 6 und 18 cm Wassersäule (cm H2O) liegt.[47] Bei einer bakteriellen Meningitis ist der Liquordruck zumeist erhöht.[3][46] Das makroskopische Erscheinungsbild der Hirn-Rückenmarksflüssigkeit erlaubt bereits Rückschlüsse auf die Ursache. Normalerweise ist Liquor klar, eine trübe bis wolkige Hirn-Rückenmarksflüssigkeit weist auf erhöhte Proteinanteile, weiße und rote Blutkörperchen und/oder Bakterien und damit auf eine bakterielle Meningitis hin. Bei einer sehr hohen Leukozytenzahl (Pleozytose) kann der Liquor eitrig aussehen.[3]
 Gram-Färbung von Meningokokken aus einer Kultur mit Gram-negativen (pink), häufig paarweise gruppierten Bakterien
Gram-Färbung von Meningokokken aus einer Kultur mit Gram-negativen (pink), häufig paarweise gruppierten Bakterien
Die Hirn-Rückenmarksflüssigkeit wird mikroskopisch auf rote und weiße Blutkörperchen sowie chemisch auf Protein-, Laktat- und Glukosegehalt untersucht.[3] Eine Gram-Färbung kann zum Nachweis von Bakterien dienen. Allerdings schließt ihr Fehlen eine bakterielle Meningitis nicht aus. Bei einer Meningitis sind nur in 60 % der Fälle, bei vorheriger Antibiotika-Gabe sogar nur bei 40 %, Bakterien mikroskopisch nachweisbar. Die Gram-Färbung zum Nachweis spezifischer Infektionen wie der Listeriose ist zudem unzuverlässig. Eine Bakterienkultur der Probe ist sensitiver, mit ihr können in 70–85 % der Fälle Mikroorganismen nachgewiesen werden, aber es dauert bis zu 48 Stunden, ehe die Ergebnisse vorliegen.[3] Die Unterscheidung der weißen Blutkörperchen gibt bereits Hinweise darauf, ob eine bakterielle (neutrophile Granulozyten überwiegen) oder virale (Lymphozyten überwiegen) Meningitis vorliegt[3] Allerdings ist dieser Befund im Anfangsstadium der Erkrankung wenig zuverlässig. Deutlich seltener überwiegen eosinophile Granulozyten, was auf eine parasitäre oder Pilzinfektion hinweist.[51]
Als „aseptische Meningitis“ bezeichnet man Meningitiden unabhängig von der Ursache, wenn im Liquor zwar Entzündungszellen enthalten sind, in der Kultur jedoch keine Erreger nachgewiesen werden können.[52] Dieser Fall kann bei einer Infektion mit schwer kultivierbaren Erregern eintreten (Spirochäten wie Borrelien, Treponemen oder Leptospiren; Viren; Pilze; Mykoplasmen) oder bei nicht-infektiösen Formen.
Die Glukose-Konzentration in der Hirn-Rückenmarksflüssigkeit beträgt normalerweise etwa 65 % des Blutglukosewertes. Der Quotient aus Liquorglukosewert und Blutzuckerwert ist bei einer bakteriellen Meningitis typischerweise erniedrigt (Quotient ≤ 0,4).[47] Bei Neugeborenen ist der Liquorglukosewert höher und ein Quotient unter 0,6 wird als krankhaft angesehen.[3] Milchsäure (Laktat) ist ein Abbauprodukt von Glukose bei unvollständiger Verstoffwechselung, es verhält sich daher umgekehrt zur Glukosekonzentration. Ein hoher Laktat-Gehalt sagt eine bakterielle Meningitis besser voraus als eine Vermehrung der weißen Blutkörperchen.[47]
Zahlreiche selektive Testmethoden werden verwendet, um die unterschiedlichen Arten von Meningitiden zu identifizieren. Ein Latextest kann bei Streptococcus pneumoniae, Neisseria meningitidis, Haemophilus influenzae, Escherichia coli und Streptokokken der Gruppe B positiv ausfallen. Sein routinemäßiger Einsatz wird jedoch nicht empfohlen, da sein Ergebnis nur selten zur Anpassungen der Therapie führt. Aber er kann hilfreich sein, wenn andere Testmethoden versagen. Auch der Limulus-Amoebozyten-Lysat-Test kann bei Meningitis durch grampositive Keime positiv sein, aber auch er sollte nur zum Einsatz kommen, wenn andere Testmethoden kein verwertbares Ergebnis erbringen.[3] Mittels der Polymerase-Kettenreaktion kann die DNA von Viren und Bakterien in vitro vervielfältigt werden, um so auch geringe Mengen von Erregern im Liquor cerebrospinalis erkennen zu können. Die Sensitivität und Spezifität dieser Untersuchung sind sehr hoch, weil schon Spuren von Erreger-DNA für die Identifikation genügen. Daher kann diese Untersuchung eine wesentliche Hilfestellung bei der Differenzierung bakterieller oder viraler Erreger sein (beispielsweise bei Enteroviren, Herpes-simplex-2-Viren und bei umgeimpften Personen auch Mumps).[38] Serologische Untersuchungen (Antigen-Antikörper-Reaktionen in vitro) können bei viralen Meningitiden hilfreich sein.[38] Beim Verdacht auf Tuberkulose finden entweder die Ziehl-Neelsen-Färbung am Untersuchungsmaterial Anwendung (geringe Sensitivität), oder aber es werden Kulturen angelegt (langsames Wachstum, daher erst nach sechs Wochen ein Ergebnis). Da beide Methoden erhebliche Nachteile haben, wird mehr und mehr auch für diese Fragestellung die Polymerase-Kettenreaktion (PCR) eingesetzt.[10] Die Diagnose der Kryptokokken-Meningitis kann preiswert mithilfe der Negativ-Färbung mit Tusche erfolgen. Allerdings ist die Untersuchung auf Kryptokokken-Antigen in Blut oder Liquor sensitiver, vor allem bei AIDS-Patienten.[53][54][55]
Eine vorher nicht erkannte, aber anbehandelte Meningitis ist ein diagnostisches und therapeutisches Puzzle, da man in diesen Fällen Meningitissymptome findet, nachdem die Patienten – etwa wegen einer Nasennebenhöhlenentzündung – ein Antibiotikum erhalten haben. Im Liquor findet man dann Zeichen einer viralen Meningitis, die antibakterielle Behandlung muss aber fortgesetzt werden, bis eine virale Meningitis durch weitere Maßnahmen (PCR) bestätigt wurde.[38]
Postmortem
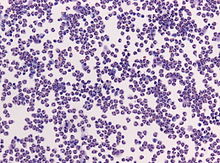
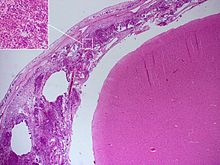 Histopathologie der bakteriellen Meningitis mit Nachweis entzündlicher Infiltrate der Pia mater bei der Autopsie. Diese bestehen überwiegend aus neutrophilen Granulozyten (Einschub). Hämatoxylin-Eosin-Färbung.
Histopathologie der bakteriellen Meningitis mit Nachweis entzündlicher Infiltrate der Pia mater bei der Autopsie. Diese bestehen überwiegend aus neutrophilen Granulozyten (Einschub). Hämatoxylin-Eosin-Färbung.
Eine Meningitis kann auch noch nach dem Tode festgestellt werden. Dabei finden sich insbesondere an Pia mater und Arachnoidea ausgedehnte entzündliche Veränderungen. Dadurch, dass neutrophile Granulozyten in den Liquor und die Gehirnbasis (schädelbasisnaher Anteil des Gehirns) zu Lebzeiten eingewandert sind, kann sich an den Hirnnerven, dem Rückenmark oder den Hirnarterien Eiter finden.[56]
Prävention und Hygienebestimmungen
In den 1980er Jahren wurde in vielen Ländern die Impfung gegen Haemophilus influenzae B in die empfohlenen Routineschemata für Kinder aufgenommen, wodurch in diesen Ländern seither dieser Erreger aus Ursache für eine Meningitis keine große Rolle mehr spielt (im Gegensatz zu den Ländern, denen diese Impfung zu teuer ist).[57][58] Ähnlich hat auch die Impfung gegen Mumps eine deutliche Reduzierung der durch diese Krankheit ausgelösten Meningitisfälle bewirkt.[38] Meningokokkenimpfungen gibt es für die Gruppen A, C, W135 und Y.[59] In Ländern, in denen die Impfung gegen Meningokokken der Gruppe C eingeführt worden war, sank die Fallzahl der durch sie ausgelösten Neuerkrankungen.[57] Zwischenzeitlich bietet die Industrie einen Vierfachimpfstoff mit den oben genannten Bestandteilen an. Die Immunisierung mit dem Vierfach-Impfstoff ACW135Y wird für die Erteilung eines Visums im Rahmen einer islamischen Pilgerfahrt (Haddsch) gefordert.[60] Impfungen gegen die Streptokokkenpneumonie mit Hilfe der Pneumokokken-Impfung, die gegen sieben Serotypen des Erregers wirksam ist, reduziert eindeutig die Inzidenz der durch Pneumokokken verursachten Meningitis.[57][61] Die „Pneumokokken-Polysaccharid-Vakzine“, die 23 Stämme abdeckt, wird nur in besonderen Fällen verabreicht. Dazu gehören Patienten mit einer entfernten Milz. Diese Impfung erzeugt bei manchen Patienten, vor allem Kindern, keine ausreichende Immunität.[61] Es gibt Berichte, dass bei mit Bacillus Calmette-Guérin geimpfte Kinder ein Rückgang der tuberkulösen Meningitis beobachtet wird. Die nicht ausreichende Wirksamkeit bei Erwachsenen ist der Grund für die Suche nach einer besseren Alternative.[57]
Zur Prophylaxe der Neugeborenensepsis durch Gruppe-B-Streptokokken (GBS) wird in Deutschland empfohlen, bei allen Schwangeren zwischen der 35+0 und 37+0 Schwangerschaftswoche eine mikrobiologische Untersuchung auf GBS durchzuführen. Ein Abstrich von Introitus vaginae und Anorektum erlaubt bereits zu diesem Zeitpunkt eine Aussage über den vermutlichen GBS-Kolonisierungsstatus am errechneten Entbindungstermin. Beim Nachweis einer GBS-Besiedlung im Rahmen des Screenings soll keine sofortige Antibiotikatherapie, sondern eine Antibiotikaprophylaxe zum Zeitpunkt der Entbindung (mit Wehenbeginn bzw. nach Blasensprung) durchgeführt werden. Mittel der Wahl ist Penicillin G, welches alle vier Stunden bis zur Entbindung gegeben wird. Ampicillin ist eine wirksame Alternative, die aber durch Förderung von Resistenzentwicklungen bei gram-negativen Erregern aus neonatologischer Sicht Nachteile gegenüber Penicillin hat. Bei Penicillinallergie sollte Cefazolin oder ein anderes Cephalosporin der zweiten Generation genutzt werden. Um einen möglichst hohen schützenden Effekt der Antibiotika-Prophylaxe für das Kind zu erreichen, sollte die erste Gabe des Antibiotikums an die Mutter mehr als vier Stunden vor der Geburt erfolgen. Bei einer primären Schnittentbindung ohne Blasensprung und ohne Wehentätigkeit kann auf eine antibiotische GBS-Prophylaxe verzichtet werden, da das Risiko für eine kindliche GBS-Infektion gering ist. Frauen, die bereits ein Kind mit einer GBS-Infektion geboren haben, sollten generell unter der Geburt eine Prophylaxe mit einem Antibiotikum erhalten. Auf das Screening kann man bei diesen Frauen verzichten.[7] In einigen dieser Fälle von Meningitis kann eine Vorbeugung auch langfristig durch Impfung und kurzfristig mittels Antibiotika erfolgen.
In Deutschland müssen bei begründetem Verdacht auf das Vorliegen einer Meningokokkenmeningitis die zuständigen Gesundheitsbehörden informiert werden. Die Patienten müssen bis 24 Stunden nach Beginn einer adäquaten Antibiotikatherapie auch isoliert werden. Da die Inkubationszeit in der Regel 3–4 (max. 10) Tage beträgt, erhalten Kontaktpersonen eine Chemoprophylaxe, als Standard Rifampicin für zwei Tage. Alternativen sind Ciprofloxacin beim Erwachsenen und Ceftriaxon bei Kindern. Dadurch wird das Risiko der Weitergabe der Erkrankung reduziert. Es schützt aber nicht vor einer zukünftigen Erkrankung.[46][62]
Behandlung
Erstversorgung
Eine Meningitis ist eine potenziell lebensbedrohliche Erkrankung und hat eine hohe Sterblichkeitsrate, wenn sie unbehandelt bleibt.[3] Eine verzögert einsetzende Behandlung ist mit einer ungünstigeren Prognose verbunden. Aus diesem Grund sollte mit dem Beginn einer Behandlung mit einem Breitband-Antibiotikum nicht gewartet werden, bis technische Untersuchungen die Diagnose bestätigen. Falls eine Meningokokken-Meningitis vermutet wird, soll schon als Notfallversorgung vor Ort Penicillin G verabreicht werden. Bei Flüssigkeitsmangel mit niedrigem Blutdruck oder Schock-Symptomen soll intravenös Flüssigkeit verabreicht werden. Aufgrund der vielfältigen und schweren Komplikationen der Erkrankung sollen die Patienten häufig ärztlich untersucht werden, im Zweifelsfalle ist eine Behandlung auf einer Intensivstation angezeigt. Bei bewusstseinsgestörten Patienten und bei Ateminsuffizienz ist eine Beatmung notwendig. Falls es Hinweise auf einen erhöhen Hirndruck gibt, sollte dieser gemessen und Maßnahmen zur Hirndrucksenkung unternommen werden, zum Beispiel mit Mannitol. Krampfanfälle können durch ein Antikonvulsivum behandelt werden, bei Hydrocephalus kann die Anlage einer externen Ventrikeldrainage oder eines ventrikulo-peritonealen Shuntsystems notwendig werden.[4][37][48]
Bakterielle Meningitis
Antibiotika-Therapie
Im Falle einer bakteriellen Meningitis muss sofort auf Verdacht hin – also ohne Diagnosesicherung – behandelt werden. Die Auswahl des Antibiotikums erfolgt in erster Linie aufgrund einer Vermutung über den verursachenden Keim („blind“). In Großbritannien wird daher verdachtsweise ein Cephalosporin wie Cefotaxim verabreicht,[46][48] in den USA aufgrund zunehmender Resistenzen nicht selten Vancomycin.[3][4][46] Die Überlegungen zur Auswahl des Antibiotikums für die initiale Therapie sollten auch das Alter des Patienten berücksichtigen, sowie die Frage, ob der Patient eine Kopfverletzung erlitten hat, eine neurochirurgische Operation durchgeführt wurde oder ein Shuntsystem eingebaut wurde.[3] Bei Kindern, Patienten über 50 Jahren und Personen, die immungeschwächt sind, wird die zusätzliche Gabe von Ampicillin empfohlen, um eine Infektion mit Listerien abzudecken.[3][46]
Sobald das Ergebnis einer Ausstrichuntersuchung zur Verfügung steht, kann man das Erregerspektrum ausreichend eingrenzen, um gegebenenfalls die antibiotische Therapie anzupassen.[3] Die Ergebnisse der Liquorkultur liegen üblicherweise erst nach ein bis zwei Tagen vor. Dann kann die empirische auf eine spezifische Therapie umgestellt werden, da üblicherweise der Erreger und seine Sensitivität bekannt sind.[3] Damit Antibiotika im Falle einer Meningitis wirksam sind, müssen sie die Hirnhäute in ausreichender Menge erreichen. Manche Antibiotika können die Blut-Hirn-Schranke nicht überwinden und sind daher für die Behandlung der Meningitis ungeeignet. Die Kenntnis über die Eignung der entsprechenden Medikamente stammt dabei meist aus Tierversuchen.[3]
Die Behandlung der tuberkulösen Meningitis verlangt eine ausreichend lange antibiotische Therapie. Während man bei einer Lungentuberkulose üblicherweise ein halbes Jahr Tuberkulostatika gibt, dehnt man diese bei einer Infektion der Meningen auf ein Jahr aus.[10] Falls die Patienten nicht zusätzlich eine AIDS-Erkrankung haben, werden zusätzlich Corticosteroide gegeben.[63]
Corticosteroide
Die adjuvante Therapie der Meningitis mit Corticosteroiden (üblicherweise Dexamethason) reduziert die Sterblichkeit sowie das Risiko von Hörverlust und neurologischen Folgeschäden bei jugendlichen und erwachsenen Patienten in westlichen Ländern mit einer niedrigen HIV-Infektionsrate.[64] Der vermutete Mechanismus ist die Unterdrückung überschießender Entzündungsreaktionen.[65]
Die Behandlungsleitlinien empfehlen daher die Gabe von Dexamethason oder ähnlichen Corticosteroiden unmittelbar vor der ersten Antibiotikagabe und weiter für vier Tage.[46][48] Da erfahrungsgemäß Patienten mit einer Pneumokokkeninfektion am meisten von der Corticosteroidgabe profitieren, raten manche Autoren dazu, Corticosteroide abzusetzen, sobald ein anderer Erreger identifiziert wurde.[46][3]
Corticosteroide wirken bei Kindern und Erwachsenen mit einer Meningitis unterschiedlich. Während in westlichen Ländern beide Patientengruppen profitieren, ist ein Vorteil für Kinder aus armen Ländern nicht nachgewiesen. Die Ursache für diesen Unterschied ist unbekannt.[66] In reichen westlichen Ländern ist der Nutzen der adjuvanten Corticosteroidtherapie nur in den Fällen einer Haemophilus-influenzae-Meningitis nachgewiesen, und dann auch nur, wenn man damit vor der antibiotischen Therapie beginnt.[3][67] Deren Vorkommen ist aber seit der Einführung der Haemophilus-influenzae-B-Impfstoffe deutlich gesunken. Manche Autoren raten deshalb Corticosteroide nur bei kindlichen Haemophilus-influenza-Meningitiden zu geben und dann auch nur, wenn vorher noch keine Antibiotika gegeben wurden. Alle anderen Fälle werden kontrovers beurteilt.[3]
Virale Meningitis
Eine virale Meningitis erfordert üblicherweise lediglich eine unterstützende (supportive) Behandlung, da die meisten Viren, die eine Meningitis verursachen, einer kausalen Therapie nicht zugänglich sind. Die virale Meningitis verläuft üblicherweise gutartiger als eine bakterielle Meningitis. Infektionen mit Herpes-simplex-Viren und durch das Varizella-Zoster-Virus können auf Virostatika wie Aciclovir ansprechen, es gibt aber keine klinischen Studien, die die Wirksamkeit dieser Maßnahme untersucht haben.[38] Milde Verläufe einer viralen Meningitis können auch ambulant mit konservativen Maßnahmen (Bettruhe, Schmerzmittel und ausreichend Flüssigkeit) behandelt werden.[68]
Kryptokokken-Meningitis
Die Kryptokokken-Meningitis wird mittels hoher Dosen von Antimykotika wie Amphotericin B oder 5-Fluorcytosin über einen langen Zeitraum behandelt.[53][69]
Prognose
Eine virale Meningitis neigt zur spontanen Heilung und ist nur selten tödlich. Die bakterielle Meningitis verläuft hingegen unbehandelt fast immer tödlich. Unter einer Behandlung hängt die Sterblichkeit (Letalität) einer bakteriellen Meningitis vom Alter des Patienten und der zugrunde liegenden Ursache ab. Neugeborene Patienten können in 20–30 % der Fälle infolge einer bakteriellen Meningitis sterben. Das Risiko zu versterben ist bei älteren Kindern deutlich geringer. Deren Sterblichkeit beträgt nur etwa 2 %, steigt aber bei Erwachsenen wieder auf ca. 19–37 % an. Das Risiko an einer Meningitis zu versterben, hängt außer vom Alter noch von weiteren Faktoren ab. So spielen der Erreger und die Zeit eine Rolle, die der Organismus braucht, um den Liquor vom Erreger zu befreien. Entscheidend ist darüber hinaus auch der Allgemeinzustand des Patienten, das Ausmaß der Bewusstseinsstörung und ob eine Leukopenie vorliegt. Eine Meningitis, die von Haemophilus influenzae oder von Meningokokken verursacht wird, hat eine bessere Prognose als eine durch Streptokokken der Gruppe B, coliformen Erregern oder Pneumokokken hervorgerufene. Bei Erwachsenen ist die Prognose von Meningokokkenmeningitiden günstiger (Mortalität von 3 bis 7 %) als Erkrankungen mit Pneumokokken.[2][4]
Bei Kindern kann eine Meningitis eine Reihe von Folgeschäden verursachen. Bei bis zu 15 % der überlebenden Kinder können Schallempfindungsschwerhörigkeit, Epilepsie, Lernbehinderung und Verhaltensauffälligkeiten ebenso wie eine Intelligenzminderung beobachtet werden.[2] Die Hörminderung kann in manchen Fällen reversibel sein.[70] Bei Erwachsenen verlaufen etwa zwei Drittel der Fälle ohne Folgeschäden. Hier kommen hauptsächlich eine Hörminderung (in 14 % der Fälle) und kognitive Defizite (in 10 % der Fälle) vor.[4]
Epidemiologie
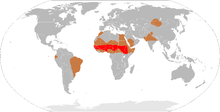 Verbreitung der Meningokokkenmeningitis im „Meningitisgürtel“
Verbreitung der Meningokokkenmeningitis im „Meningitisgürtel“
Obwohl die Meningitis in vielen Ländern eine meldepflichtige Krankheit ist, sind genaue epidemiogische Zahlen nicht bekannt.[38] In westlichen Ländern kommen etwa 3 Fälle einer bakteriellen Meningitis auf 100.000 Einwohner pro Jahr vor. In Populationsstudien wurde gezeigt, dass virale Meningitiden mit ungefähr 11 Fällen pro 100.000 Einwohner und Jahr häufiger vorkommen und es vor allem einen Erkrankungsgipfel im Sommer gibt. In Brasilien ist die Erkrankungsrate mit etwa 46/100.000 Einwohner pro Jahr deutlich höher. In Afrika südlich der Sahara gibt es während der Trockenzeit Meningitisepidemien mit einer Erkrankungsrate bis von 100 bis 800/100.000 Einwohner pro Jahr.[72][6] In Afrika starten diese Epidemien hauptsächlich in der Zeit zwischen Dezember und Juni, können zwei bis drei Jahre anhalten und enden dann während der Regenzeit.[73] Die Erkrankung wird hauptsächlich von Meningokokken verursacht.[6] Die größte bekannte Epidemie dieser Art ereignete sich 1996–1997. Damals erkrankten 250.000 Menschen und 25.000 starben.[74] Meningokokken-Erkrankungen ereignen sich in epidemischer Form, wenn viele Menschen erstmals in größerer Anzahl zusammenleben. Dies kommt beispielsweise bei kasernierten Rekruten während einer Mobilmachung, bei den Erstjahrgängen eines Colleges[2] oder auch bei Pilgerfahrten wie der jährlichen Haddsch[60] vor. Obwohl die Ursachen für wiederkehrende Epidemien wie in Afrika nicht gut verstanden sind, wurden verschiedene Faktoren für diese Vorgänge verantwortlich gemacht. Dazu zählen eine erhöhte Krankheitsbereitschaft der betroffenen Menschen, demographische Bedingungen, wie die hohe Anzahl an Flüchtlingen, Überbevölkerung, Armut, klimatische Bedingungen und rezidivierende Atemwegsinfekte.[72]
Es gibt deutliche regionale Unterschiede im Auftreten der Meningitis. So findet man bei Meningkokkenmeningitiden in Europa vorwiegend Neisserien der Gruppen B und C, während der Subtyp A in China und bei Mekka-Pilgern dominiert. Hauptverantwortlich für die Erkrankungen im Meningitis-Gürtel sind die Subtypen A und C. Jüngste Epidemien in Afrika und Saudi-Arabien wurden von Meningokokken der Gruppe W135 verursacht.[57] Man erwartet, dass solche regionalen Unterschiede auch in Zukunft unter anderem infolge von Impfkampagnen auftreten.[57] Der aktuelle Ausbruch einer Meningitisepidemie in Afrika dauert seit Januar 2009 an. Es sind hauptsächlich westafrikanische Länder betroffen. Zwischenzeitlich sind über 1.000 Menschen im Rahmen dieser Epidemie gestorben und über 25.000 erkrankt. Es handelt sich damit um die derzeit zweitschwerste Meningitisepidemie seit 1996.[75]
Geschichte
Die Schriften von Hippokrates von Kos (* um 460 v. Chr.; † um 370 v. Chr.) enthalten zahlreiche Beschreibungen von Krankheitszuständen, die dem klinischen Bild einer Meningitis vereinbar sind.[76] Man geht davon aus, dass mittelalterlichen Ärzten wie Avicenna das Symptom des Meningismus bekannt war.[77] Aus dem 17. und 18. Jahrhundert stammen verschiedene Berichte von unter „Gehirnfieber“ („Phrenitis“, „Cephalitis“) leidenden Patienten, deren Symptomkonstellationen teilweise auf das Vorliegen einer Meningitis oder Enzephalitis schließen lassen.[76] Thomas Willis beschrieb in einer 1685 posthum veröffentlichten Arbeit die „Phrensy“ (deutsch: etwa „Fieberwahn“), eine Meningitis-Symptomatik mit Meningismus, Opisthotonus und Krampfanfällen, die er auf eine Entzündung der Hirnhäute und eine Kompression des Gehirns zurückführte. Seine Aufzeichnungen umfassen zudem die Beschreibung eines entsprechenden „epidemischen Fiebers“ im Jahre 1661, bei dem es sich wahrscheinlich um eine Meningokokken-Epidemie handelte.[78] Dem britischen Arzt Robert Whytt aus Edinburgh wird die Erstbeschreibung der tuberkulösen Meningitis 1768 zugeschrieben. Man nannte diese Erkrankung seinerzeit „Gehirnwassersucht“. Die Verbindung zum Tuberkuloseerreger wurde allerdings erst etwa hundert Jahre später hergestellt.[77][79] Epidemische Meningitiden scheinen ein weitgehend modernes Phänomen zu sein.[80] Der erste bekannte Ausbruch der Erkrankung in Form einer Epidemie wird vielfach für das Jahr 1805 in der schweizerischen Stadt Genf angegeben.[80][81] Kurze Zeit später werden weitere Meningitis-Epidemien in Europa und den USA beschrieben. 1840 wurde erstmals ein solches Ereignis in Nordafrika, in Algerien, bekannt. Ausbrüche 1905 in Nigeria und von 1906 bis 1908 in Ghana, waren möglicherweise die erste Meningokokkenepidemie in Westafrika.[80] Der österreichische Bakteriologe Anton Weichselbaum beschrieb 1887 zum ersten Mal eine bakterielle Meningitis und nannte den Erreger „Meningococcus“.[82]
Die Sterblichkeit durch Meningitiden war in den frühen Berichten sehr hoch (über 90 %). Der amerikanische Wissenschaftler Simon Flexner stellte 1906 ein Antiserum aus Pferdeblut her und erreichte dadurch eine deutliche Reduktion der Sterblichkeit.[83][84] Im Jahr 1944 wurde erstmals die Wirksamkeit des Penicillins bei der Behandlung der Meningitis beschrieben.[85] Die Einführung der Haemophilus-Impfung zum Ende des 20. Jahrhunderts führte zu einem deutlichen Rückgang der Erkrankungshäufigkeit mit diesem Erreger.[58] Der jüngste wichtige Fortschritt war im Jahre 2002 der Nachweis der Wirksamkeit der Corticosteroidbehandlung zur Reduktion von Komplikationen im Frühverlauf der Erkrankung.[84]
Literatur
- S1-Leitlinie Bakterielle (eitrige) Meningoenzephalitis der Deutschen Gesellschaft für Neurologie. In: AWMF online (Stand 2008)
- S1-Leitlinie Virale Meningoenzephalitis der Deutschen Gesellschaft für Neurologie. In: AWMF online (Stand 2008)
- S1-Leitlinie Atypische erregerbedingte Meningoenzephalitiden der Deutschen Gesellschaft für Neurologie. In: AWMF online (Stand 2008)
- Kenneth L. Tyler: A history of bacterial meningitis. In: S. Finger, F. Boller, K. L. Tyler (Hrsg.): History of Neurology. Elsevier, 2010, ISBN 978-0-444-52009-8, S. 419–433.
Weblinks
 Commons: Meningitis – Sammlung von Bildern, Videos und Audiodateien
Commons: Meningitis – Sammlung von Bildern, Videos und Audiodateien- Links zum Thema Meningitis im Open Directory Project
- Nationales Referenzzentrum für Meningokokken am Institut für Hygiene und Mikrobiologie der Universität Würzburg
Einzelnachweise
- ↑ a b c d e f g Ginsberg L: Difficult and recurrent meningitis. In: Journal of Neurology, Neurosurgery, and Psychiatry. 75 Suppl 1, März 2004, S. i16–21. doi:10.1136/jnnp.2003.034272. PMID 14978146. Volltext bei PMC: 1765649.
- ↑ a b c d e f g h i j k l m n o p q Sáez-Llorens X, McCracken GH: Bacterial meningitis in children. In: Lancet. 361, Nr. 9375, Juni 2003, S. 2139–2148. doi:10.1016/S0140-6736(03)13693-8. PMID 12826449.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z Tunkel AR, Hartman BJ, Kaplan SL, et al.: Practice guidelines for the management of bacterial meningitis. In: Clinical Infectious Diseases. 39, Nr. 9, November 2004, S. 1267–1284. doi:10.1086/425368. PMID 15494903.
- ↑ a b c d e f g h i van de Beek D, de Gans J, Tunkel AR, Wijdicks EF: Community-acquired bacterial meningitis in adults. In: The New England Journal of Medicine. 354, Nr. 1, Januar 2006, S. 44–53. doi:10.1056/NEJMra052116. PMID 16394301.
- ↑ Gesundheitsberichterstattung des Bundes zu meldepflichtigen Krankheiten.
- ↑ a b c d e f Attia J, Hatala R, Cook DJ, Wong JG: The rational clinical examination. Does this adult patient have acute meningitis?. In: JAMA. 282, Nr. 2, Juli 1999, S. 175–81. doi:10.1001/jama.282.2.175. PMID 10411200.
- ↑ a b S1-Leitlinie Prophylaxe der Neugeborensepsis – frühe Form – durch Streptokokken der Gruppe B der Gesellschaft für Neonatologie und Pädiatrische Intensivmedizin (GNPI), Deutschen Gesellschaft für Gynäkologie und Geburtshilfe, Deutschen Gesellschaft für Pädiatrische Infektiologie (DGPI), und Deutschen Gesellschaft für Perinatale Medizin (DGPM). In: AWMF online (Stand 7/2008)
- ↑ Wei BP, Robins-Browne RM, Shepherd RK, Clark GM, O'Leary SJ: Can we prevent cochlear implant recipients from developing pneumococcal meningitis?. In: Clin. Infect. Dis.. 46, Nr. 1, Januar 2008, S. e1–7. doi:10.1086/524083. PMID 18171202.
- ↑ a b Tebruegge M, Curtis N: Epidemiology, etiology, pathogenesis, and diagnosis of recurrent bacterial meningitis. In: Clinical Microbiology Reviews. 21, Nr. 3, Juli 2008, S. 519–37. doi:10.1128/CMR.00009-08. PMID 18625686. Volltext bei PMC: 2493086.
- ↑ a b c Thwaites G, Chau TT, Mai NT, Drobniewski F, McAdam K, Farrar J: Tuberculous meningitis. In: Journal of Neurology, Neurosurgery, and Psychiatry. 68, Nr. 3, März 2000, S. 289–99. doi:10.1136/jnnp.68.3.289. PMID 10675209. Volltext bei PMC: 1736815.
- ↑ * Reuter P.: Springer Großwörterbuch Medizin. Medical Dictionary Deutsch-Englisch / English-German: So Schreibt Man Medizin, Springer, 2004, S. 492 + 571, ISBN 354021352X, hier online
* Böcker W., e.a.: Pathologie, Urban&FischerVerlag, 2008, S.286, ISBN 3437423827, hier online
* Bankl H., e.a.: Arbeitsbuch Pathologie, Bände 2-3, Facultas Verlag, 2000, S.375ff. + 501, ISBN 3850765369, hier online - ↑ Douvoyiannis M, Litman N, Goldman DL: Neurologic manifestations associated with parvovirus B19 infection. Clin. Infect. Dis. (2009) 48(12): S. 1713–1723 PMID 19441978
- ↑ H. W. Doerr, W. H. Gerlich (Hg.): Medizinische Virologie, 2. Auflage Stuttgart 2010 ISBN 978-3-13-113962-7, S. 206ff
- ↑ Chotmongkol V.: Comparison of prednisolone plus albendazole with prednisolone alone for treatment of patients with eosinophilic meningitis.. In: Am J Trop Med Hyg, 2009 /81/3, S.443ff., PMID 19706911
- ↑ Panackel C., e.a.: Eosinophilic meningitis due to Angiostrongylus cantonensis. In: Ind J Med Microbio, 2006/24/3, S., 220ff.m PMID 16912445
- ↑ Weller P. F., e.a.: Eosinophilic meningitis. In: Semin Neurol, 1993/13/2, S.161–8, PMID 8356350
- ↑ Schermoly M. J., e.a.: Eosinophilia in coccidioidomycosis. In: Arch. Intern. Med., 1988/148/4, S.895–6, PMID 3355309
- ↑ Chamberlain MC: Neoplastic meningitis. In: Journal of Clinical Oncology: official journal of the American Society of Clinical Oncology. 23, Nr. 15, Mai 2005, S. 3605–13. doi:10.1200/JCO.2005.01.131. PMID 15908671.
- ↑ Moris G, Garcia-Monco JC: The Challenge of Drug-Induced Aseptic Meningitis. In: Archives of Internal Medicine. 159, Nr. 11, Juni 1999, S. 1185–1194. doi:10.1001/archinte.159.11.1185. PMID 10371226.
- ↑ Logan SA, MacMahon E.: Viral meningitis. in: BMJ. 2008 Jan 5;336(7634):36-40. PMID 18174598.
- ↑ Irani DN.: Aseptic meningitis and viral myelitis. in: Neurol Clin. 2008 Aug;26(3):635-55, vii-viii. PMID: 18657719
- ↑ Kupila L, Vuorinen T, Vainionpää R, Hukkanen V, Marttila RJ, Kotilainen P.: Etiology of aseptic meningitis and encephalitis in an adult population. in: Neurology. 2006 Jan 10;66(1):75-80. PMID 16401850.
- ↑ Rotbart HA.: Viral meningitis. in: Semin Neurol. 2000;20(3):277-92. PMID 11051293.
- ↑ Michos AG, Syriopoulou VP, Hadjichristodoulou C, Daikos GL, Lagona E, Douridas P, Mostrou G, Theodoridou M.: Aseptic meningitis in children: analysis of 506 cases. in: PLoS One. 2007 Aug 1;2(7):e674. PMID 17668054.
- ↑ http://www.cdc.gov/meningitis/about/faq.html#c
- ↑ Kumar R.: Aseptic meningitis: diagnosis and management. in: Indian J Pediatr. 2005 Jan;72(1):57-63. PMID 15684450
- ↑ Irani DN.: Aseptic meningitis and viral myelitis. in: Neurol Clin. 2008 Aug;26(3):635-55, vii-viii. PMID 18657719.
- ↑ Shahien R, Vieksler V, Bowirrat A.: Amoxicillin-induced aseptic meningoencephalitis. in: Int J Gen Med. 2010 Jul 21;3:157-62. PMID 20689687.
- ↑ Moris G, Garcia-Monco JC.: The challenge of drug-induced aseptic meningitis. in: Arch Intern Med. 1999 Jun 14;159(11):1185-94. Review. PMID 10371226.
- ↑ Peltola H, Kulkarni PS, Kapre SV, Paunio M, Jadhav SS, Dhere RM.: Mumps outbreaks in Canada and the United States: time for new thinking on mumps vaccines. in: Clin Infect Dis. 2007 Aug 15;45(4):459-66. Epub 2007 Jul 10.PMID 17638194.
- ↑ Chamberlain MC.: Neoplastic meningitis. in: Oncologist. 2008 Sep;13(9):967-77. Epub 2008 Sep 5. Review. PMID 18776058
- ↑ Zheng RL, Lv H, Zhang W, Yu MX, Yuan Y.: Rheumatoid leptomeningitis: a case report and literature review. in: Beijing Da Xue Xue Bao. 2006 Jun 18;38(3):324-5. PMID 16778982.
- ↑ Avery RA, Frank G, Glutting JJ, Eppes SC.: Prediction of Lyme meningitis in children from a Lyme disease-endemic region: a logistic-regression model using history, physical, and laboratory findings. in: Pediatrics. 2006 Jan;117(1):e1-7. PMID 16396843.
- ↑ Perevoscikovs J, Brila A, Firstova L, Komarova T, Lucenko I, Osmjana J, Savrasova L, Singarjova I, Storozenko J, Voloscuka N, Zamjatina N.: Ongoing outbreak of aseptic meningitis in South-Eastern Latvia, June - August 2010. in: Euro Surveill. 2010 Aug 12;15(32). pii: 19639. PMID 20738995.
- ↑ van de Beek D, de Gans J, Spanjaard L, Weisfelt M, Reitsma JB, Vermeulen M: Clinical features and prognostic factors in adults with bacterial meningitis. In: The New England Journal of Medicine. 351, Nr. 18, Oktober 2004, S. 1849–1859. doi:10.1056/NEJMoa040845. PMID 15509818.
- ↑ Thomas KE, Hasbun R, Jekel J, Quagliarello VJ: The diagnostic accuracy of Kernig's sign, Brudzinski's sign, and nuchal rigidity in adults with suspected meningitis. In: Clinical Infectious Diseases. 35, Nr. 1, Juli 2002, S. 46–52. doi:10.1086/340979. PMID 12060874.
- ↑ a b c Theilen U, Wilson L, Wilson G, Beattie JO, Qureshi S, Simpson D: Management of invasive meningococcal disease in children and young people: Summary of SIGN guidelines. In: BMJ (Clinical research ed.). 336, Nr. 7657, Juni 2008, S. 1367–1370. doi:10.1136/bmj.a129. PMID 18556318. Volltext bei PMC: 2427067. Full guideline page
- ↑ a b c d e f g Logan SA, MacMahon E: Viral meningitis. In: BMJ (Clinical research ed.). 336, Nr. 7634, Januar 2008, S. 36–40. doi:10.1136/bmj.39409.673657.AE. PMID 18174598. Volltext bei PMC: 2174764.
- ↑ a b c d Sáez-Llorens X, McCracken GH: Bacterial meningitis in children. Lancet vol. 361/9375, S. 2139–2148 2003 PMID 12826449
- ↑ Varon J, Chen K, Sternbach GL: Rupert Waterhouse and Carl Friderichsen: adrenal apoplexy. In: J Emerg Med vol. 16/4 S. 643–7, 1998 PMID 9696186
- ↑ a b c d van de Beek D, de Gans J, Tunkel AR, Wijdicks EF. Community-acquired bacterial meningitis in adults. In: The New England Journal of Medicine vol. 354/1 S. 44–53, 2006, PMID 16394301
- ↑ Tunkel AR, Hartman BJ, Kaplan SL, et al.: Practice guidelines for the management of bacterial meningitis. In: Clinical Infectious Diseases, vol. 39/9 S. 1267–1284, 2004, PMID 15494903
- ↑ Philippon D, Bergeron F, Ferron P, Bussières R.: Cochlear implantation in postmeningitic deafness. in: Otol Neurotol. 2010 Jan;31(1):83-7. PMID 20050267
- ↑ Merkus P, Free RH, Mylanus EA, Stokroos R, Metselaar M, van Spronsen E, Grolman W, Frijns JH.: Dutch Cochlear Implant Group (CI-ON) consensus protocol on postmeningitis hearing evaluation and treatment. in: Otol Neurotol. 2010 Oct;31(8):1281-6. PMID 20814346
- ↑ Drew Provan, Andrew Krentz: Oxford Handbook of Clinical and Laboratory Investigation. Oxford: Oxford University Press 2005, ISBN 0198566638
- ↑ a b c d e f g h i j Chaudhuri A., e.a.: EFNS guideline on the management of community-acquired bacterial meningitis: report of an EFNS Task Force on acute bacterial meningitis in older children and adults. In: European Journal of Neurolology, 2008 15/7, S. 649–59, PMID 18582342
- ↑ a b c d Straus S. E., e.a.: How do I perform a lumbar puncture and analyze the results to diagnose bacterial meningitis?. In: JAMA (Journal of the American Medical Association), 2006 296/16, S. 2012–2022, PMID 17062865
- ↑ a b c d e Heyderman R. S., e.a.: Early management of suspected bacterial meningitis and meningococcal septicaemia in adults. In: The Journal of infection, 2003/46/2, S.75–7, PMID 12634067 – Leitlinie Early management of suspected meningitis and meningococcal septicaemia in immunocompetent adults der British Infection Society & UK Meningitis Research Trust, 2004, pdf
- ↑ Ali Yikilmaz, George A. Taylor: Sonographic findings in bacterial meningitis in neonates and young infants. Pediatric Radiology 38 (2008), 129-137, doi:10.1007/s00247-007-0538-6
- ↑ Maconochie I, Baumer H, Stewart ME: Fluid therapy for acute bacterial meningitis. In: Cochrane Database Syst Rev. Nr. 1, 2008, S. CD004786. doi:10.1002/14651858.CD004786.pub3. PMID 18254060.
- ↑ Weller PF, Liu LX: Eosinophilic meningitis. In: Semin Neurol. 13, Nr. 2, Juni 1993, S. 161–8. PMID 8356350.
- ↑ Herbert Renz-Polster, Steffen Krautzig: Basislehrbuch Innere Medizin. 4. Auflage. Elsevier / Urban & Fischer, 2008, ISBN 978-3-437-41053-6., S. 1185
- ↑ a b Bicanic T, Harrison TS: Cryptococcal meningitis. In: British Medical Bulletin. 72, 2004, S. 99–118. doi:10.1093/bmb/ldh043. PMID 15838017.
- ↑ Saag MS, Graybill RJ, Larsen RA, et al.: Practice guidelines for the management of cryptococcal disease. Infectious Diseases Society of America. In: Clin. Infect. Dis.. 30, Nr. 4, April 2000, S. 710–8. doi:10.1086/313757. PMID 10770733.
- ↑ Sloan D, Dlamini S, Paul N, Dedicoat M: Treatment of acute cryptococcal meningitis in HIV infected adults, with an emphasis on resource-limited settings. In: Cochrane Database Syst Rev. Nr. 4, 2008, S. CD005647. doi:10.1002/14651858.CD005647.pub2. PMID 18843697.
- ↑ David A., e. a.: Oxford Textbook of Medicine Volume One, Oxford Press, 2003, S.1115–1129, ISBN 0-19-852787-X
- ↑ a b c d e f Segal S, Pollard AJ: Vaccines against bacterial meningitis. In: British Medical Bulletin. 72, 2004, S. 65–81. doi:10.1093/bmb/ldh041. PMID 15802609.
- ↑ a b Peltola H.: Worldwide Haemophilus influenzae type b disease at the beginning of the 21st century: global analysis of the disease burden 25 years after the u. In: Clinical Microbiology Reviews, 2000/13/2, S. 302–17, PMID 10756001
- ↑ Harrison L. H.: Prospects for vaccine prevention of meningococcal infection. In: Clinical microbiology reviews, 2006/191, S. 142–64, PMID 16418528
- ↑ a b Wilder-Smith A: Meningococcal vaccine in travelers. In: Current Opinion in Infectious Diseases. 20, Nr. 5, Oktober 2007, S. 454–60. doi:10.1097/QCO.0b013e3282a64700. PMID 17762777.
- ↑ a b Weisfelt M, de Gans J, van der Poll T, van de Beek D: Pneumococcal meningitis in adults: new approaches to management and prevention. In: Lancet Neurol. 5, Nr. 4, April 2006, S. 332–42. doi:10.1016/S1474-4422(06)70409-4. PMID 16545750.
- ↑ Fraser A, Gafter-Gvili A, Paul M, Leibovici L: Antibiotics for preventing meningococcal infections. In: Cochrane Database of Systematic Reviews (Online). Nr. 4, 2006, S. CD004785. doi:10.1002/14651858.CD004785.pub3. PMID 17054214.
- ↑ Prasad K, Singh MB: Corticosteroids for managing tuberculous meningitis. In: Cochrane Database of Systematic Reviews (Online). Nr. 1, 2008, S. CD002244. doi:10.1002/14651858.CD002244.pub3. PMID 18254003.
- ↑ Assiri AM, Alasmari FA, Zimmerman VA, Baddour LM, Erwin PJ, Tleyjeh IM: Corticosteroid administration and outcome of adolescents and adults with acute bacterial meningitis: a meta-analysis. In: Mayo Clin. Proc.. 84, Nr. 5, Mai 2009, S. 403–9. doi:10.4065/84.5.403. PMID 19411436. Volltext bei PMC: 2676122.
- ↑ de Gans J, van de Beek D: Dexamethasone in adults with bacterial meningitis. In: The New England Journal of Medicine. 347, Nr. 20, November 2002, S. 1549–1556. doi:10.1056/NEJMoa021334. PMID 12432041.
- ↑ van de Beek D, de Gans J, McIntyre P, Prasad K: Corticosteroids for acute bacterial meningitis. In: Cochrane Database of Systematic Reviews (Online). Nr. 1, 2007, S. CD004405. doi:10.1002/14651858.CD004405.pub2. PMID 17253505.
- ↑ McIntyre PB, Berkey CS, King SM, et al.: Dexamethasone as adjunctive therapy in bacterial meningitis. A meta-analysis of randomized clinical trials since 1988. In: JAMA. 278, Nr. 11, September 1997, S. 925–31. doi:10.1001/jama.278.11.925. PMID 9302246.
- ↑ Meningitis and Encephalitis Fact Sheet. National Institute of Neurological Disorders and Stroke (NINDS) (11. Dezember 2007). Abgerufen am 27. April 2009.
- ↑ Gottfredsson M, Perfect JR: Fungal meningitis. In: Seminars in Neurology. 20, Nr. 3, 2000, S. 307–22. doi:10.1055/s-2000-9394. PMID 11051295.
- ↑ Richardson MP, Reid A, Tarlow MJ, Rudd PT: Hearing loss during bacterial meningitis. In: Archives of Disease in Childhood. 76, Nr. 2, Februar 1997, S. 134–38. doi:10.1136/adc.76.2.134. PMID 9068303. Volltext bei PMC: 1717058.
- ↑ Mortality and Burden of Disease Estimates for WHO Member States in 2002 (xls). World Health Organization (2002). Abgerufen am 12. Januar 2011.
- ↑ a b World Health Organization: Control of epidemic meningococcal disease, practical guidelines, 2nd edition, WHO/EMC/BA/98 (PDF), 3, S. 1–83 1998
- ↑ Greenwood B: Manson Lecture. Meningococcal meningitis in Africa. In: Trans. R. Soc. Trop. Med. Hyg.. 93, Nr. 4, 1999, S. 341–53. PMID 10674069.
- ↑ WHO: Detecting meningococcal meningitis epidemics in highly-endemic African countries. (PDF) In: Weekly Epidemiological Record. 78, Nr. 33, 2003, S. 294–6. PMID 14509123.
- ↑ Meningococcal Disease: situation in the African Meningitis Belt. WHO. Abgerufen am 29. März 2009.
- ↑ a b Kenneth L. Tyler: A history of bacterial meningitis. In: S. Finger, F. Boller, K. L. Tyler (Hrsg.): History of Neurology. Elsevier, 2010, ISBN 978-0-444-52009-8, S. 417.
- ↑ a b Arthur Earl Walker, Edward R. Laws, George B. Udvarhelyi: Infections and inflammatory involvement of the CNS. In: The Genesis of Neuroscience, S. 219–21, Thieme 1998, ISBN 1-879-28462-6
- ↑ Kenneth L. Tyler: A history of bacterial meningitis. In: S. Finger, F. Boller, K. L. Tyler (Hrsg.): History of Neurology. Elsevier, 2010, ISBN 978-0-444-52009-8, S. 418.
- ↑ Whytt R: Observations on the Dropsy in the Brain. Edinburgh: J. Balfour 1768
- ↑ a b c Greenwood B: 100 years of epidemic meningitis in West Africa – has anything changed?. In: Tropical Medicine & International health: TM & IH. 11, Nr. 6, Juni 2006, S. 773–80. doi:10.1111/j.1365-3156.2006.01639.x. PMID 16771997.
- ↑ Vieusseux G: Memoire sur la maladie qui regnéà Geneve au printemps de 1805. In: Journal de Médecine, de Chirurgie et de Pharmacologie (Bruxelles). 11, 1806, S. 50–53.
- ↑ Weichselbaum A: Ueber die Aetiologie der akuten Meningitis cerebro-spinalis. In: Fortschrift der Medizin. 5, 1887, S. 573–583.
- ↑ Flexner S: The results of the serum treatment in thirteen hundred cases of epidemic meningitis. (PDF) In: J Exp Med. 17, 1913, S. 553–76. doi:10.1084/jem.17.5.553.
- ↑ a b Swartz MN: Bacterial meningitis--a view of the past 90 years. In: The New England Journal of Medicine. 351, Nr. 18, Oktober 2004, S. 1826–1828. doi:10.1056/NEJMp048246. PMID 15509815.
- ↑ Rosenberg DH, Arling PA: Penicillin in the treatment of meningitis. In: JAMA. 125, 1944, S. 1011–1017. reproduced in Rosenberg DH, Arling PA: Penicillin in the treatment of meningitis. In: JAMA. 251, Nr. 14, April 1984, S. 1870–6. doi:10.1001/jama.251.14.1870. PMID 6366279.

Bitte den Hinweis zu Gesundheitsthemen beachten! 
Dieser Artikel wurde am 31. August 2011 in dieser Version in die Liste der exzellenten Artikel aufgenommen. Kategorien:- Wikipedia:Exzellent
- Krankheitsbild in der Neurologie
- Krankheitsbild in der Notfallmedizin
- Infektionskrankheit
- S1-Leitlinie Bakterielle (eitrige) Meningoenzephalitis der Deutschen Gesellschaft für Neurologie. In: AWMF online (Stand 2008)
Wikimedia Foundation.