- 3-Kresol
-
Kresole Name o-Kresol m-Kresol p-Kresol Andere Namen 1,2-Methylphenol,
1,2-Hydroxytoluol1,3-Methylphenol,
1,3-Hydroxytoluol1,4-Methylphenol,
1,4-HydroxytoluolStrukturformel 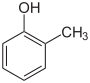


CAS-Nummer 95-48-7 108-39-4 106-44-5 1319-77-3 (Isomerengemisch)[1] PubChem 2879 342 335 Summenformel C7H8O Molare Masse 108,14 g·mol−1 Aggregatzustand fest flüssig fest Kurzbeschreibung farblose bis gelbliche Kristalle bzw. Flüssigkeit Schmelzpunkt 31 °C[2] 10,9 °C[3] 34,8 °C[4] Siedepunkt 191 °C[2] 203 °C[3] 202 °C[4] pKs-Wert[5] 10,28 10,09 10,26 Dichte 1,05 g·cm−3 1,03 g·cm−3 1,03 g·cm−3 Löslichkeit 26,0 g·l−1 (25 °C) 31 g·l−1 (20 °C) 20,0 g·l−1 (20 °C) Gefahrstoff-
kennzeichnung
[2][3][4]
Giftig (T) R-Sätze 24/25-34 S-Sätze (1/2)-36/37/39-45 Die Kresole (auch Hydroxytoluole bzw. Methylphenole) bilden eine Stoffgruppe aromatischer Verbindungen, die sich sowohl vom Toluol als auch vom Phenol ableiten. Die Kresole bestehen aus einem planaren Benzolring mit angefügter Hydroxy- (–OH) und Methylgruppe (–CH3). Je nach Position spricht man von ortho-, meta- oder para-Kresol. Darüber hinaus spricht man bei den halogenierten Derivaten ebenfalls von Kresolen.
Inhaltsverzeichnis
Vorkommen
Kresole und deren Derivate (z. B. Xylenole) sind in der Natur weit verbreitet. Man findet sie als Metaboliten in verschiedenen Mikroorganismen sowie im Urin von Säugetieren, im Steinkohlen- und Buchenholzteer.
Darstellung
Ursprünglich wurden die nicht derivatisierten Kresole aus Steinkohlen- und Buchenholzteer isoliert. Man erhält ein flüssiges, gelbbraunes Isomerengemisch, das so genannte Trikresol. Einmalige Destillation führt zur rohen Carbolsäure. Die Reinherstellung der drei Kresole erfolgt auf Grundlage von Carbolöl durch Extraktion mit Natronlauge. Alternativ wird das Phenoraffin-Verfahren durchgeführt, bei dem zur Extraktion eine Natriumphenolat-Lösung und Diisopropylether eingesetzt werden.
Synthetisch können Kresole durch Verkochung des jeweiligen Diazoniumsalzes der Toluidine dargestellt werden.
Eigenschaften
Kresole sind stark licht- und luftempfindlich. Bei Temperaturen oberhalb von 80 °C bilden sich mit Luft explosionsfähige Gemische. Sie sind in Wasser schlecht löslich und verbrennen unter starker Rußentwicklung. Kresole haben einen teerartigen Geruch. Mit Propen reagiert m-Kresol zu Thymol.
pKs-Wert
Die Methylgruppe übt einen (schwachen) +I-Effekt auf den Aromaten aus, wodurch die Elektronendichte im Ring erhöht wird. Dadurch wird u. a. die Acidität des phenolischen OH abgeschwächt. Die pKs-Werte sind daher etwas höher als die des Phenols (9,99[5]).
Reaktivität
Neben dem (schwachen) +I-Effekt der Methylgruppe ist jedoch der +M-Effekt der Hydroxygruppe entscheidender für die chemische Reaktivität. Beide Effekte erhöhen deutlich die Elektronendichte im Ring. Der −I-Effekt der Hydroxygruppe hat nur sehr wenig Einfluss auf die Eigenschaften der Kresole. Die Kresole gehen daher relativ leicht elektrophile aromatische Substitutionen ein.
Verwendung
Kresole wirken als Bakterizid, Insektizid und Fungizid. Sie sind deshalb vielfach Bestandteil von Desinfektionsmitteln wie zum Beispiel Lysol, Sagrotan oder Bacillol. m-Kresol findet als Fungizid in der Landwirtschaft Anwendung. 8 µl/g genügen, um Getreide 60 Tage lang bei einer Lagertemperatur von 30 °C frei von Pilzbefall zu halten.
Kresole werden auch verwendet, um daraus Kunst- und Farbstoffe, Kunstharze (Kresolharze) und Arzneimittel herzustellen. In der Homöopathie wird ein unter dem Namen Cresolum crudum bekanntes, aus Steinkohlenteer gewonnenes Rohkresol bei Entzündungen, Hautkrankheiten und Lähmungen eingesetzt.
Toxikologie
Kresol-Vergiftungen rufen recht unspezifische Symptome hervor. Anzeichen einer chronischen Vergiftung sind Kopfschmerzen, Husten- und Brechreiz, Appetitverlust sowie Mattheit und Schlaflosigkeit. Eine Aufnahme über die Haut durch Resorption erfolgt sehr schnell. Akute Vergiftungen mit Nierenschäden und Störungen des Zentralnervensystems wie Krämpfen, Bewusstlosigkeit und Atemlähmung können die Folge sein. Kresole gelten als kanzerogen.
Wie bei Phenolen allgemein kommt es bei oraler Einnahme zu (weißlichen) Verätzungen, welche schmerzlos sind, da Phenole anästhetisch wirken. Vergiftungserscheinungen treten beim Menschen ab etwa 3 g auf, ab etwa 10 g besteht die Möglichkeit eines tödlichen Schocks.
Darüber hinaus wirken Phenole und insbesondere Kresole stark eiweißzersetzend. Da sie stark ätzend wirken, rufen sie bei Hautkontakt akute Hautschäden hervor, zerstören das Eiweiß der Hautzellen und überwinden den Schutzmechanismus der Haut, welcher leicht sauer ist, beinahe sofort. Bei Kontamination offener Schleimhäute (Mundhöhle, Nase, After) gelangen sie direkt ins Blut, wobei sie im Körper rasch verteilt werden und zu multiplen Eiweißschädigungen der inneren Organe führen. Ohne sofortige Einleitung von Gegenmaßnahmen können Kresole auch in geringer Menge letale Wirkung haben.
Nachweis
Kresole können schon in Konzentrationen von wenigen Mikrogramm pro Kubikmeter Luft geruchlich wahrgenommen werden.
Einzelnachweise
- ↑ Eintrag zu CAS-Nr. 1319-77-3 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 25. März 2008 (JavaScript erforderlich).
- ↑ a b c Eintrag zu o-Kresol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 6. März 2008 (JavaScript erforderlich).
- ↑ a b c Eintrag zu m-Kresol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 6. März 2008 (JavaScript erforderlich).
- ↑ a b c Eintrag zu p-Kresol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 6. März 2008 (JavaScript erforderlich).
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
Literatur
- Klemm, Elias: Direktsynthese von Phenol und Kresol. Vom Katalysator zum Verfahren., Shaker Verlag GmbH 2002, ISBN 3-8265-9896-2.
- Autorenkollektiv: Organikum, 22. Auflage, Wiley-VCH, Weinheim, 2004, ISBN 3-527-31148-3.
Weblinks
Wikimedia Foundation.
