- Mycobacterium tuberculosis
-
Mycobacterium tuberculosis 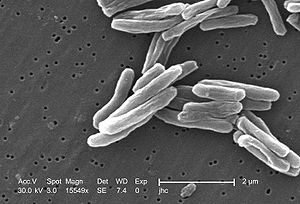
Mycobacterium tuberculosis
Systematik Abteilung: Actinobacteria Klasse: Actinobacteria Ordnung: Actinomycetales Familie: Mycobacteriaceae Gattung: Mycobacterium Art: Mycobacterium tuberculosis Wissenschaftlicher Name Mycobacterium tuberculosis (Zopf 1883) Lehmann & Neumann 1896 Mycobacterium tuberculosis ist ein Bakterium aus der Familie der Mykobakterien. Es handelt sich um den wichtigsten Erreger der Tuberkulose beim Menschen. Auch Tiere können durch M. tuberculosis an Tuberkulose erkranken.
Inhaltsverzeichnis
Eigenschaften
M. tuberculosis ist ein gram-positives, stäbchenförmiges, zur aktiven Bewegung unfähiges Bakterium. Die Bakterien sind säurefest und lassen sich daher mit der Ziehl-Neelsen-Färbung sowie mit speziellen Fluoreszenzfarbstoff-Färbungen (z. B. Auramin-Färbung) mikroskopisch von nicht säurefesten Bakterien und anderen nicht säurefesten Objekten unterscheiden. Die Bakterienzellwand enthält unter anderem Arabinogalaktan und Mykolsäuren, die neben anderen lipophilen Zellwandbestandteilen für die Säurefestigkeit verantwortlich sind.
Weitere charakteristische Eigenschaften sind sein extrem langsames Wachstum (15 bis 20 Stunden bis zur Teilung), die Fähigkeit, schwachen Desinfektionsmitteln zu widerstehen, Aerobie und intrazelluläre Pathogenese. Das Bakterium besitzt die Fähigkeit, in Makrophagen (Fresszellen des Immunsystems) ruhend zu überleben und, nach Jahren wieder aufwachend, sich dann zu teilen (Dormanz). Auf genomischer Ebene codiert ein ungewöhnlich großer Teil seiner Gene für die Produktion von lipolyse- (fettspaltenden) und lipogenesefähigen (Fettsynthese) Enzymen. Dabei ist das Bakterium nicht nur in der Lage, von den eigenen in der Zellwand deponierten Fettschicht zu leben, sondern auch externes Cholesterin, das während der Infektion im Menschen gefunden wird, zu sammeln und zu verwerten.[1]
Intrazelluläre Pathogenese
M. tuberculosis hat mehrere Mechanismen entwickelt, um im Phagosom überleben zu können: er besitzt zunächst eine wachsartige, fettreiche Zellwand, die es ihm ermöglicht, sich gegen seine Zerstörung innerhalb der Immunabwehr zu wehren. Das Phagosom ist nicht in der Lage, die äußere Schicht der Zellwand des Erregers aufzuspalten. Außerdem enthält die äußere Wachsschicht Lipoarabinomannan (LAM), ein Glycolipid, das, zusammen mit einer Phosphatase die Signaltransduktion des Phagosoms stört, so dass diese nicht das volle Zerstörungsprogramm fährt.[2]
Des Weiteren werden vom Bakterium mehrere Enzyme (Katalase, Superoxid-Dismutase und andere) ausgeschieden, die jede Gefahr durch reaktive Sauerstoff- und Stickstoffspezies ausschalten (die Katalase wirkt auch als Peroxinitritase). Zuletzt bringt sich das Bakterium in einen winterschlafähnlichen Zustand (Dormanz), in dem keine DNA-Replikation und Zellteilung stattfindet, und der Organismus auf Sparflamme anaerob von der eigenen Fettschicht lebt. Dadurch werden viele Antibiotika unwirksam, die sonst in die normalen Zellprozesse eingreifen.[3][4]
Hinzu kommt eine erhöhte Mutationsrate durch Ablesefehler der DNA-Polymerase sowie durch von den Makrophagen erzeugte reaktive Sauerstoffspezies (ROS), die auch bei latenter Infektion die DNA des Bakteriums schädigen und zu Mutationen führen. Das bedeutet, dass das Bakterium auch dann Resistenzen entwickeln kann, wenn es sich nicht teilt.[5]
Infektion, Erkrankung, Therapie beim Menschen
- → Hauptartikel: Tuberkulose
Die Übertragung erfolgt in der Regel durch eine Tröpfcheninfektion. Die Haupteintrittspforte ist die Lunge. Die Infektion der Lungen führt zur Knötchenbildung und Zerstörung des Lungengewebes sowie zur Streuung tuberkulöser Herde im Körper. Unterernährte und geschwächte Menschen sind besonders anfällig für die Erkrankung. Heute ist etwa jeder dritte Mensch auf der Welt mit Mycobacterium tuberculosis infiziert. Vor allem in Dritte-Welt-Ländern fällt die Behandlung mit Antibiotika schwer, da sie sich über Monate hinzieht. Darüber hinaus gibt es immer mehr Fälle, bei denen der Erreger gegenüber vielen Antibiotika resistent ist. Jedes Jahr fordert Tuberkulose 2 Millionen Todesfälle und ist neben AIDS und Malaria die weltweit am weitesten verbreitete Infektionskrankheit.
Infektion und Erkrankung bei Nutz- und Haustieren
Tiere infizieren sich stets durch an offener Tuberkulose erkrankte Menschen. Rinder sind dadurch nicht nur von der Variante M. bovis betroffen; in Äthiopien beispielsweise wurde bei bis zu einem Viertel der freilaufenden Tiere M. tuberculosis gefunden, während eingezäunte Tiere teilweise mit M. bovis infiziert waren. Ursache ist wahrscheinlich die Angewohnheit der dortigen Hirten, Rindern ins Maul zu spucken.[6]
Beobachtet wurde eine Erkrankung weiters bei Schweinen, Pferden, Schafen und Ziegen. Hühner sind weitgehend resistent gegen M. tuberculosis. Bei erkrankten Tieren entwickelt sich meist nur ein schnell abheilender örtlicher Prozess. In solchen Fällen ist es angeraten, die betreuenden Menschen auf Tuberkulose zu untersuchen.
Wesentlich ernster ist die Infektion von Haustieren, die mit dem Menschen in enger häuslicher Gemeinschaft leben. Hunde, Katzen und möglicherweise Papageien werden zuerst von offen tuberkulösen Menschen angesteckt, entwickeln selbst eine meist offene Tuberkulose und bilden dadurch eine gefährliche Ansteckungsquelle für Menschen, die mit ihnen in Kontakt kommen.
Antibiotikaresistenz
M. tuberculosis ist aufgrund mehrerer Eigenschaften in der Lage, Antibiotika unschädlich zu machen. Insbesondere die Undurchlässigkeit der äußeren wachsartigen Zellwand führt dazu, dass Fremdstoffe nur über Transportproteine aufgenommen werden, die sehr selektiv sein können. Weiterhin sind mehrere der funktionierenden Antibiotika auf eine Aktivierung durch Bakterienenzyme angewiesen (Prodrug). Viele andere werden von Effluxpumpen effektiv aus der Zelle entfernt. Zuletzt sind die Angriffspunkte der Antibiotika durchweg Enzyme oder Ribosomen. Da an allen diesen Prozessen Proteine beteiligt sind, genügt oft eine Mutation an der richtigen Position im Protein, entweder einen Angriffspunkt zu beseitigen, aktivierende Enzyme zu deaktivieren, Effluxpumpen zu überexprimieren, oder den Import zu spezialisieren, damit ein Antibiotikum seinen Effekt auf das Bakterium einbüßt und eine Resistenz entsteht. Im Folgenden eine Tabelle der bekannten Antibiotika bei M. tuberculosis mit ihren Wirk- und Resistenzmechanismen:[7]
Antibiotikum Wirkort Resistenz-
gen(e)Resistenzmechanismus Isoniazid, Ethionamid (Prodrug) Fettsäuresynthese katG, ahpC, ndh Verlust der Aktivierung inhA Mutation am Angriffspunkt Rifampicin Elongation der mRNA-Transkription rpoB Mutation am Angriffspunkt Pyrazinamid (Prodrug) Trans-Translation[8] pncA Verlust der Aktivierung Streptomycin Initiation der Translation rpsL Mutation am Angriffspunkt Ethambutol Arabinogalactan-Biosynthese embB, ? Mutation am Angriffspunkt Fluorchinolone DNA-Replikation gyrA, gyrB Mutation am Angriffspunkt ? Effluxpumpen MfpA ? Kanamycin Translation rrs Verlust der Ribosemethylierung eis Abbau des Antibiotikums[9] 4-Aminosalicylsäure (Prodrug) ? thyA? ? Makrolide Translation erm37 Ribosemethylierung Linezolid, PNU100480 Initiation der Translation (23S rRNA) Mutation am Angriffspunkt D-Cycloserin Peptidoglykan-Synthese alr Mutation am Angriffspunkt TMC207 ATP-Synthese atpE, ? Mutation am Angriffspunkt PA-824, OPC-67683 (Prodrug) Lipid-Synthese? Rv3547 Verlust der Aktivierung Multiresistenz
Gebräuchliche Abkürzungen:
- MDR-TB: multiresistentes Tuberkulosebakterium
- XDR-TB: extrem resistentes Tuberkulosebakterium
Als multiresistent werden M. tuberculosis-Stämme bezeichnet, die mindestens eine Resistenz auf die TB-Standardantibiotika Isoniazid und Rifampicin aufweisen. Die erste größere MDR-TB-Epidemie fand Anfang der 1990er Jahre in New York statt und betraf hauptsächlich HIV-Infizierte und medizinisches Personal. Im Jahr 2007 waren weltweit etwa 20 Prozent aller Isolate multiresistent.[10][11]
Extrem resistent heißen diejenigen MDR-TB-Stämme mit zusätzlicher Resistenz gegen mindestens ein Fluorchinolon-Antibiotikum und mindestens eines der Medikamente Capreomycin, Kanamycin oder Amikazin. Einer der ersten XDR-TB-Ausbrüche fand 2005 in einem ländlichen Krankenhaus in KwaZulu-Natal statt. Die Gefahr solcher Epidemien ist nicht auf Afrika beschränkt, da XDR-TB inzwischen auf sechs Kontinenten zu finden ist und durchschnittlich im Jahr 2007 etwa 10 Prozent der MDR-TB-Fälle ausmachte.[11][12][13]
Mittlerweile treten auch bei Linezolid immer mehr Resistenzen auf.[14]
Geschichte
Das Bakterium wurde 1882 von Robert Koch entdeckt und erstmals isoliert. Durch Züchtung in Reinkultur und Tierexperimente konnte er in Form der Kochschen Postulate nachweisen, dass die Tuberkulose durch M. tuberculosis verursacht wird.
Mycobacterium tuberculosis wird auf einen rund 40.000 Jahre alten Vorgänger zurückgeführt, auf den auch Mycobacterium leprae als auch das Mycobacterium bovis zurückgeführt werden.[15]
Einzelnachweise
- ↑ A. Brzostek, J. Pawelczyk u.a.: Mycobacterium tuberculosis is able to accumulate and utilize cholesterol. In: J. Bacteriol. Band 191, Nummer 21, November 2009, S. 6584–6591, ISSN 1098-5530. doi:10.1128/JB.00488-09. PMID 19717592. PMC PMC2795286.
- ↑ Briken V, Porcelli SA, Besra GS, Kremer L: Mycobacterial lipoarabinomannan and related lipoglycans: from biogenesis to modulation of the immune response. In: Mol. Microbiol.. 53, Nr. 2, Juli 2004, S. 391–403. doi:10.1111/j.1365-2958.2004.04183.x. PMID 15228522.
- ↑ Hestvik AL, Hmama Z, Av-Gay Y: Mycobacterial manipulation of the host cell. In: FEMS Microbiol. Rev.. 29, Nr. 5, November 2005, S. 1041–50. doi:10.1016/j.femsre.2005.04.013. PMID 16040149.
- ↑ Deretic V, Singh S, Master S, et al.: Mycobacterium tuberculosis inhibition of phagolysosome biogenesis and autophagy as a host defence mechanism. In: Cell. Microbiol.. 8, Nr. 5, Mai 2006, S. 719–27. doi:10.1111/j.1462-5822.2006.00705.x. PMID 16611222.
- ↑ C. B. Ford, P. L. Lin u.a.: Use of whole genome sequencing to estimate the mutation rate of Mycobacterium tuberculosis during latent infection. In: Nat. Genet. Band 43, Nummer 5, Mai 2011, S. 482–486, ISSN 1546-1718. doi:10.1038/ng.811. PMID 21516081. PMC 310187.
- ↑ G. Ameni, M. Vordermeier u.a.: Mycobacterium tuberculosis infection in grazing cattle in central Ethiopia. In: Veterinary journal (London, England : 1997) Band 188, Nummer 3, Juni 2011, S. 359–361. doi:10.1016/j.tvjl.2010.05.005. PMID 20965132. PMC 310382.
- ↑ P. E. Almeida Da Silva, J. C. Palomino: Molecular basis and mechanisms of drug resistance in Mycobacterium tuberculosis: classical and new drugs. In: The Journal of antimicrobial chemotherapy. Band 66, Nummer 7, Juli 2011, S. 1417–1430, ISSN 1460-2091. doi:10.1093/jac/dkr173. PMID 21558086. (Review).
- ↑ W. Shi, X. Zhang u.a.: Pyrazinamide inhibits trans-translation in Mycobacterium tuberculosis. In: Science (New York, N.Y.). Band 333, Nummer 6049, September 2011, S. 1630–1632, ISSN 1095-9203. doi:10.1126/science.1208813. PMID 21835980.
- ↑ W. Chen, T. Biswas u.a.: Unusual regioversatility of acetyltransferase Eis, a cause of drug resistance in XDR-TB. In: Proceedings of the National Academy of Sciences of the United States of America. Band 108, Nummer 24, Juni 2011, S. 9804–9808. doi:10.1073/pnas.1105379108. PMID 21628583. PMC 3116390.
- ↑ T. R. Frieden, L. F. Sherman u.a.: A multi-institutional outbreak of highly drug-resistant tuberculosis: epidemiology and clinical outcomes. In: JAMA Band 276, Nummer 15, Oktober 1996, S. 1229–1235, ISSN 0098-7484. PMID 8849750.
- ↑ a b N. S. Shah, A. Wright u.a.: Worldwide emergence of extensively drug-resistant tuberculosis. In: Emerging Infect. Dis. Band 13, Nummer 3, März 2007, S. 380–387, ISSN 1080-6040. PMID 17552090. PMC 272591.
- ↑ M. C. Raviglione, I. M. Smith: XDR tuberculosis–implications for global public health. In: N. Engl. J. Med. Band 356, Nummer 7, Februar 2007, S. 656–659, ISSN 1533-4406. doi:10.1056/NEJMp068273. PMID 17301295.
- ↑ N. R. Gandhi, A. Moll u.a.: Extensively drug-resistant tuberculosis as a cause of death in patients co-infected with tuberculosis and HIV in a rural area of South Africa. In: Lancet Band 368, Nummer 9547, November 2006, S. 1575–1580, ISSN 1474-547X. doi:10.1016/S0140-6736(06)69573-1. PMID 17084757.
- ↑ Thomas Schwantzer: Therapieresistente Tuberkulose – Die WHO warnt vor mehrfach medikamenten-resistenten Stämmen! In: www.gesund.co.at. GKA Domainverwertung, 14. April 2008, abgerufen am 18. November 2009.
- ↑ Z Djelouadji, D Raoult, M Drancourt : Palaeogenomics of Mycobacterium tuberculosis: epidemic bursts with a degrading genome. Lancet Infect Dis. 13 June 2011doi:10.1016/S1473-3099(11)70093-7
Literatur
- Karl Bernhard Lehmann, Rudolf Otto Neumann: Atlas und Grundriss der Bakteriologie und Lehrbuch der speciellen bakteriologischen Diagnostik. Lehmann, München 1896.
- W. Köhler et al.: Medizinische Mikrobiologie. Urban & Fischer-Verlag München/Jena 2001, 8. Auflage. ISBN 3-437-41640-5
- I. Comas, S. Gagneux: The past and future of tuberculosis research. In: PLoS Pathog. Band 5, Nummer 10, Oktober 2009, S. e1000600, ISSN 1553-7374. doi:10.1371/journal.ppat.1000600. PMID 19855821. PMC PMC2745564. (Review).
Weblinks
 Commons: Mycobacterium tuberculosis – Sammlung von Bildern, Videos und Audiodateien
Commons: Mycobacterium tuberculosis – Sammlung von Bildern, Videos und Audiodateien- Genom von Mtu ATCC 25618 / H37Rv beim Sanger Institut (erstes sequenziertes Genom)
- TB Structural Genomics Consortium
- TubercuList am EPFL (Genom-Datenbank; letztes Update 2011)
- TubercuList am Pasteur-Institut (Genom-Datenbank; letztes Update 2008-Oct)
- TB Database (vergleichende Genomik-Datenbank)
- MycoRegNet - Mycobacterial Transcription Factors and Regulatory Networks (Datenbank bei der Uni Bielefeld)
- TBrowse - TB Genomics Wiki @osdd
Kategorien:- Tuberkulose
- Mykobakterien
- Meldepflichtiger Erreger
- Mycobacterium
Wikimedia Foundation.

